原子力显微镜研究L-半胱氨酸对鲢肌球蛋白溶液热聚集行为的影响
王艳敏,于加美,石 彤,袁 丽,高瑞昌*
(江苏大学食品与生物工程学院,江苏 镇江 212013)
肌球蛋白是重要的功能性蛋白质,约占肌原纤维蛋白的55%~60%,占总蛋白的30%左右[1]。诸多研究发现,肌肉组织的凝胶性、持水性和乳化性等均与肌球蛋白结构存在密切的联系[2]。肌球蛋白是一种长形不对称小分子,包含两条长链构成的杆状尾部和两条短链构成的球状头部,且为盐溶性蛋白[3],在体外高盐条件下(0.6 mol/L KCl)蛋白分子主要以单体或可溶性寡聚体的形式存在[4-5],在低盐条件下由于肌球蛋白纤丝自发聚集因而表现出低的溶解度[6-9],对于盐溶性蛋白合适的盐浓度有利于形成理想的凝胶,但是过量的盐则会诱发心血管和高血压等疾病[10-12],因此,降低盐浓度的同时提高肌球蛋白溶解度的研究很有必要。
赖氨酸、组氨酸、精氨酸能提高低盐条件下肌球蛋白的溶解度[13-16],但同时肌球蛋白的热聚集行为也发生了较大变化。Shiraki等[17]报道赖氨酸、精氨酸、甘氨酸等氨基酸能够阻止蛋白质的聚集,且相应带电侧链起主要作用,亲水性的氨基酸比疏水性氨基酸作用更明显。然而报道多从蛋白溶解度和构象研究氨基酸对蛋白的影响,利用更加直观的手段研究氨基酸对蛋白聚集行为的影响鲜见报道。目前已有学者利用原子力显微镜(atomic force microscope,AFM)技术研究了蛋白溶液聚集状态[18-20]。利用该技术比较添加氨基酸前后肌球蛋白溶液聚集行为形貌的变化,可从微观角度直观反映半胱氨酸对肌球蛋白聚集行为的影响。AFM的应用日益广泛,其在蛋白质、核糖核酸、脱氧核糖核酸、核酸与蛋白质复合物、病毒、细胞等生物大分子上的应用也一直吸引着生物学家的目光[21-24]。AFM利用纳米级尺寸及pN级力灵敏度的探针在样品表面进行逐级光栅扫描得到样品表面的形貌[25]。基于现有研究,利用AFM观察蛋白质聚集过程中的微观形态的变化可行且更加直观,弥补了现有研究手段的不足。L-半胱氨酸(L-Cys)是一种亲水性氨基酸,也是一种还原剂,能够通过改变蛋白质分子之间和内部的二硫键减弱蛋白质的结构,使蛋白质伸展开。周爱梅等[26]曾报道L-Cys可显著提高鳙鱼鱼糜的凝胶能力,对颜色和白度不会产生不利影响,是鳙鱼鱼糜的良好品质改良剂。本实验研究L-Cys对鲢肌球蛋白热聚集行为的影响,利用AFM观测L-Cys存在条件下鲢肌球蛋白热聚集行为形貌的变化,并改变离子强度来观察肌球蛋白的聚集状态及溶解度的变化,从而在降低淡水鱼凝胶制品盐添加量的同时提高肌球蛋白的溶解度,为生产低盐淡水鱼产品提供参考。
1 材料与方法
1.1 材料与试剂
新鲜的花鲢鱼在镇江市学府路欧尚超市购得,用碎冰块保持低温30 min内带回实验室,取鲢鱼背部白肉、去骨、清洗,切成肉糜状备用。
三(羟甲基)氨基甲烷(trihydroxymethyl aminomethane,Tris)、L-Cys(均为分析纯) 国药集团化学试剂有限公司;8-苯胺基萘-1-磺酸盐(N-phenyl-8-naphthylamine-1-sulfonic acid,ANS)(化学纯)上海阿拉丁生化科技股份有限公司;其他化学试剂均为国产分析纯。
试剂A:0.1 mol/L氯化钾、20 mmol/L Tris,盐酸调节pH值至7.5。试剂B:0.45 mol/L氯化钾、0.2 mol/L乙酸镁、1 mmol/L乙二醇双(2-氨基乙基醚)四乙酸、20 mmol/L Tris、5 mmol/L β-巯基乙醇,马来酸调节pH值至6.8。试剂C:0.5 mol/L氯化钾、20 mmol/L Tris、5 mmol/L β-巯基乙醇,盐酸调节pH值至7.5。8 mmol/L ANS-磷酸缓冲液:将ANS溶解于0.1 mol/L pH 7.0的磷酸缓冲液中。
1.2 仪器与设备
Multimode 8 AFM 美国布鲁克公司;Avanti J-26XP超高速冷冻离心机 德国贝克曼库尔特有限公司;TGL-16gR飞鸽牌系列离心机 上海安亭科学仪器厂;IKA T18 分散仪 德国IKA 公司;UV1600紫外-可见分光光度计 北京瑞利分析仪器;Cary Eclipse荧光分光光度计 美国Varian公司;FE 20 pH计 梅特勒-托利多仪器(上海)有限公司。
1.3 方法
1.3.1 不同离子强度肌球蛋白溶液的制备
参考Jia Dan等[27]的方法并稍作修改。取新鲜花鲢鱼背部肉糜,加入10 倍体积试剂A,利用均质机在11 000 r/min条件下均质6 min,每隔10 s暂停10 s。置于4 ℃反应15 min,离心(3 000×g、6 min、4 ℃),取沉淀物量体积,加入5 倍体积试剂B,同时加入腺苷-5’-三磷酸二钠盐水合物,使其终浓度为10 mmol/L的悬浮液,置于4 ℃冰箱静置90 min,离心(11 000×g,13 min,4 ℃),量取上清液,加入5 倍体积的1 mmol/L碳酸氢钾溶液,4 ℃条件下放置20 min,离心(11 000×g、13 min、4 ℃),量取沉淀物,加入2.5 倍体积试剂C,4 ℃反应10 min,往悬浮液中加入5 倍体积的1 mmol/L碳酸氢钾溶液,并加入氯化镁,使混合液终浓度为10 mmol/L,置于4 ℃冰箱过夜。离心(11 000×g、25 min、4 ℃),量取沉淀,得到肌球蛋白颗粒。得到的肌球蛋白颗粒,分别溶解在0.5 mol/L和0.1 mol/L NaCl-20 mmol/L Tris-HCl(pH 7.0)缓冲液中,离心(5 000×g,10 min,4 ℃),取上清液,得到不同离子强度条件下的肌球蛋白溶液备用。分别用双缩脲法[28]检测上清液中蛋白含量,并进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,用Gel-Pro analyzer软件采用光密度法,对肌球蛋白的纯度进行定量分析,肌球蛋白的纯度超过90%,与Liu Ru等[29]的结果一致,满足实验要求。
1.3.2 L-Cys对肌球蛋白溶液溶解度的影响
肌球蛋白溶液的终质量浓度为0.5 mg/mL[16],加入L-Cys溶液(pH 7.0)使其终浓度为5 mmol/L[13-14],混匀。将样品分别进行一段式加热(90 ℃、30 min)、二段式加热(40 ℃、60 min+90 ℃、30 min)处理[30],以不加热作为对照组。参考Guo等[13]的方法,用高速冷冻离心机4 ℃、5 000 r/min离心10 min,分离后取上清液测蛋白浓度,溶解度按下式计算:

1.3.3 L-Cys对肌球蛋白溶液表面疏水性的影响
将分别溶于0.5 mol/L和0.1 mol/L NaCl-20 mmol/L Tris-HCl缓冲液中的新鲜肌球蛋白溶液逐步稀释成终质量浓度分别为0.062 5、0.125、0.25 mg/mL和0.5 mg/mL的溶液,同时加入5 mmol/L的L-Cys溶液(pH 7.0)。参照Yongsawatdigul等[31]的方法,取各质量浓度溶液各4 mL,逐个加入8 mmol/L的ANS 40 μL,黑暗处反应10 min,用0.5 mol/L和0.1 mol/L NaCl-20 mmol/L Tris-HCl缓冲液做空白对照。荧光分光光度计狭缝校正设定为5 nm,激发波长和发射波长经实验后分别设定为375 nm和475 nm,测定肌球蛋白样品的荧光强度。以相对荧光强度对肌球蛋白浓度作图,初始段的斜率即为肌球蛋白的表面疏水性指标。
1.3.4 AFM样品制备及观察
1.3.4.1 AFM样品的制备
提前将云母片剪成5 mm×5 mm大小,用双面胶黏在具有铁磁性物质如直径约为1 cm的铁片上,铁片厚度不超过1 mm;将蛋白溶液稀释至20 μg/mL,用双面胶将云母片外表层剥离,准确吸取6 μL蛋白-L-Cys混合液滴于新剥离的云母片表面,室温条件下在超净台内自然干燥,形成蛋白吸附层;为消除盐分的干扰,用纯净水(30 ℃,35 μL)冲洗吸附层5 次,超净台内自然干燥,所有操作均在超净台内进行。扫描前样品存放在带盖培养皿中,避免空气中的灰尘落在样品表面干扰扫描。
1.3.4.2 AFM样品成像
AFM探针为商用氮化硅针尖,型号为TAP 150(MPP-12100-10),操作模式为分子力模式,微悬臂的长度、厚度、宽度分别为1.5~2.5、115~135、25~35 μm,共振频率为150~200 kHz,弹性系数为5 N/m。本实验图像扫描范围均为5 μm×5 μm,每个样品至少选取10 个不同区域进行扫描,确保得到可重复的高质量图像,所有图像均在NanoScope Analysis离线软件上进行,图片只进行Flatten平整化处理,以消除慢扫描方向上的低频噪音造成的倾斜、扭曲、跳线等的影响,对每条扫描线进行补偿,使得到的图像更加真实。
2 结果与分析
2.1 L-Cys对肌球蛋白溶解度的影响
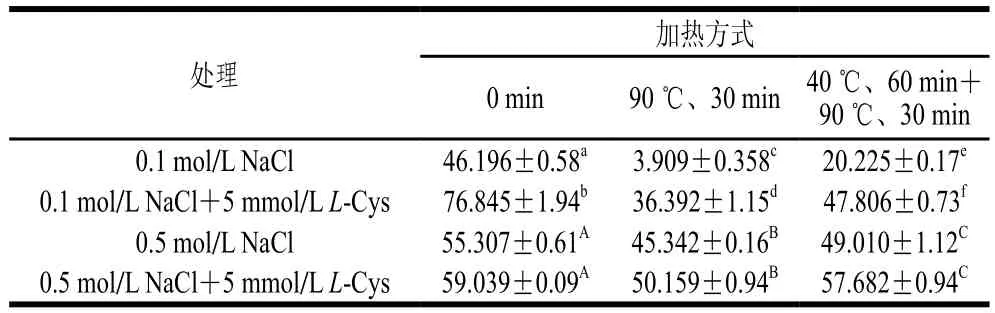
表1 L-Cys对肌球蛋白溶解度的影响Table 1 Effect of L-Cys on the solubility of myosin solutions%
表1表明L-Cys的添加能影响肌球蛋白的溶解度。未添加L-Cys时,高离子强度条件下肌球蛋白的溶解度均高于低离子强度,原因可能是静电作用力和表面疏水性的变化改变了肌球蛋白的构象[32]。在低离子强度添加L-Cys的条件下,未加热、一段式加热、二段式加热时溶解度分别显著提高了30.649%、32.483%、27.581%(P<0.05);高离子强度时则分别提高了3.732%、
4.817%、8.672%,但无显著性差异(P>0.05)。该结果表明5 mmol/L的L-Cys在低盐时作用更明显,与周春霞等[33]的研究结果一致,高离子强度环境中,由于大量氯离子的存在,电荷屏蔽作用显著,L-Cys所带负电荷被屏蔽。Takai等[15]曾报道低离子强度时蛋白可能更趋向于自组装,形成较大的纤丝体,然而低离子环境中,电荷屏蔽作用较小,L-Cys所带负电荷围绕在肌球蛋白周围增加了静电斥力,阻止了自组装,从而提高了肌球蛋白的溶解度。另一方面,L-Cys具有还原基团巯基(-SH)可能会改变蛋白质分子内部的二硫键,影响蛋白质的结构,从而减弱肌球蛋白分子之间的聚集,L-Cys与肌球蛋白之间的特异性作用在低盐条件下更显著。
2.2 L-Cys对肌球蛋白溶液表面疏水性的影响
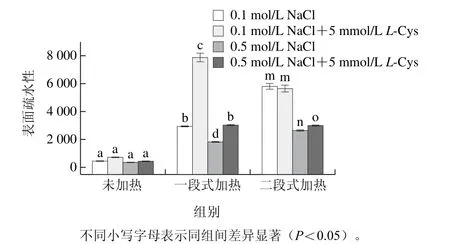
图1 L-Cys对肌球蛋白溶液表面疏水性的影响Fig. 1 Eff ect of L-Cys on the surface hydrophobicity of myosin solutions
图1表明未加热时,在高/低盐环境中,添加L-Cys对肌球蛋白溶液的表面疏水性均无显著性影响(P>0.05)。一段式加热时,高/低盐环境中,L-Cys均能显著提高肌球蛋白的表面疏水性(P<0.05)。二段式加热时,低盐环境中,L-Cys的加入对肌球蛋白溶液的表面疏水性未产生显著影响(P>0.05);高盐环境中,L-Cys能显著提高肌球蛋白的表面疏水性(P<0.05)。当蛋白变性展开,疏水基团暴露,肌球蛋白的表面疏水性增大。未加热时,肌球蛋白展开程度低,暴露的疏水位点较少,L-Cys作用不足以显著改变肌球蛋白的表面疏水性。一段式加热时,加热温度过高,肌球蛋白快速变性展开,暴露出大量疏水位点,但此时肌球蛋白的聚集速率大于展开速率,使部分疏水性位点重新被掩埋,但L-Cys的加入缓解了肌球蛋白的聚集,减少了疏水位点被掩埋,因而表现出较高的表面疏水性,原因可能是L-Cys特有的侧链结构抑制肌球蛋白的聚集,与Shiraki等[17]的研究结果一致。二段式加热时,高/低盐环境中,L-Cys对表面疏水性的影响具有不同的趋势,但数值上较一段式均未大幅度提高表面疏水性,原因可能是经过预加热阶段肌球蛋白充分展开,展开速率大于聚集速率,在低温凝胶化阶段肌球蛋白通过二硫键和疏水键发生有序聚集形成三维网络结构[33],再经90 ℃加热时疏水性位点相比一段式加热被掩埋的相对较少,从而L-Cys对肌球蛋白表面疏水性的影响弱于一段式加热,此时加热对表面疏水性的影响占主导地位而不是L-Cys。
2.3 L-Cys对肌球蛋白聚集行为表面形貌的影响
2.3.1 缓冲液及L-Cys溶液AFM成像
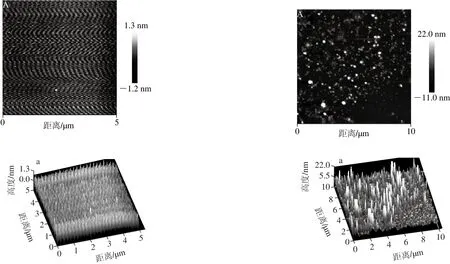

图2 缓冲液和L-Cys溶液AFM成像Fig. 2 AFM images of buffer solution and L-Cys solutions
由图2A可以看出,缓冲液在云母片表面形成的吸附层在经过冲洗去盐后表面无明显颗粒状杂质,无污染、非常平滑,因此样品在自然干燥过程中空气中的尘埃颗粒及析出的盐分颗粒对样品观测的影响不大;图2a在高度上进一步反应出缓冲液吸附层表面无明显杂质颗粒。图2B为将L-Cys溶解在缓冲液中形成的L-Cys溶液在云母片上形成的吸附层,可以看出L-Cys溶液不存在大的颗粒状物质,与蛋白颗粒形貌存在较大的区别;图2b表明L-Cys溶液颗粒细小且均匀,与蛋白聚集体高度图差别较大。
2.3.2 高盐条件下L-Cys对肌球蛋白聚集行为的影响

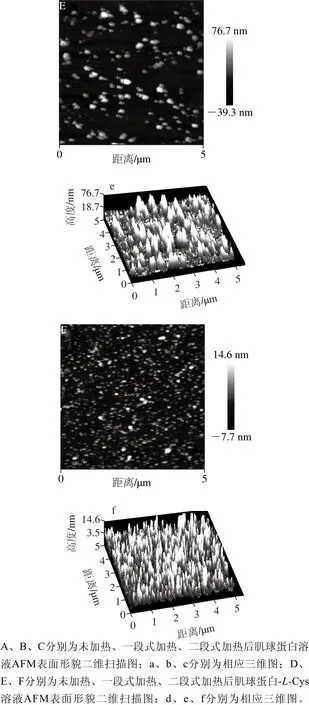
图3 高盐条件下肌球蛋白溶液和添加L-Cys对肌球蛋白溶液热聚集行为的影响Fig. 3 Effect of L-Cys on the heat-induced aggregation of myosin solutions at high ionic strength
由图3A、a可以看出,未加热时肌球蛋白多以单体或小聚集体的形式吸附在云母片的表面,分布相对均匀,存在轻微的交联现象。图3B、b显示一段式加热时,肌球蛋白形成大的聚集体,大小不等的聚集体分布很不均匀,图像表明肌球蛋白发生无序且剧烈的聚集,产生横向交联,形成不规则的簇状聚集体,原因可能是加热温度过高,肌球蛋白聚集速率大于展开速率。图3C、c显示二段式加热时形成大的聚集簇,部分小的聚集体发生交联从而进一步聚集成大的聚集体,蛋白聚集体的分布相对均匀。由图3D、d可以看出,未加热添加L-Cys后肌球蛋白多以小的聚集体或单体的形式存在,与纯蛋白相比小的聚集体数量增多,与溶解度结果一致,且分布不均匀,未出现轻微交联现象,表明L-Cys在未加热时干扰了肌球蛋白的聚集。图3E、e结果显示,一段式加热时出现较大的聚集体,聚集体的大小形状较纯蛋白均匀,并且表现出明显的有序聚集,说明L-Cys缓解了肌球蛋白在一段式加热时产生的剧烈聚集。图3F、f显示二段式加热时,L-Cys对肌球蛋白溶液的聚集行为有明显的影响,与纯蛋白相比聚集体更小,分布更均匀,阻止了肌球蛋白聚集体发生横向聚集,未形成大的聚集体,与Shiraki等[17]曾报道的氨基酸能阻止蛋白的聚集结果一致。
2.3.3 低盐条件下L-Cys对肌球蛋白聚集行为的影响
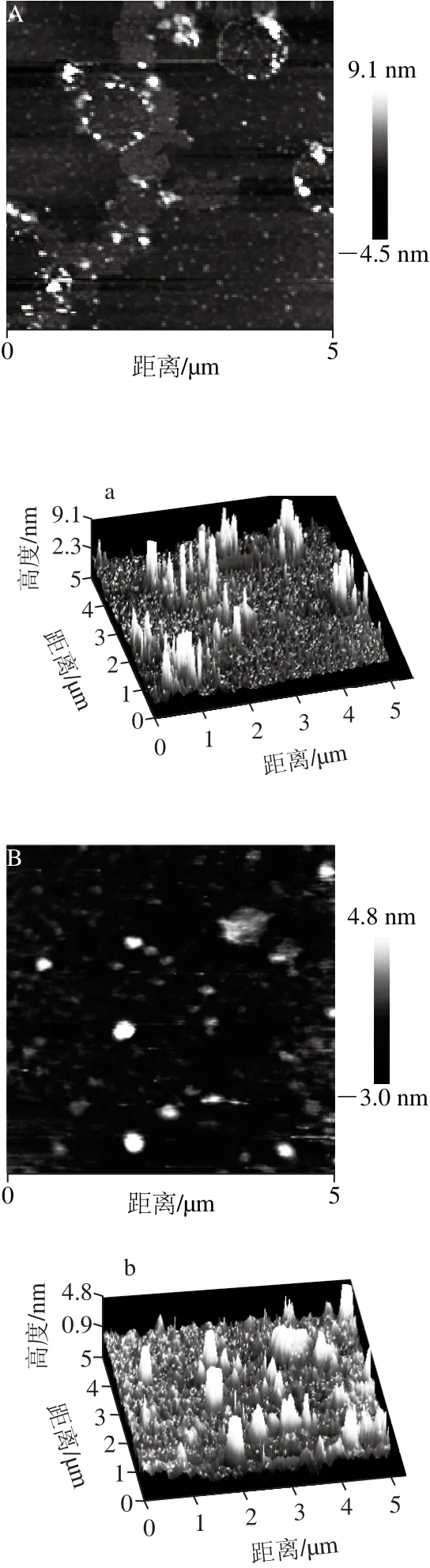
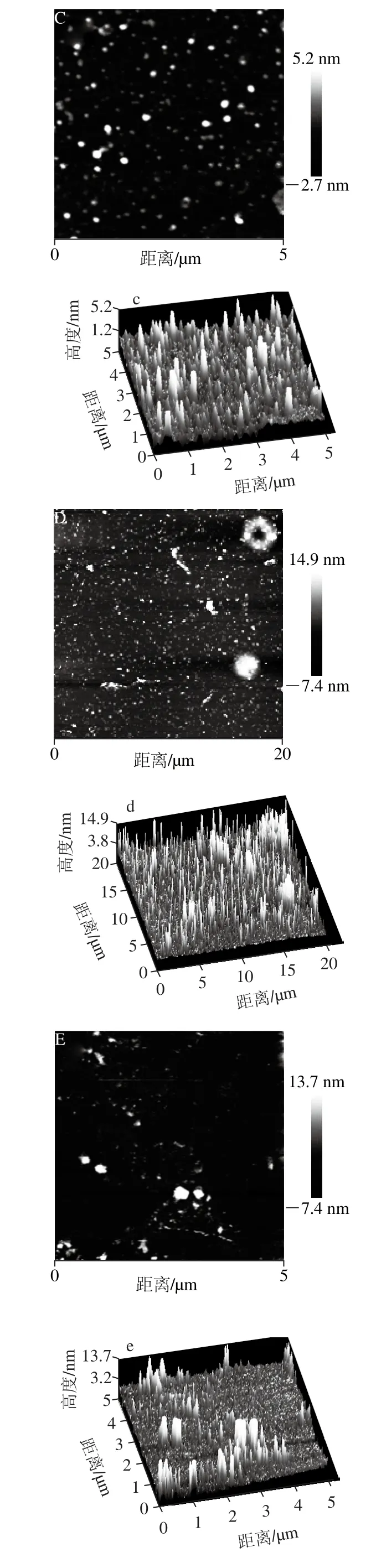

图4 低盐条件下肌球蛋白溶液和添加L-Cys对肌球蛋白溶液热聚集行为的影响Fig. 4 Effect of L-Cys on the heat-induced aggregation of myosin solutions at low ionic strength
由图4A可以看出,肌球蛋白低盐条件未加热时自组装成较小的聚集体,与高盐相比聚集体分布不均匀,形状不规则,但横向交联明显增多(图4a),原因可能是低盐条件下肌球蛋白更趋向于自组装成较大的肌球蛋白纤丝[16]。一段式加热时出现较大的肌球蛋白聚集体,较高盐条件下分布较均匀,形状较规则(图4B、b)。二段式加热时出现较小的聚集体,分布较均匀,与高盐条件下聚集形貌表现出较大区别(图4C、c)。由图4E、e可以看出,未加热时添加L-Cys后肌球蛋白分散更均匀,小的纤丝体增多,原因可能是L-Cys提高了肌球蛋白的溶解度,较大的纤丝体分解成较小的纤丝体或单体,该结果与溶解度结果一致。图4E、F也可看出添加L-Cys后聚集体明显减小,与溶解度结果一致,同时蛋白聚集体的横向交联增加,说明L-Cys在缓解肌球蛋白聚集的同时使其聚集更有序,避免聚集速率过快,形成大的蛋白簇,而且簇与簇间的交联能力明显上升,利于凝胶网络结构的形成。
3 结 论
3 种加热方式下,低盐环境中,L-Cys均能显著提高肌球蛋白的溶解度;高盐环境中,L-Cys的添加对肌球蛋白的溶解度无显著性影响。未加热时,高/低盐环境中L-Cys对肌球蛋白溶液表面疏水性均无显著性影响;一段式加热时,高/低盐环境中,添加L-Cys均显著提高了肌球蛋白溶液的表面疏水性;二段式加热时,相对一段式加热L-Cys均未大幅度改变表面疏水性。AFM图像显示高盐条件下添加L-Cys使蛋白聚集体分布更均匀,聚集体更小,缓解了肌球蛋白的聚集,使其聚集更有序;低盐条件下L-Cys使肌球蛋白分布更分散但不均匀,聚集体更小,横向交联明显增加,有利于凝胶网络的形成。
L-Cys本身带负电荷,与肌球蛋白自身的负电荷形成干扰,破坏了静电平衡,从而影响肌球蛋白的聚集行为。低盐时,电荷屏蔽作用弱,L-Cys所带负电荷围绕在肌球蛋白周围,增大了静电斥力,从而显著提高了肌球蛋白的溶解度;一段式加热时,肌球蛋白的聚集速度大于展开速度,L-Cys可显著缓解肌球蛋白的聚集,使被掩埋的疏水位点重新暴露,从而显著提高了表面疏水性;二段式加热时,预加热过程肌球蛋白充分展开,且展开速度大于聚集速度,发生有序聚集,疏水位点被掩盖的较少,加热方式对表面疏水性的影响大于L-Cys。此外,L-Cys特殊的侧链结构与肌球蛋白发生特异性作用,也会干扰肌球蛋白的聚集行为,还需要进一步的研究。

