氯-硫酸盐体系下硫酸钙溶解度相图的研究进展*
赖富国,高国华,肖燕飞,徐志峰
(江西理工大学冶金与化学工程学院,江西赣州341000)
硫酸钙通常以3种形态存在:二水硫酸钙(或称石膏,DH,CaSO4·2H2O)、半水硫酸钙(HH,CaSO4·0.5H2O)、无水硫酸钙(AH,CaSO4),其存在形态取决于温度、溶液酸碱度和溶液中组分浓度等条件。硫酸钙在多组分水溶液中的溶解度随晶型、温度和其它组分浓度而改变,这使得硫酸钙在多组分水溶液中的溶解行为非常复杂,很难预测。然而,钙大量存在于矿物资源以及天然水中,在物质提取过程中钙不可避免地会被带入水溶液中,很容易形成低溶解度的硫酸钙结晶,造成设备结垢、管道阻塞、产品纯度降低等问题[1],其症结就在于硫酸钙在氯化钠、氯化镁和氯化铵等氯-硫酸盐体系中的溶解度变化。
关于硫酸钙溶解度相图的研究在早期主要是通过实验来测定,而在当前,越来越多的模型被用来预测硫酸钙溶解度相图,如NRTL(Non-random Twoliquid)模型、Pitzer模型和MSE (The Mixed Solvent Electrolyte)模型,并且取得了较多可信的溶解度数据。但是硫酸钙溶解度相图更多集中在硫酸盐体系中[1-3]。而在卤水制盐、油田开发等领域中主要存在的是氯化钠、氯化镁、氯化钙等氯盐。对于这类氯-硫酸盐体系下硫酸钙的结晶问题,目前的研究相对较分散,没有系统的溶解度数据。笔者从卤水制盐、油田开发等领域中的氯-硫酸盐混合体系出发,总结归纳了硫酸钙在氯-硫酸盐混合体系中溶解度相图的研究进展,基于此来掌握硫酸钙在各种氯-硫酸盐水溶液体系下的溶解度规律,为最终解决卤水制盐和油田开发等工业生产过程中硫酸钙结晶难题提供更加全面的数据支撑。
1 硫酸钙在氯-硫酸盐混合体系中溶解度相图研究
1.1 CaSO4-NaCl-H2O体系
朱佳兵等[4]采用溶解平衡法测定了85~95℃条件下二水硫酸钙在NaCl水溶液中的溶解度;尹忠等[5]测定了二水硫酸钙在 25~80℃条件下的溶解度;W.L.Marshall等[6]则测定了二水硫酸钙在 40、60℃下的溶解度。综合比较,文献[4-6]的溶解度吻合度高,相关数据见图 1a。S.H.Najibi等[7]所测溶解度数据与文献[4-6]所测数据基本重合,但溶解度最大值略有偏差。由图1a可知,在一定温度下,二水硫酸钙溶解度随着氯化钠浓度的增加先增大后减小,在氯化钠浓度为2.5~4.5 mol/kg时出现溶解度最大值,最大值为二水硫酸钙在纯水中的3倍以上,出现最大值处氯化钠浓度随温度变化而改变;氯化钠对二水硫酸钙促溶作用主要是因为氯化钠作为强电解质加入溶液后,溶液离子强度增大,离子活度系数降低从而使硫酸钙溶解度增大,而在高氯化钠浓度下容易生成硫酸钙离子对,导致短程静电相互作用增强,使溶解度减小[5];当氯化钠浓度较低时,温度对溶解度的影响较小,但当氯化钠浓度大于溶解度最大值临界氯化钠浓度时,在低温下溶解度随着氯化钠浓度的增大迅速减小,而在高温下则随着氯化钠浓度增大先是保持不变而后减小。
E.Bock 等[8]测定了 25~50 ℃下无水硫酸钙在氯化钠水溶液(0~5.24 mol/kg)中的溶解度。W.M.Madgin等[9]测定了无水硫酸钙在25℃下的溶解度,与文献[8]结果非常吻合。 D.N.Glew 等[10]测定了在65 ℃下的溶解度。 W.L.Marshall等[6]则测定了 125~200℃下的溶解度。本文将文献[6,8,10]的数据做了总结归纳,结果见图1b。由图1b可见,在不同温度下,无水硫酸钙溶解度随氯化钠浓度表现出不一样的变化规律。低温下,无水硫酸钙溶解度随氯化钠浓度的变化趋势与二水硫酸钙相同,都是先增大后减小,并存在溶解度最大值;而在高温下,无水硫酸钙溶解度随着氯化钠浓度增大而持续增大,但总体小于低温时的溶解度。在相同氯化钠浓度下,无水硫酸钙溶解度随温度的升高而减小;当小于40℃时,无水硫酸钙溶解度与二水硫酸钙基本相等;当大于40℃时,无水硫酸钙溶解度显著小于二水硫酸钙,此时无水硫酸钙为稳定晶型。为系统了解无水硫酸钙溶解度在氯化钠水溶液中的变化规律,70~120℃下的溶解度数据还有待补充,因为生产真空盐过程中换热器上以无水硫酸钙为主要成分的结垢主要集中在较高的温度范围(103~119 ℃)内[11]。

CaSO4-NaCl-H2O体系中的溶解度
G.Azimi等[12]通过硫酸钙在 CaSO4-H2O 体系和CaSO4-NaCl-H2O体系的溶解度实验数据拟合出更加完整的离子相互作用参数,并应用到OLI软件内嵌的MSE计算模型中,通过该模型对二水硫酸钙和无水硫酸钙在CaSO4-NaCl-H2O体系的溶解度做了数值模拟计算,计算值均与实验测定值较符合。
1.2 CaSO4-MgCl2-H2O体系
氯化镁水溶液中二水硫酸钙在较高温度下的溶解度已有一定的研究。X.Q.Wu等[13]对CaSO4-MgCl2(0.1~1.2 mol/kg)-H2O 体系中二水硫酸钙在 75~98℃下的溶解度做了测定,并测定了二水硫酸钙在氯化镁溶液中的溶解平衡时间,数据相对可信。何伟等[14]所测得相似条件下的溶解度数据与文献[13]大致相近。以上研究结果表明,在相同温度下,二水硫酸钙溶解度随氯化镁浓度的增加而增大,相同温度条件下二水硫酸钙在氯化镁溶液中的溶解度为在纯水中的2~6倍,说明氯化镁对二水硫酸钙有促溶作用;在相同氯化镁浓度下,二水硫酸钙溶解度随温度升高而增大,当氯化镁浓度大于0.2 mol/kg时,温度对溶解度的影响较为显著;在85℃时,溶液中平衡固相为二水硫酸钙和半水硫酸钙共存,低于此温度则平衡固相为二水硫酸钙,高于此温度则为半水硫酸钙。氯化镁的促溶作用一方面是由于Mg2+与SO42-在较低浓度时更容易形成稳定的硫酸镁离子对[15],另一方面是MgCl2作为易溶强电解质加入溶液中产生了盐溶效应。
此外,针对硫酸钙的另一种晶型——半水硫酸钙,王可苗[16]测定了其在 CaSO4-MgCl2(0.1~4.5 mol/kg)-H2O体系中的溶解度。与二水硫酸钙类似,由于体系容易生成稳定的硫酸镁离子对,半水硫酸钙在该体系中的溶解度比在纯水中增加了1~5倍。随着氯化镁浓度的增加,硫酸钙的溶解度呈先增大而后呈减小趋势。溶解度增加是由于硫酸镁离子对的形成,而高氯化镁浓度中溶解度的减小则可能是Ca2+和SO42-的活度系数以及水的活度变化所造成的。
Z.Li[17]利用 OLI软件拟合实验数据计算出Mg2+-HSO42-离子对的Bromley-Zemaitis相互作用参数和硫酸镁的解离常数,将新参数加入OLI软件中的自有模型(Software Package StreamAnalyzer 1.3)中建立新的自洽模型,应用新模型计算了二水硫酸钙在CaSO4-HCl(0.5 mol/L)-MgCl2-H2O 体系中的溶解度,模型计算值与实验值非常接近。K.K.Tanji等[18]基于debye-huckel理论用Fortran IV语言编写计算程序,并计算了25℃下二水硫酸钙在CaSO4-MgCl2-H2O体系中的溶解度,计算值和实验值较为吻合。
1.3 CaSO4-MgCl2-NaCl-H2O体系
在CaSO4-MgCl2-NaCl-H2O体系中,硫酸钙溶解度研究集中在二水硫酸钙。A.G.Ostroff等[19]于早期测定了28~90℃下二水硫酸钙在CaSO4-MgCl2-NaCl-H2O体系中的溶解度,数据较为全面。A.Kumar等[20]测定了二水硫酸钙在35℃下的溶解度。文献[19-20]相关数据归纳于图2中。由图2可见,在相同温度及氯化镁浓度下,二水硫酸钙溶解度随氯化钠浓度的增大先增大后减小,最后趋于相等;在相同温度和氯化钠浓度下,当氯化钠浓度较小时,氯化镁的加入对硫酸钙溶解度影响较大,但随着溶液中氯化钠浓度的增大,氯化镁对硫酸钙溶解度的影响越来越小。在相同氯化钠和氯化镁浓度下,温度对二水硫酸钙溶解度几乎没有影响。在该体系中,氯化镁对二水硫酸钙的促溶作用可能是由于稳定的硫酸镁离子对的形成,还可能是由于镁离子对硫酸钙晶体的成核和生长具有抑制作用。当镁离子浓度较低时,镁离子替代钙离子进入二水硫酸钙晶格中,而当镁离子浓度较高时,镁离子作为嵌入物存在于二水硫酸钙晶体缺陷中[21]。
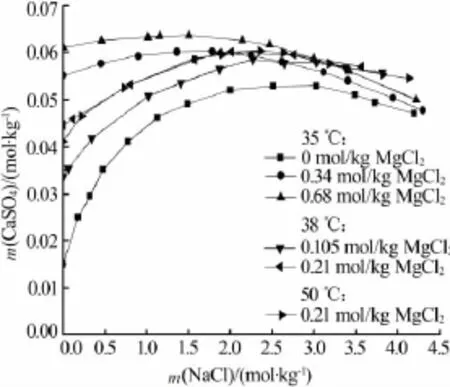
图 2 CaSO4·2H2O 在 CaSO4-MgCl2-NaCl-H2O体系中的溶解度[19-20]
1.4 CaSO4-NH4Cl-H2O体系
P.Tian 等[22]测定了 25~70 ℃下二水硫酸钙在CaSO4-NH4Cl-H2O体系中的溶解度。结果发现,二水硫酸钙在该体系中的溶解度随NH4Cl浓度增加而增大,在氯化铵浓度为1.59 mol/kg时溶解度达到最大值0.060 mol/kg(为纯水中的4.1倍),同时可看出温度对CaSO4·2H2O溶解度的影响不明显。氯化铵对二水硫酸钙的促溶作用一方面可能是氯化铵作为强电解质产生了盐效应,另一方面可能是生成了可溶性硫酸钙-硫酸铵复盐—CaSO4·(NH4)2SO4·2H2O 或(NH4)2[Ca(SO4)2]。 梁亚琴等[23]测定了以二水硫酸钙为主要成分的磷石膏在更高浓度的氯化铵溶液(0~3.0 mol/L)中的溶解度。在常温下,二水硫酸钙的溶解度随氯化铵浓度(0~1.6 mol/L)的变化趋势与文献[22]一致。但是,继续增加氯化铵的浓度,二水硫酸钙的溶解度将随氯化铵浓度的增大而减小,这是由于氯化铵浓度过大会导致溶液的黏性增大,致使Cl-和NH4+吸附在二水硫酸钙表面从而阻止二水硫酸钙的溶解。
此外,P.Tian 等[22]还采用流程模拟系统(Aspen Plus)内嵌的NRTL电解质模型计算了新的电解质相互作用参数,建立了 CaSO4-NH4Cl-(NH4)2SO4-H2O体系的混合电解质溶液模型,并对二水硫酸钙在NH4Cl-H2O体系做了模型计算,计算值与实验值的相对误差不超过1.52%。
1.5 CaSO4-KCl-H2O体系
二水硫酸钙在CaSO4-KCl-H2O体系中的溶解度也有较多的研究。X.Q.Wu 等[13]测定了 75~85 ℃下二水硫酸钙在氯化钾(0~0.3 mol/L)溶液中溶解度,溶液中钙离子浓度采用ICP测定,数据可信度较高。A.Aagli等[24]测定了 25、80 ℃下二水硫酸钙在更高浓度的氯化钾(0~2.5 mol/kg)水溶液中的溶解度。文献[13,24]相关数据如图3a所示。由图3a可见,在一定温度下,二水硫酸钙溶解度随氯化钾浓度增大先增大而后急剧减小,溶解度最大值为0.066 mol/L(纯水中的4.5倍)。在溶解度达到最大值前,相同氯化钾浓度下温度对二水硫酸钙溶解度影响较小,但在最大值点后,相同氯化钾浓度下,低温时二水硫酸钙溶解度下降地更快。氯化钾对二水硫酸钙溶解度的影响主要是盐效应。
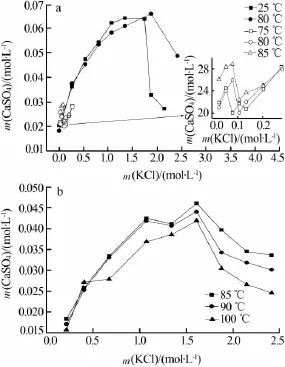
图 3 CaSO4·2H2O[13,24](a)和 CaSO4[25]在CaSO4-KCl-H2O体系中的溶解度
L.Yang 等[25]测定了 85~100 ℃下硫酸钙 3 种晶型在氯化钾(0~2.5 mol/L)溶液中的溶解平衡时间和溶解度。结果表明,硫酸钙3种晶型溶解度随氯化钾浓度的变化趋势一致,都是随着氯化钾浓度的增大先增大后减小,其中二水硫酸钙的溶解度数据与文献[24]所测数据相近,半水硫酸钙的溶解度值与二水硫酸钙溶解度相差较小。但是,无水硫酸钙的溶解度与前2种晶型的溶解度相差较大,溶解度最大值仅为0.046 mol/L,其溶解度相图见图3b。由图3b可见,当氯化钾浓度较小时,温度对溶解度影响小,当氯化钾浓度较大时,溶解度受温度影响较大且随着温度升高而下降。
1.6 CaSO4-CaCl2-H2O体系
在三元体系CaSO4-CaCl2-H2O中二水硫酸钙的溶解度已有大量报道[13,26-27]。 Z.Li[27]通过等温溶解平衡法测定了22~60℃下二水硫酸钙在氯化钙溶液(0~2 mol/kg)中的溶解度。 X.Q.Wu 等[13]测定了更高温度(85~98℃)下的二水硫酸钙在氯化钙溶液中的溶解度。文献[13,27]相关数据见图 4。A.Kumar等[26]测定了30℃下二水硫酸钙在氯化钙溶液中的溶解度,但是采用EDTA滴定法测定溶液中钙离子浓度的实验误差较大,而所得的二水硫酸钙溶解度随氯化钙浓度的变化趋势与文献[27]一致。由图4可见,二水硫酸钙溶解度先随着氯化钙浓度的增加而急剧下降,随后缓慢下降,这主要是受同离子效应的影响;在相同氯化钙浓度下,低温时硫酸钙溶解度随温度的升高而轻微增大,而在高温时,二水硫酸钙溶解度随温度的升高而减小,随后在高氯化钙浓度时趋于一致。
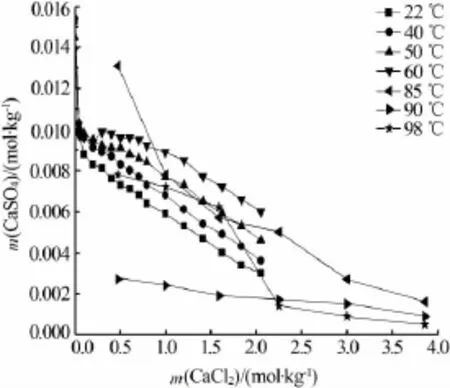
图4CaSO4·2H2O在CaSO4-CaCl2-H2O体系中的溶解度[13,27]
1.7 CaSO4-MgCl2-Na2SO4-H2O体系
D.Barba等[28]测定了40℃下二水硫酸钙在CaSO4-MgCl2-Na2SO4-H2O体系下的溶解度。结果发现,在硫酸钠浓度较低时,氯化镁的加入可以显著提高二水硫酸钙的溶解度,而在硫酸钠浓度较高时,随着氯化镁浓度的增加,二水硫酸钙的溶解度反而降低,这主要是由于Cl-和SO42-的极化作用不同造成的;在一定氯化镁浓度下,二水硫酸钙溶解度先是随硫酸钠浓度增加急剧减小,随后缓慢增大,这主要是同离子效应和硫酸钙中性分子的形成所造成的。同时还计算了硫酸钙的活度系数,从热力学计算方面验证了影响硫酸钙溶解度变化的因素。
1.8 CaSO4-NaCl-Na2SO4-H2O体系
二水硫酸钙在CaSO4-NaCl-Na2SO4-H2O体系中的溶解度已有大量研究。J.Block等[29]测定了25~100℃下二水硫酸钙在该体系下的溶解度,L.B.Yeatts等[30]和 F.K.Cameron 等[31]测定了 25 ℃下二水硫酸钙在CaSO4-NaCl-Na2SO4-H2O体系中的溶解度,数值与文献[29]较接近,文献[29-31]相关数据见图5a。由图5a可见,在一定氯化钠浓度条件下,二水硫酸钙溶解度先是随硫酸钠浓度增加急剧减小,随后缓慢增大,先前的减小是由于同离子效应的存在,而后增加可能是由于络合物的形成[29]。在一定硫酸钠浓度下,二水硫酸钙溶解度随氯化钠浓度变化呈现2种相反的变化趋势;1)当硫酸钠浓度低于0.6 mol/kg时,二水硫酸钙溶解度随氯化钠浓度的增大而增大,这是由于氯化钠的盐溶作用所致;2)当硫酸钠浓度的高于0.6 mol/kg时,由于盐析效应的存在使得二水硫酸钙溶解度随氯化钠浓度的增大而降低。在相同硫酸钠和氯化钠浓度下,二水硫酸钙随温度升高而略微增大。
无水硫酸钙在CaSO4-NaCl-Na2SO4-H2O体系中的溶解度主要是在高温下测定的。C.C.Templeton等[32]测定了250、300℃下无水硫酸钙在该体系中的溶解度,如图5b所示。由图5b可见,由于温度过高,无水硫酸钙溶解度极低;在一定温度和溶液离子强度下,无水硫酸钙溶解度随硫酸钠浓度增大先急剧减小,而后缓慢增大。在一定温度和硫酸钠浓度下,无水硫酸钙溶解度随溶液离子强度的增大而轻微增大。为系统了解无水硫酸钙溶解度在该体系下的变化规律,100℃下的溶解度数据还有待补充,在此温度范围内温度变化对工业卤水输送管道内硫酸钙结垢有重要影响[33]。
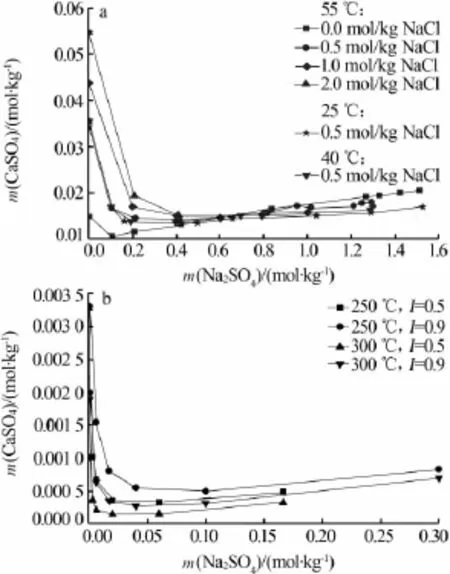
图 5 CaS4·2H2O(a)[46]和 CaSO4[49]在 CaSO4-NaCl-Na2SO4-H2O体系中的溶解度
G.Amizi等[34]应用OLI软件的内置拟合功能对溶解度实验数据做了拟合,计算出离子活度系数等模型参数,并将参数应用到OLI软件的MSE模型中,计算了25~300℃时二水硫酸钙和无水硫酸钙在该体系下的溶解度。结果表明,计算值与前人文献实验数据吻合度高。
2 结语
1)针对卤水制盐、油田开发等领域中存在的氯-硫酸盐体系(氯化钠、氯化镁、氯化钙等氯盐)下硫酸钙的结晶问题,总结归纳了目前硫酸钙在氯-硫酸盐溶液体系中溶解度相图研究进展。总结发现,温度和氯盐浓度对硫酸钙各晶型的溶解度有较大影响,但其影响规律不尽相同。因此,在实际的生产过程中可根据溶解度规律调整组分浓度及温度,以增大硫酸钙的溶解度。
2)硫酸钙在氯-硫酸盐体系中溶解度相图研究,关于硫酸钙另外2种常见晶型(半水硫酸钙和无水硫酸钙)的溶解度数据相对较少。此外,对于高温和高盐度的复杂盐溶液体系的硫酸钙溶解度数据也较少。但是在实际工艺生产过程中存在硫酸钙的多种晶型和晶型转变,同时还涉及到高温和高浓度的复杂盐溶液体系。因此,应大力开展硫酸钙各晶型在硫酸盐-氯盐高温多组分复杂体系下溶解度的研究,以加深硫酸钙在卤水蒸发结晶及油田开采过程中硫酸钙结晶问题的认识。
3)全面掌握复杂体系下硫酸钙各晶型的溶解度相图,热力学模型计算必不可少。在已运用的众多热力学模型计算中,OLI软件中的MSE模型由于其较强的预测能力而被广泛应用,但其模拟计算所需的相关模型参数(如离子相互作用参数等)仍有待继续扩充。因此,MSE计算模型的优化和进一步开发应用,有助于更加全面地掌握硫酸钙溶解度相图,指导研究与生产的进行。

