糯大麦与非糯大麦颖果发育过程的解剖学与组织化学研究
邵珊珊, 李发丽, 陈昕钰,董召娣,余徐润, 熊 飞
(扬州大学 生物科学与技术学院,江苏扬州 225009)
大麦颖果由果皮、种皮、胚和胚乳四部分组成。大麦的食用部分主要为胚乳,淀粉含量占胚乳贮藏物质的90%以上[1],是大麦主要的贮藏物质。糯大麦支链淀粉含量高,表现出独特的淀粉品质性状,在食用加工、酿造及畜牧产业等方面具有潜在的应用价值。淀粉约占籽粒重量的60%~75%,其中直链淀粉含量变化范围在0~45%之间,淀粉总含量及直链淀粉含量的高低对大麦的最终品质有重要影响[2-3],而胚乳淀粉体的发育和充实状况对糯大麦的产量和品质[4]起决定作用。淀粉体由原质体发育而来,是主要用来合成和贮藏淀粉的一种重要细胞器[5]。近年来学者们不乏对糯大麦的研究,李祥栋等认为糯性大麦因其支链淀粉含量多,具有高黏性、耐蒸煮、延展性优等特性,在食品加工和酿造产业上都有广泛的应用[6]。研究者们对大麦颖果内胚乳淀粉体的研究更是不少,Berger等[7]、荆彦平等[8]指出,在谷物胚乳淀粉体发育过程中,细胞核衰亡并降解,胚乳细胞表现出细胞程序性死亡的特征,然而胚乳细胞中的淀粉体仍能继续生长和增殖,最终充实整个胚乳细胞。Van Dongen[9]和刘美等[10]的研究发现,在大麦的生长过程中,胚乳中的淀粉、蛋白质等储藏物质为大麦种子的萌发和幼苗的早期生长提供了必要的能量供应。
尽管大麦淀粉研究的深入程度不及玉米、小麦和水稻,但由于近年来大麦淀粉在食品和工业应用中作为其他淀粉的替代物而使其开发利用价值日益显现[11-12]。目前,国内外对于糯大麦的研究主要集中于大麦淀粉的理化性质方面,而对糯大麦颖果发育过程研究较少。该研究以糯大麦代表品种‘白青稞’、‘甘垦5号’与非糯大麦代表性品种‘扬农啤10号’、‘苏裸麦1号’为材料,采用体视显微镜观察、组织化学染色、树脂半薄切片和光学显微镜观察等方法比较糯大麦与非糯大麦颖果及胚乳淀粉体发育的特点,探讨糯大麦与非糯大麦颖果发育的差异机理,为糯大麦淀粉的食品加工、应用提供理论依据。
1 材料和方法
1.1 材 料
本研究选用2个糯大麦和2个非糯大麦代表性品种为试验材料。糯大麦品种‘白青稞’(C2-2),是西藏自治区边坝县农技站从农家品种系统选育而来。此品种穗大粒多,适应性强,稳产高产,性能好;‘甘垦5号’(GK5),为甘肃省农垦农业研究院选育的黑色食用糯大麦新品种,加工品质较好。非糯大麦品种‘扬农啤10号’(YNP10),由‘苏引麦3号’和‘扬农啤5号’杂交而来,具有籽粒和麦芽品质优良的优点;‘苏裸麦1号’(SLM1),为江苏沿江地区农科所采用优质、高产、多抗种质亲本杂交选育而成的裸大麦新品种,具耐肥抗倒性较好, 成穗率较高的优点。以上材料均由扬州大学大麦研究中心提供。所有大麦材料于2016年10月种植于扬州大学重点实验室试验田,常规管理,保证正常生长。
1.2 方 法
1.2.1标花和挂牌对于开颖的大麦品种,在开花期采用记号笔点开颖颖花与植株上挂牌相结合的方法来标记颖花的开花日期;对于闭颖的大麦品种,于齐穗期同一天,进行挂牌来标记穗茎露出剑叶鞘的时间,直至花期结束。
1.2.2颖果形态观察及组织化学染色(1) 颖果形态观察:取不同发育天数的大麦颖果,于体视显微镜(MZ6型,德国Leica公司)下观察并拍照,观察物质积累及发育情况。(2) I2/KI染色:将不同发育天数的大麦颖果用刀片纵剖,室温下用I2/KI(0.3%I2+1%KI)染色6~10 s,后置于体视显微镜下观察颖果剖面着色情况。I2/KI可将含有淀粉的地方染色,支链淀粉被染成红褐色,而直链淀粉被染成蓝黑色,通过观察剖面着色情况可判断淀粉的积累情况。
1.2.3大麦颖果生理指标的测定对不同发育天数的大麦颖果进行采集,称量颖果百粒鲜重,再于105 ℃下杀青30 min,80 ℃下烘干至恒重后,称量颖果百粒干重,并计算颖果含水率。将上述烘干的颖果充分研磨,采用蒽酮比色法[13]及高氯酸法[14]分别测定颖果的可溶性糖含量和总淀粉含量。
1.2.4胚乳显微结构观察(1) 胚乳不同部位淀粉体发育显微观察:取不同发育天数的大麦颖果,用刀片将要观察的部位切成2 mm厚的薄片,放入2.5%戊二醛前固定液中于4 ℃下固定4 h,后经磷酸缓冲液(pH 7.2)清洗、乙醇系列脱水、环氧丙烷置换、低粘性Spurr树脂浸透与包埋,70 ℃下聚合成树脂样品块。用超薄切片机(Ultracut R型,德国Leica公司)制作1 μm厚的薄片,经0.5%甲基紫和1%番红染液复染色后于光学显微镜(DMLS型,德国Leica公司)下观察并拍照,对大麦颖果背、腹部胚乳淀粉体的发育进行比较和分析。(2) 胚乳淀粉体形态、面积的测定:参照余徐润等[15]的方法,运用Image-Pro Plus和Adobe Photoshop CC 2017软件对胚乳淀粉体的大小和淀粉体占胚乳细胞的面积比的变化进行分析。
1.2.5表观直链淀粉含量测定参照朱帆等[16]的方法,采用碘结合法测定表观直链淀粉含量。
1.2.6数据分析各指标测定均重复3次,数据用Excel 2010和SPSS 19.0软件处理,用Origin 9.0作图,图片用Adobe Photoshop CC 2017做拼图处理。
2 结果与分析
2.1 大麦颖果发育过程中形态的变化
大麦颖果在发育过程中大小、形状和色泽均发生了变化(图1)。每种大麦颖果均在花后1~11 d,体积由小而大,主要变化为纵向变长,颖果表面色泽由乳白色变为浅绿色;在花后13~23 d,颖果体积不断增大,但纵向几乎不再变化,主要为横向加粗,颖果表面色泽逐渐变为深绿色;在花后25~40 d,颖果基本成型,果皮颜色逐渐变为棕黄色,最后变为深棕色。其中,花后35~40 d期间,‘甘垦5号’颖果表面色泽变化最大,逐渐变黄发黑,花后40 d时完全变为灰黑色;而其他品种则为深棕黄色。在颖果的整个发育过程中,糯大麦和非糯大麦颖果大小、形状和表面色泽等方面的变化具有一定相似的规律。

YNP10. 扬农啤10号,非糯大麦;SLM1. 苏裸麦1号,非糯大麦;C2-2. 白青稞,糯大麦; GK5. 甘垦5号,糯大麦;图中数字表示颖果发育天数;下同图1 4种大麦颖果在发育过程中的形态变化YNP10.Yangnongpi 10,non-waxy barley; SLM1.Suluomai 1, non-waxy barley; C2-2.Baiqingke, waxy barley; GK5.Ganken 5, waxy barley; Number of the figure show development days of caryopsis. The same as belowFig.1 Morphologic changes during the development of caryopsis of four barley cultivars

图2 不同发育天数大麦颖果纵切面I2/KI染色Fig.2 The I2-KI dyeing of barley caryopsis vertical section at different development days
2.2 大麦颖果发育过程中淀粉积累的变化
在颖果发育前期,大麦胚乳不能被染色,果皮部分可被染成蓝黑色,可知此时果皮中已经含一定量的直链淀粉(图2)。在花后7 d,胚乳部分开始被染色,且随着胚乳细胞的发育,染色面积逐渐增大,染色程度逐渐加深;而在此过程中,果皮的着色程度逐渐变浅,直至不着色,说明果皮中的淀粉在逐渐降解。另外,糯大麦与非糯大麦颖果胚乳和果皮的I2/KI染色结果不同:非糯大麦胚乳被I2/KI染成蓝黑色,糯大麦胚乳则被染成红褐色,但二者果皮染色特性一致,均呈蓝黑色(图2)。
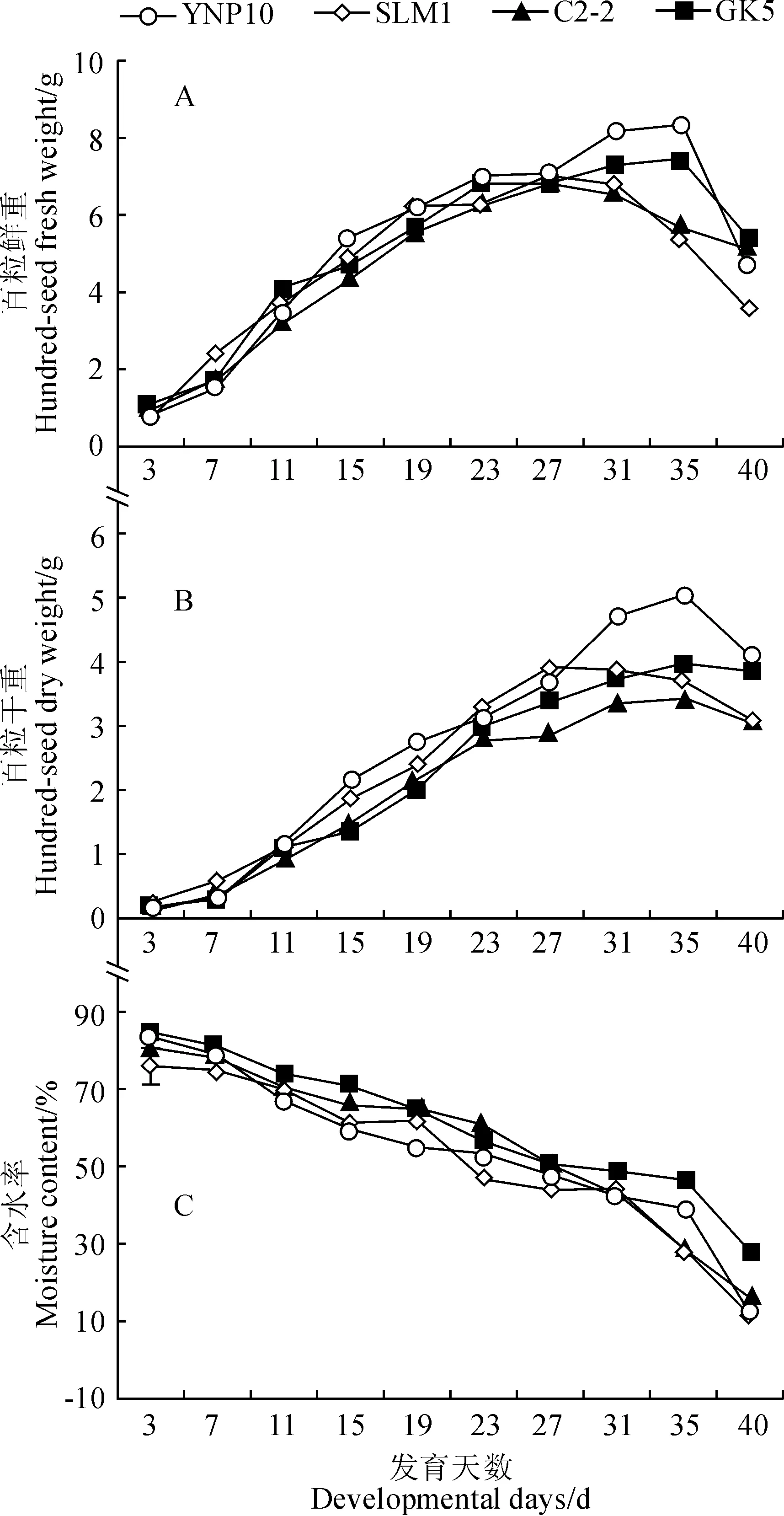
图3 大麦颖果在发育过程中鲜、干重及含水率的变化Fig.3 Changes of fresh and dry weight and moisture content during the development of barley caryopsis
2.3 大麦发育过程中颖果鲜、干重和含水量的变化
从图3可看出,糯大麦和非糯大麦在发育过程中,颖果鲜、干重变化趋势大体一致,生长曲线均呈“S”型。各品种颖果鲜重在花后3~27 d增加较快,27 d后逐渐趋于平缓并有所下降。而各品种颖果干重在花后7~27 d增加较快,27 d后增加缓慢并有少许下降。同时,各品种颖果含水率则在花后7~27 d迅速降低,27~31 d降低趋于平缓,31 d后降低加快,在整个发育过程中总体表现为逐渐下降趋势。与非糯大麦相比,糯大麦颖果鲜、干重在发育前、中期略低,在发育后期较高,而含水率总的趋势为糯大麦高于非糯大麦。
2.4 大麦发育过程中颖果淀粉含量及可溶性糖含量的变化
在各品种大麦颖果的发育前期,可溶性糖含量处于较高水平,在花后5~13 d迅速降低,20 d后趋于平缓(图4,A)。各品种颖果总淀粉含量变化大致呈“S”型曲线,其在花后5~13 d迅速增加,在花后13~20 d增长速度有所减慢,在花后20 d后开始趋于平稳(图4,B)。与非糯大麦相比,糯大麦颖果的可溶性糖含量在发育前期和中期明显高于非糯大麦,而在发育后期两者无显著差异。在整个发育时期,糯大麦的总淀粉含量都明显低于非糯大麦。
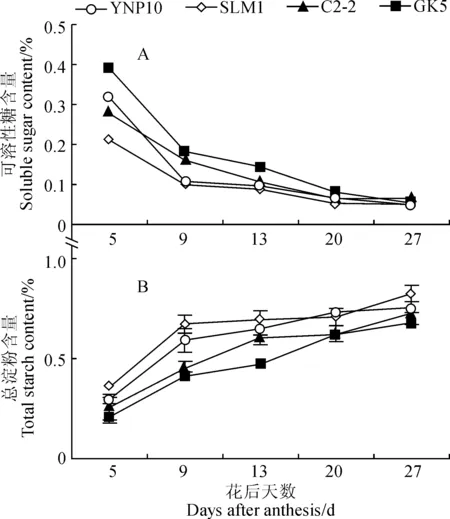
图4 大麦颖果发育过程中可溶性糖和总淀粉含量的变化Fig.4 Changes of soluble sugar and total starch contents during the development of barley caryopsis
2.5 大麦胚乳淀粉体的发育
在胚乳淀粉体的出现时间上,非糯大麦约在花后5 d(图5,a),糯大麦则比较早,约在花后3 d。大麦腹部胚乳淀粉体大多出现在细胞核周围,糯大麦胚乳淀粉体在花后5 d的数目多于非糯大麦、体积也大于非糯大麦(图5,a~d);花后9 d的糯大麦胚乳细胞中出现较多蛋白体,而非糯大麦中仅有少数几个蛋白体,且糯大麦胚乳细胞淀粉体的数目明显较多、体积较大;在花后13~27 d,大麦胚乳的淀粉体数目增多、体积增大(图5,i~t);在花后27 d,胚乳基本被淀粉体充实,蛋白体受淀粉体的挤压而变形,并分布于淀粉体间的缝隙中,细胞核消失(图5,q~t)。在两类大麦的胚乳中,大淀粉体最先出现,在花后20 d之前快速增殖(图5,m~p),而小淀粉体在花后13 d开始出现,之后迅速增殖生长(图5,e~h)。
同时,由图5和图6可以看出,大麦颖果背部胚乳淀粉体的发育及充实速度慢于腹部。在花后5 d,大麦颖果背部胚乳淀粉体出现的数目极少,且体积明显小于腹部胚乳淀粉体(图5,a~d;图6,a~d),淀粉体也是大多出现在细胞核周围。在花后9~20 d,大麦颖果背部胚乳积累的淀粉体数目较腹部胚乳淀粉体少、体积小(图5,e~t;图6,e~t)。在颖果的发育后期,大麦淀粉胚乳细胞几乎被大、小淀粉体充满,且小淀粉体填满大淀粉体之间的空隙。综合图5和图6可看出,糯大麦与非糯大麦胚乳淀粉体在背部与腹部的发育规律相似。

a~d. 花后5 d的胚乳细胞;e~h.花后9 d的胚乳细胞;i~l.花后13 d的胚乳细胞;m~p.花后20 d的胚乳细胞;q~t.花后27 d的胚乳细胞;A.淀粉体;Nu.细胞核;PB.蛋白体; 标尺=10 μm;图6同图5 糯大麦与非糯大麦腹部胚乳淀粉体的发育a-d. Endosperm cells of 5 days after anthesis; e-h. Endosperm cells of 9 days after anthesis; i-l. Endosperm cells of 13 days after anthesis; m-p. Endosperm cells of 20 days after anthesis; q-t. Endosperm cells of 27 days after anthesis; A. Amyloplast; Nu. Nucleus; PB. Protein body; The ruler is equal to 10 microns. The same as Fig.6Fig.5 Amyloplast development in abdominal endosperm of waxy and non-waxy barley
另外,大麦胚乳淀粉体发育过程中大、小淀粉体的面积及比例变化如图7所示。随着颖果发育天数的增加,大麦胚乳细胞中淀粉体所占的面积逐渐增加,且糯大麦品种大于非糯大麦品种,这说明糯大麦胚乳淀粉体的充实度要优于非糯大麦(图7,A)。由图7,B进一步可看出,在花后9 d,糯大麦和非糯大麦小淀粉体的比例均在40%以下,且糯大麦的小淀粉体比例高于非糯大麦;随着颖果发育天数的增加,小淀粉体的比例逐渐变大。在花后9~13 d,非糯大麦淀粉充实较快(图7,A、B);在花后20 d,糯大麦与非糯大麦小淀粉体的比例皆在80%左右,且糯大麦小淀粉体的比例高于非糯大麦(图7,B)。

图6 糯与非糯大麦背部胚乳淀粉体的发育Fig.6 Amyloplast development in dorsal endosperm of waxy and non-waxy barley

图7 大麦颖果发育过程中胚乳细胞淀粉体的相对面积比及小淀粉体的比例Fig.7 The relative area of starch granules and proportion of small starch granules in endosperm cells during the development of barley caryopsis
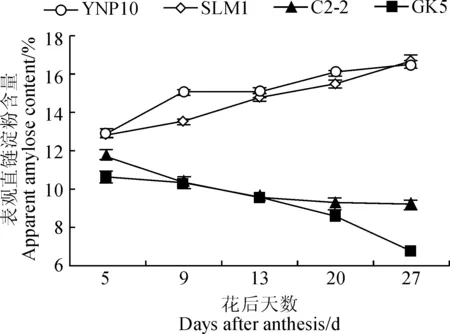
图8 大麦颖果在发育过程中表观直链淀粉含量的变化Fig.8 Changes of apparent amylose content during the development of barley caryopsis
2.6 大麦颖果发育过程中胚乳淀粉体表观直链淀粉含量的变化
从图8可看出,花后5~27 d,糯大麦的表观直链淀粉含量随发育天数的增加而逐渐降低,而非糯大麦表现则与之相反;在整个颖果发育过程中,糯大麦表观直链淀粉含量都明显低于非糯大麦,且随着生育期差异逐渐增大。
3 讨 论
大麦颖果胚乳细胞的分裂与生长,使颖果体积逐渐增长。而果皮生长前中期呈绿色,具有光合活性,随着果皮叶绿素的降解[17],类胡萝卜素合成相关基因的上调表达导致类胡萝卜素的大量积累[18]等,颖果表皮褪掉绿色;在组织染色观察过程中,大麦胚乳中淀粉的不断积累使染色程度及面积出现变化;非糯大麦胚乳被I2/KI染成蓝黑色,糯大麦的则被染成红褐色,结合表观直链淀粉测量结果,说明非糯大麦胚乳淀粉以直链淀粉为主而糯大麦以支链淀粉为主[19]。出现这一现象可能与颗粒结合淀粉合酶(GBSS)有关:在植物细胞中,GBSS是决定直链淀粉合成的关键酶[20],是唯一与发育中的淀粉体结合并有活力的蛋白[21],其两种同工酶GBSSI、GBSSII分别主要在贮藏器官和营养器官中表达[22]。在谷物中编码GBSSI的基因Waxy(wx)的突变体虽没有明显改变总淀粉含量,但在水稻、玉米、大麦等突变体的胚乳淀粉体中发现直链淀粉含量降低或完全缺失[23],而在高粱突变体的籽粒中则发现淀粉颗粒中的支链淀粉含量增加[24]。即编码GBSSI的基因的突变使直链淀粉和支链淀粉的比例发生变化,这也是大麦形成糯性的根本原因[4]。此研究结果可作为最直观、最简单的鉴定大麦糯性的依据。
在胚乳淀粉体的出现时间上,大麦胚乳淀粉体出现的时间与其他稻麦不同,水稻胚乳淀粉体大约在花后4 d出现,小麦胚乳在花后7 d开始积累淀粉[25],非糯大麦为5 d,糯大麦则更早,为3 d左右。依据王忠等的研究[26]将大麦淀粉粒分为A型(大)淀粉粒(直径10~20 μm)和B型(小)淀粉粒(直径3~5 μm),侯维海等[27]的研究指出淀粉粒数量、粒径和面积的变化与总淀粉含量有显著关系,本研究结果表明,在大麦发育过程中,小淀粉体比例和胚乳淀粉体相对面积比与淀粉含量呈正相关性,与其研究结果一致。且侯维海等[27]测得西藏冬青稞干物质和淀粉积累量呈“S”型曲线,本试验结果也与其一致,同时含水率的变化趋势与王忠等[26]的研究结果也一致。罗伟等[28]指出含水率与谷类作物的导热系数有关,可影响谷物的储藏,同时含水率对谷物的干燥工艺也有很大的影响[29],因而本研究中对含水率的探讨结果可用于对不同糯性大麦的储藏及干燥采取相应措施。而对于大麦胚乳淀粉体中大、小淀粉体的出现时间,本研究则与侯维海等[27]的研究不一致,这可能与其研究的品种冬青稞与本试验品种不同、生长环境等条件也不同等有关。对于小淀粉粒的增长趋势,本试验与伊祖涛等[30]在玉米颖果中发现的结果相似,即颖果发育前期,小型淀粉体数目百分比呈增加趋势,发育后期,淀粉体粒径分布趋于稳定。本研究结果显示,糯大麦的淀粉体充实状况优于非糯大麦,因此,可根据此结果决定选择不同糯性大麦品种。如根据不同要求来选用不同糯性大麦来制作天然淀粉、淀粉衍生物等。
王兵等[31]的研究指出小麦的淀粉体、蛋白体积累等与维管束有关,维管束又使谷物类的颖果区别出背、腹部,熊飞等[25]更明确指出养分运输时,由于背、腹部胚乳细胞离胚乳传递细胞及维管束的距离不同,使养分输入的速率和多少有差异,从而导致胚乳背部与腹部淀粉体发育不同,此即本研究中大麦背部胚乳淀粉体的发育及充实速度有别于腹部的原因。
本研究发现,糯大麦的表观直链淀粉及总淀粉含量较非糯大麦低,可溶性糖含量较高。一般来说,直链淀粉可制作薄膜,用于包装粉状产品和速冻食品等,由于非糯大麦直链淀粉含量较高,故非糯大麦既可考虑用于食品生产中,又可作为糖尿病患者食物的理想选择。由于糯大麦可溶性糖含量高,易于被动物吸收,可用于动物饲料产品的开发。

