草莓生长素响应因子FvARF10和FvARF18基因的克隆及表达分析
苏丽艳
(西安文理学院 生物与环境工程学院 秦岭野生观赏植物研究中心,西安 710065)
草莓属于蔷薇科草莓属水果,富含维生素C、A、E、B1及矿物质、膳食纤维等多种营养成分而广受欢迎。现代分子生物学和生物信息学技术的发展以及草莓基因组测序的完成,为研究和揭示草莓生长和发育的分子机理提供了丰富的信息资源。草莓果实是由植物花器官中的子房,通过授粉或生长素、赤霉素等条件刺激后,进一步分裂膨大而形成[1-3]。生长素作为调控果实生长发育的重要植物激素之一,对草莓的花诱导控制及其授粉后果实的生长发育过程有重要调控作用[4-6]。生长素响应因子(auxin response factors,ARFs)是介导生长素信号转导的重要蛋白家族之一,研究草莓中ARFs家族基因的功能,对探索生长素在花及果实发育过程中的作用具有重要意义[7-8]。
生长素信号通路中, 生长素可能通过影响ARFs 和Aux/IAA (auxin/indole-3-acetic acid)蛋白的互作调控早期响应基因的表达[9]。ARFs是一类响应生长素应答的转录因子,能和Aux/IAA的启动子响应元件(AuxREs)TGTCTC 特异结合[10-11]。研究表明,在低浓度生长素条件下,ARFs与Aux/IAA结合,抑制生长素诱导基因表达;当生长素浓度升高后,生长素受体(TIR/AFBs)与生长素结合后会大大增强与Aux/IAA结合能力,导致Aux/IAA泛素化而被26S蛋白酶体降解,使ARF从ARF-Aux/IAA二聚体中游离出来,从而激活生长素响应[12-13]。研究表明,拟南芥AtARF16与AtARF10基因同属一个亚家族,两者同为拟南芥At-miR160基因的靶基因,对于植株根冠细胞的分裂和分化水平有重要调控作用,为维持植株正常生长发育所必须[14], 同时,有研究证明杨树中Pto-ARF16与Pto-miR160a互作调控木材的形成过程[15]。另外,敲除大豆GmARF16基因后,大豆叶片叶绿素含量及最大光量子效率 (Fv/Fm) 显著提高,而叶片衰老相关基因表达受到抑制,从而证明GmARF16正调控叶片衰老进程[16]。近年来,越来越多研究关注ARFs家族基因对于果实的生长发育的调控作用[17-20]。目前,在番茄中分离得到22个ARFs基因[20],在葡萄中分离得到19个ARFs基因[21],甜橙ARFs家族包含19个成员[22], 香蕉中有47个ARFs基因[23]。部分成员的功能已经展开了深入研究分析,例如arf1/arf2双突变体植株的研究表明ARF2对于叶片和花器官的衰老有重要调控作用[24],而arf8突变导致番茄果实的单性结实,其对于番茄的坐果和果实发育有重要意义[25]。目前,以番茄为模式植物已经证明,越来越多的ARF家族基因参与调控果实的早期发育、细胞分裂、坐果、成熟和品质形成过程[26-34],这为解析生长素调控果实生长发育的分子机制奠定了坚实的基础。尽管ARFs已在很多物种中得到分离和鉴定,但其在草莓果实发育过程中的功能尚无相关报道。
本研究以森林草莓(Fragariavesca)为研究材料,克隆得到草莓生长素响应因子家族FvARF10和FvARF18基因,详细分析FvARF10和FvARF18的保守结构域、进化关系、保守结构和启动子应答元件,并研究其在不同组织中的表达情况及其对外源IAA处理的应答情况,为深入研究草莓FvARF家族蛋白的功能提供参考,同时也为其他果类和瓜类蔬菜果实发育分子调控机制的研究提供借鉴。
1 材料和方法
1.1 植物材料及处理
森林草莓(Fragariavesca)材料由西安市农业技术推广中心提供。植株栽种于西安文理学院温室中,于生长盛期分别取根、茎、叶、当天开放的花朵、青果(花后11~12 d)、半熟果(花后20~21 d)、红果(花后25~26 d),液氮冷冻后保存于-80 ℃超低温冰箱。
外源IAA处理方法参考文献[31]。选取长势良好的草莓盆栽30盆,分为2组,每组15盆。一组为IAA处理,用50 mg/L IAA溶液200 mL灌根;另一组为对照,用等量清水灌根。分别于处理后0、1、6和 12 h随机取叶片(每次约8片单叶)。每个处理3次重复。植物材料液氮冷冻后保存于-80 ℃超低温冰箱。
1.2 方 法
1.2.1基因克隆与序列分析利用去多糖多酚RNA提取试剂盒(北京天根)提取森林草莓不同组织样品RNA,用反转录试剂盒PrimeScriptTM1st Strand cDNA Synthesis Kit(TaRaKa 公司)合成cDNA。利用Phytozome数据库中提交的森林草莓(Fragariavesca)数据库,通过与拟南芥At-ARFs家族基因同源序列比对,克隆FvARF10和FvARF18基因,根据其ORF序列设计特异性引物(表1)进行PCR扩增。PCR 反应条件为94 ℃预变性5 min; 94 ℃变性30 s, 60℃退火30 s, 72 ℃延伸90 s, 35个循环; 最后72 ℃延伸7 min。回收PCR 产物并连接到pMD18-T 载体上,构建重组质粒转化E.coliDH5α 感受态细胞,筛选阳性克隆,提取质粒进行鉴定后,送往上海生物工程有限公司进行DNA测序。
1.2.2序列分析不同植物相关基因及氨基酸序列来自 NCBI 数据库;利用 DNAMAN 进行氨基酸序列比对;利用在线软件 ProtParam(http://web. expasy.org/protparam/)计算蛋白质分子质量和等电点;利用TargetP 1.1 Server(http://www.cbs.dtu.dk/services/TargetP/)进行FvARF10、FvARF18蛋白的亚细胞定位预测;启动子顺式作用元件分析采用在线工具plantCARE(http://bioinformatics.psb.ugent.be/ webtools/plantcare/html/)进行。利用 MEGA 5 软件进行系统进化树分析,并生成报告图形。
1.2.3FvARF10、FvARF18表达特性分析以不同组织和IAA处理材料cDNA为模板进行实时荧光定量 PCR 分析。以草莓Fv18S为内参基因,设计FvARF10和FvARF18特异性引物(表1)进行实时荧光定量PCR分析。操作步骤按照FastStart Universal SYBR Green Master (ROX) 试剂盒说明书进行。qPCR体系为20 μL,包括10 μL SYBR premix混合液,1 μL cDNA (稀释至 30 ng/μL),引物各1 μL (10 μmol/L),ddH2O 7 μL。反应程序为:95 ℃
变性3 min;然后,95 ℃ 20 s,60 ℃退火30 s,72 ℃延伸30 s,共40 次循环;每次循环第3 步进行荧光采集,最后退火至65 ℃,每隔30 s 上升0.5 ℃,至95 ℃变性1 min。qRT-PCR 反应于ABI Quant Studiotm6 Flex Real-Time PCR System上进行。cDNA样品均3 次生物样本重复。试验结果用2-ΔΔCT法对数据进行定量分析,方法同文献[32]。
2 结果与分析
2.1 FvARF10和FvARF18的克隆和序列分析
以森林草莓叶片cDNA为模板,经PCR 扩增,获得FvARF10和FvARF18基因片段, 琼脂糖凝胶电泳显示与目标条带大小一致(图1)。对扩增结果进行测序和分析后表明,FvARF10和FvARF18基因片段大小依次为2 056和2 100 bp,分别编码685和699个氨基酸。预测其分子量和等电点分别为75.73、76.78 kD和 8.12、6.55。保守结构域预测分析表明FvARF10和FvARF18均含有保守的B3 DNA结合结构域和生长素响应因子保守结构域(图2)。
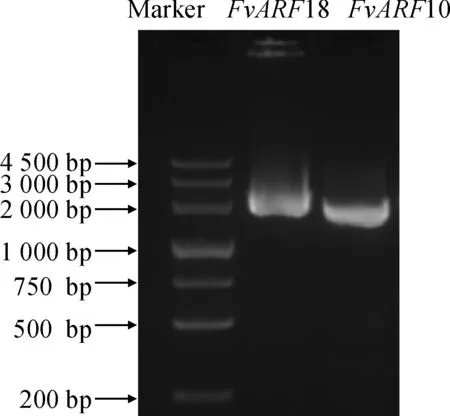
图1 森林草莓FvARF10和FvARF18基因克隆Fig.1 Amplification of FvARF10 and FvARF18 genes from Fragaria vesca
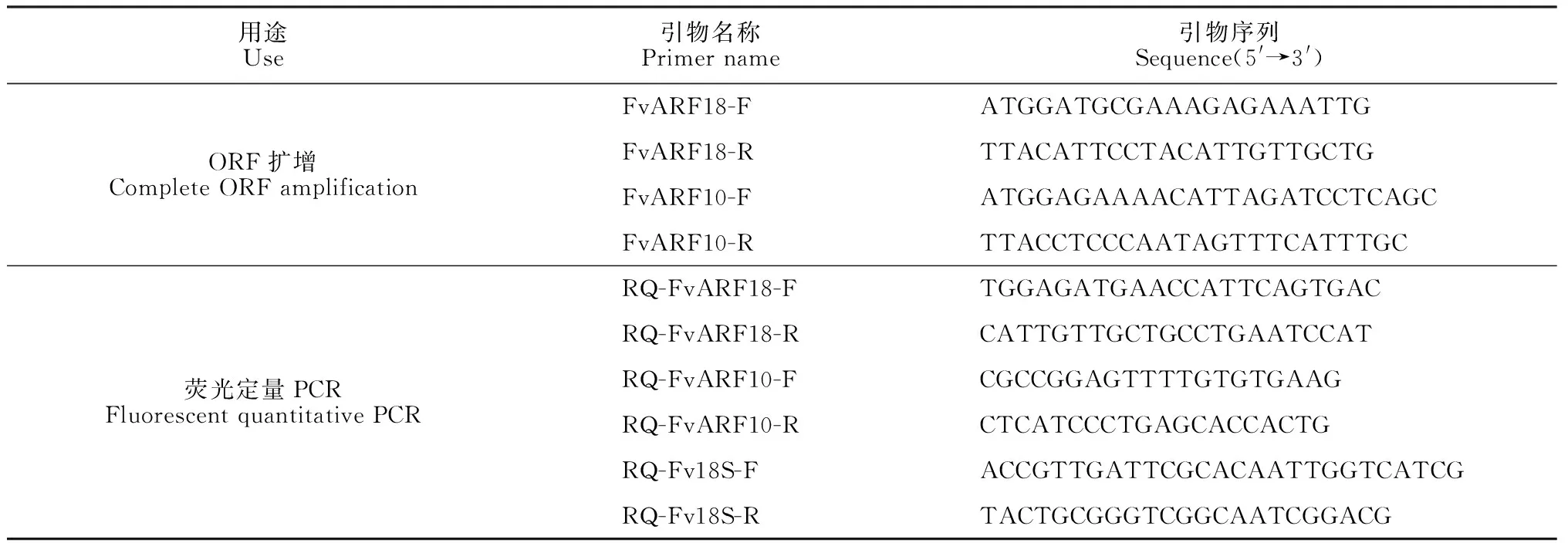
用途Use引物名称Primer name引物序列Sequence(5'→3')ORF扩增Complete ORF amplificationFvARF18-FATGGATGCGAAAGAGAAATTGFvARF18-RTTACATTCCTACATTGTTGCTGFvARF10-FATGGAGAAAACATTAGATCCTCAGCFvARF10-RTTACCTCCCAATAGTTTCATTTGC荧光定量PCRFluorescent quantitative PCRRQ-FvARF18-FTGGAGATGAACCATTCAGTGACRQ-FvARF18-RCATTGTTGCTGCCTGAATCCATRQ-FvARF10-FCGCCGGAGTTTTGTGTGAAGRQ-FvARF10-RCTCATCCCTGAGCACCACTGRQ-Fv18S-FACCGTTGATTCGCACAATTGGTCATCGRQ-Fv18S-RTACTGCGGGTCGGCAATCGGACG

图2 森林草莓FvARF10和FvARF18保守结构域示意图Fig.2 Putative conserved domain structure and schematic model for FvARF10 and FvARF18
2.2 FvARF10、FvARF18基因的同源序列比对和进化分析
利用DNAman 软件将克隆FvARF10和FvARF18氨基酸序列与其他物种ARFs进行同源比对(图4),B3 DNA结合结构域和生长素响应因子保守结构域所在位置高度保守。进化树分析表明(图3),FvARF18与桑树MnARF18聚集在一个分支上,而FvARF10与苎麻BnARF10进化关系较密切。
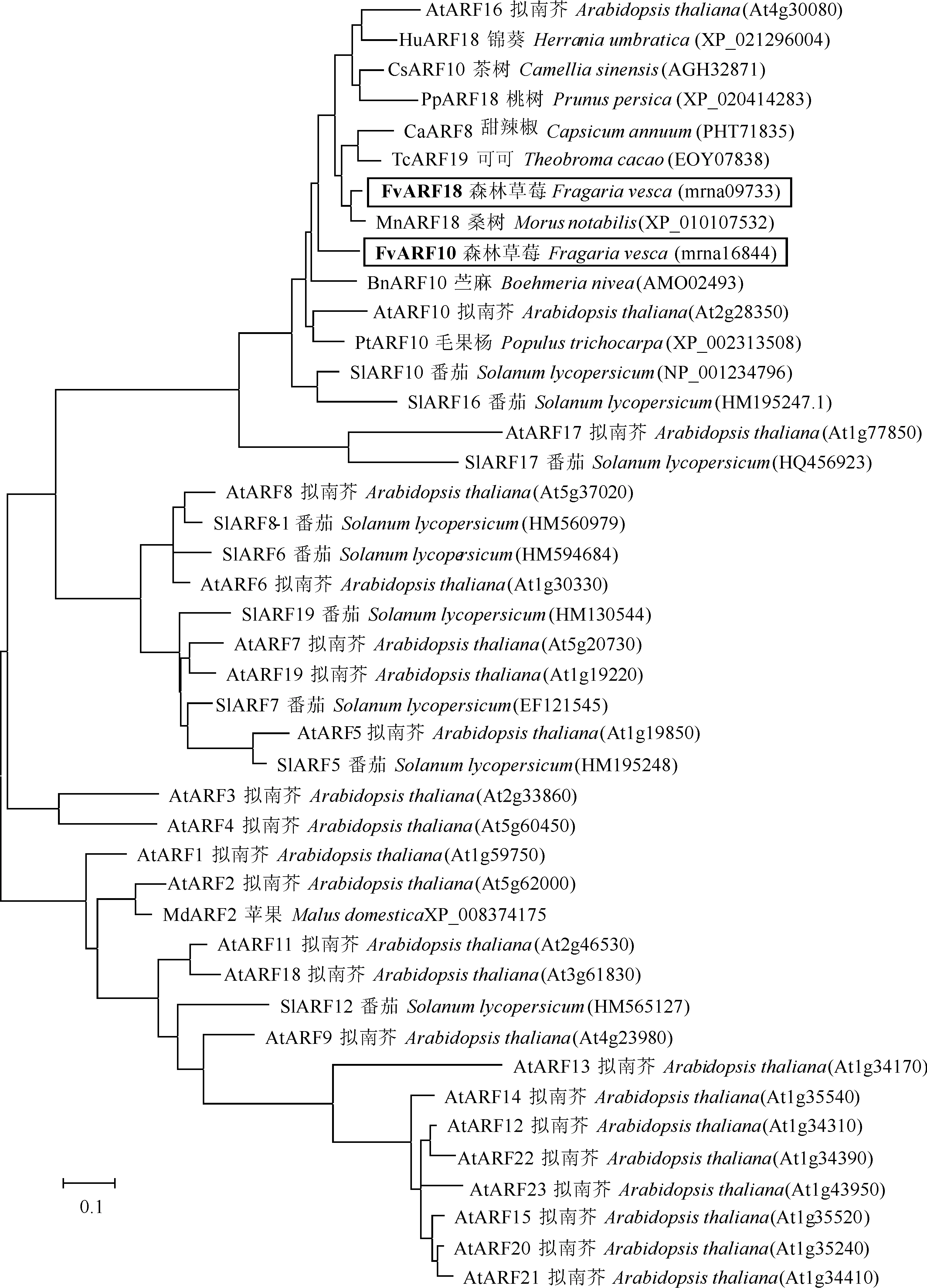
图3 森林草莓FvARF10和FvARF18系统进化树分析Fig.3 The phylogenetic relationships of FvARF10 and FvARF18 from various organisms
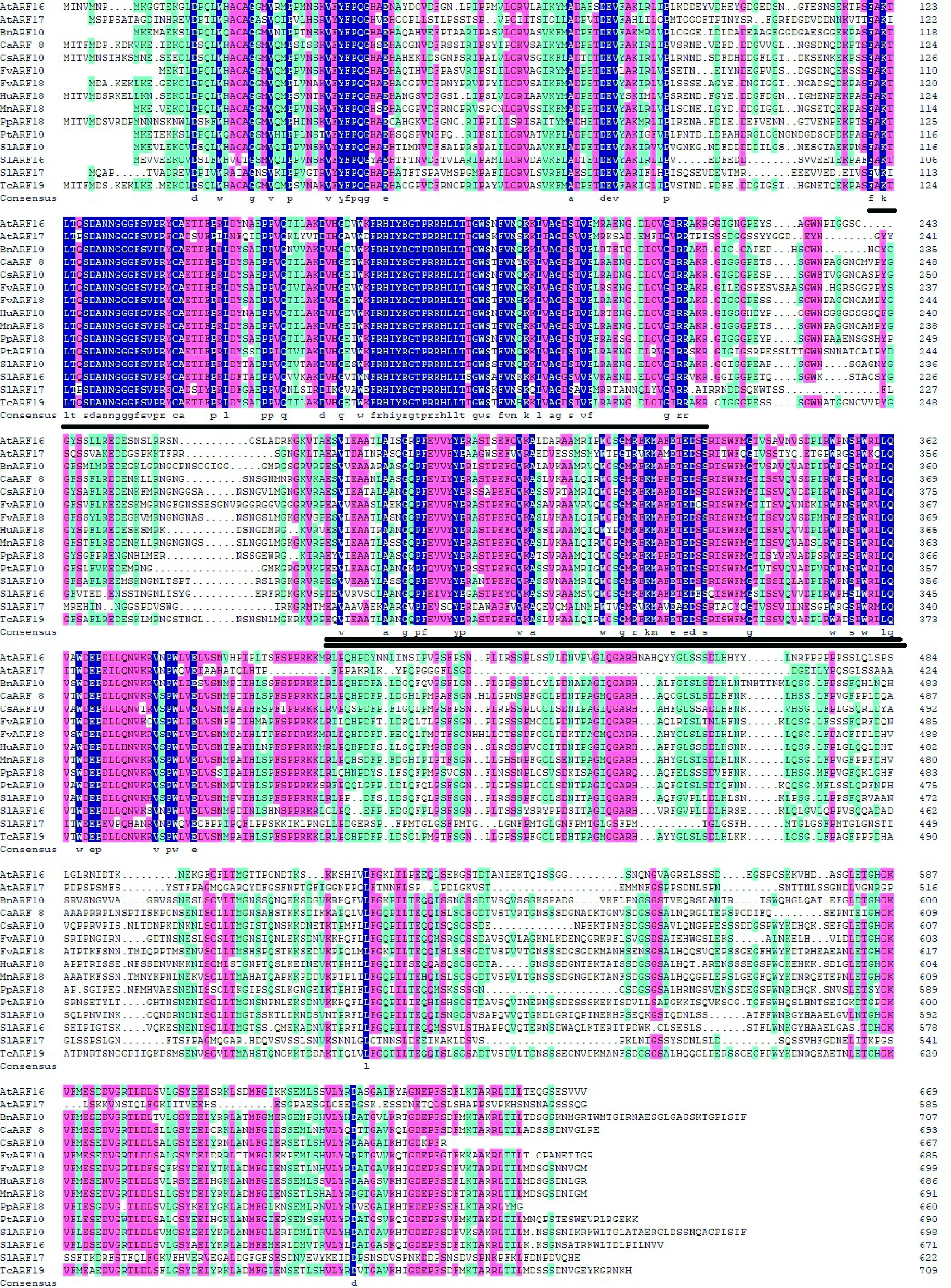
AtARF16、AtARF17. 拟南芥(At4g30080 and At1g77850); BnARF10. 苎麻(AMO02493);CaARF8.甜辣椒(PHT71835);CsARF10.茶树(AGH32871);FvARF10、FvARF18.森林草莓(mrna16844和mrna09733); HuARF18.锦葵(XP_021296004);MnARF18.桑树(XP_010107532);PpARF18.桃树(XP_020414283);PtARF10.毛果杨(XP_002313508);SlARF10、SlARF16.、SlARF17.番茄(NP_001234796、HM195247.1和HQ456923);TcARF19.可可(EOY07838)单黑线标记为B3 DNA 结合结构域,双黑线为生长素响应因子保守结构域图4 草莓FvARF10、FvARF18所编码的氨基酸同源性比对AtARF16,AtARF17. Arabidopsis thaliana (At4g30080 and At1g77850); BnARF10. Boehmeria nivea (AMO02493); CaARF8. Capsicum annuum (PHT71835); CsARF10. Camellia sinensis (AGH32871); FvARF10,FvARF18. Fragaria vesca (mrna16844 and mrna09733); HuARF18. Herrania umbratica (XP_021296004); MnARF18. Morus notabilis (XP_010107532); PpARF18. Prunus persica (XP_020414283); PtARF10. Populus trichocarpa (XP_002313508); SlARF10,SlARF16,SlARF17. Solanum lycopersicum (NP_001234796,HM195247.1 and HQ456923); TcARF19. Theobroma cacao (EOY07838)Single black line was B3 DNA binding domain and double black line was auxin response factor conserved domainFig.4 Sequence alignment of the deduced amino acid of FvARF10 and FvARF18

基因名称Gene name叶绿体运输肽Chloroplast transit peptide线粒体运输肽Mitochondrial targeting peptide分泌通道蛋白Secretory pathway signal peptide其他OtherFvARF100.1030.1850.0540.705FvARF180.0720.1040.1270.912
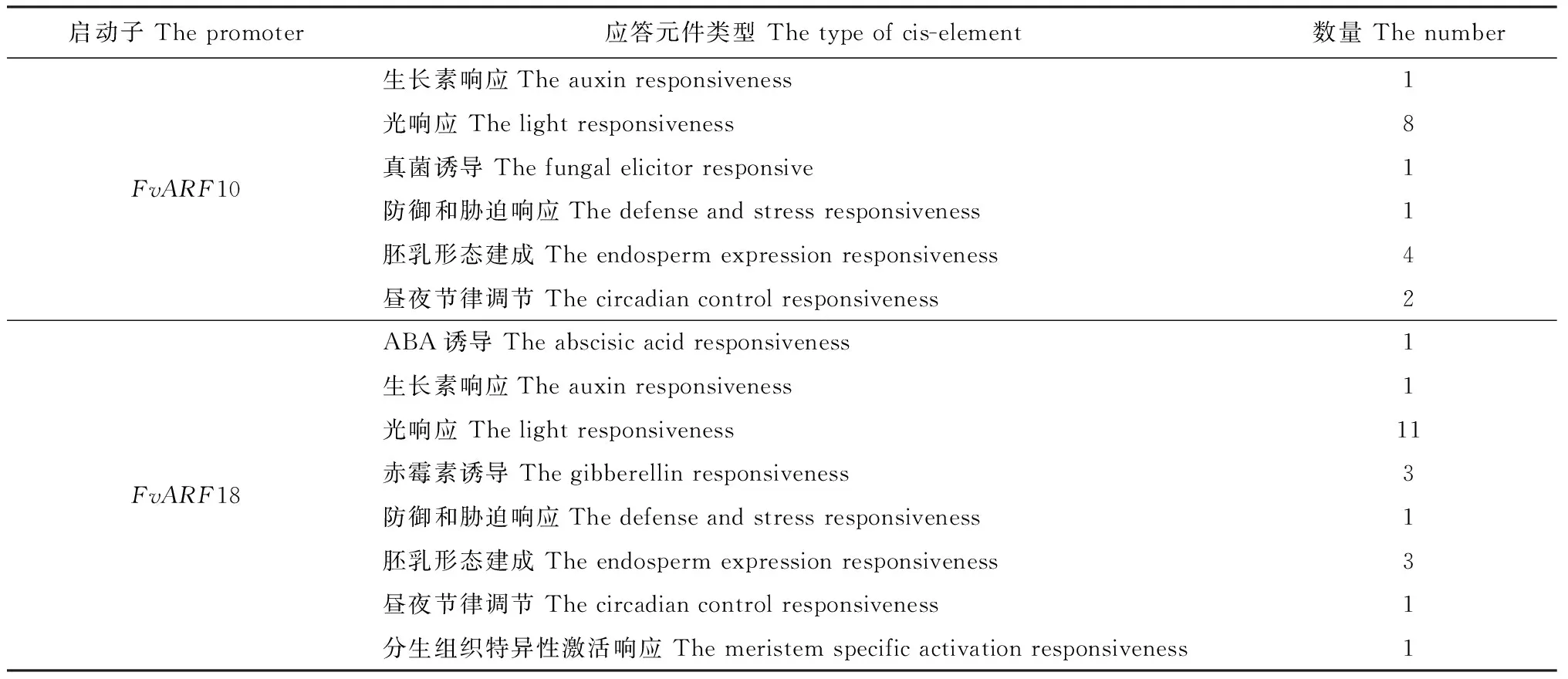
表3 FvARF10、FvARF18启动子序列中与组织特异性或激素及胁迫诱导相关的cis元件
与拟南芥ARF家族中的AtARF10、AtARF16基因进化关系较近,位于同一大类分支中(图3)。
2.3 FvARF10和FvARF18亚细胞定位预测
对FvARF10、FvARF18蛋白进行亚细胞定位预测分析,数值结果如表2所示,数值越大可信度越高。因此,预测FvARF10、FvARF18蛋白均定位于‘其他’即细胞核或细胞质中,具体定位情况仍需实验进行验证确定。
2.4 FvARF10和FvARF18基因的启动子结构分析
FvARF10、FvARF18启动子序列分析表明,FvARF10、FvARF18除具有调控真核基因转录的基本元件,如TATA 框、CAAT 框等,还具有多种逆境响应功能元件,如激素(生长素、ABA、赤霉素)诱导响应元件、光响应元件、防御与胁迫响应元件及调节生物节律等相关作用元件(表3)。
2.5 FvARF10、FvARF18基因的组织表达分析
以草莓Fv18S为内参基因,提取森林草莓不同组织部位的总RNA,并逆转录成cDNA,对FvARF10、FvARF18基因进行实时定量PCR 扩增。结果表明,FvARF10、FvARF18在森林草莓的茎、叶片、花、根和果实中均有表达,但是表达量存在明显差异。如图5所示,以目的基因在根中表达量为对照,FvARF18在森林草莓的茎中相对表达量最高(图5),约为根中的4倍;而FvARF10在果实中表达较高,特别是半熟果(1/2RF)中表达最强(图5),约为根中表达量的14倍。以上结果说明FvARF10、FvARF18可能在森林草莓的不同组织及不同的发育阶段起不同的作用。
2.6 FvARF10、FvARF18基因对IAA处理的应答分析
外源激素IAA处理森林草莓植株后,于处理后0、1、6和12 h取材。通过RT-qPCR检测发现,与对照组相比,FvARF10与FvARF18均在IAA处理后受到强烈诱导呈先上调而后恢复正常水平的表达趋势,并在IAA处理1 h后达到顶峰(图6)。
3 讨 论
中国是世界草莓属植物种类分布最多的国家,同时也是世界上草莓栽培面积最大、产量最多的国家。草莓的果实是由花托膨大而来,植物学上称为假果,栽培学上又称之为浆果。生长素是调控植物生长发育的重要激素之一,对草莓生长发育有重要的调控作用,生长激素分泌过多则引起草莓花芽分化异常,导致花器官细胞分裂失调形成畸形果,或花芽分化时两朵花或两朵以上花一同分化,最终形成鸡冠果或双身果等[35-36]。所以,培养优质的草莓果实及培育优良的草莓品质一直是国内外草莓种植者和育种工作者追求的目标。因此了解生长素对草莓果实发育的调控机理对于优良草莓品种的培养及生产实践具有重要的指导意义。

图5 森林草莓不同组织中FvARF10和FvARF18相对表达Fig.5 Relative expression of FvARF10 and FvARF18 in different tissues of Fragaria vesca
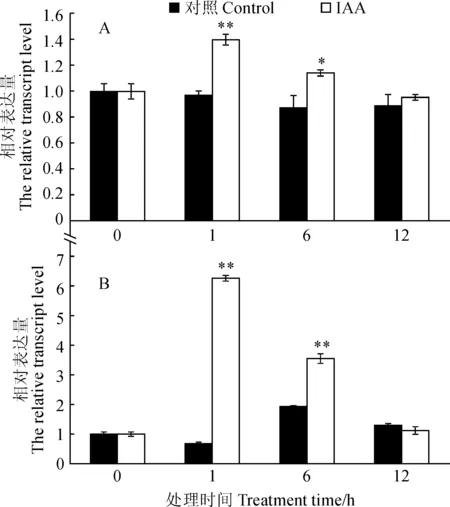
*和**表示同期处理与对照间差异分别达到0.05和0.01显著性水平图6 IAA处理下FvARF10(A)和FvARF18(B)相对表达* and ** indicate significant difference between control and treatment within the same stage at 0.01 and 0.05, respectivelyFig.6 Relative expression of FvARF10(A) and FvARF18 (B) genes under IAA treatment
在生长素信号转导过程中,ARFs家族基因是植物体内调控生长素初级响应基因的调控因子。如前所述,ARFs对于植物的发育过程中有重要的调控作用,如植物胚的形成、叶片的衰老、花器官的脱落和花瓣的生长、果实的坐果和发育[26-30]。然而, 关于ARFs家族基因在草莓果实发育过程中的功能尚无相关报道。
本研究克隆得到森林草莓ARF家族2个基因,根据其与其他物种的同源性将其命名为FvARF10、FvARF18。序列分析表明,FvARF10、FvARF18具有ARF家族基因典型的B3 DNA 结合结构域和生长素响应因子特征结构域,表明其属于草莓中ARFs家族成员。进化树分析表明,FvARF10、FvARF18属于不同的分支,其中,FvARF18与桑树MnARF18聚集在一个分支上,而FvARF10与苎麻BnARF10进化关系较密切;启动子分析表明,FvARF10、FvARF18基因的启动子区域存在有多种激素响应、胁迫响应、组织形态建成相关以及与植物的生理节律相关的作用元件,并且发现FvARF10、FvARF18 启动子均存在生长素响应元件。组织特异性表达分析显示,FvARF10、FvARF18基因在草莓的茎、叶片、花、根和果实中均有表达,但是表达量存在明显差异。这预示着草莓FvARF10、FvARF18基因在草莓生长发育过程中可能发挥着不同的调控功能。外源激素IAA处理草莓植株后,FvARF10、FvARF18均在IAA处理后受到强烈诱导呈先上调而后恢复正常水平的表达趋势,并在IAA处理1 h后达到顶峰,表明FvARF10、FvARF18可能在响应生长素应答过程中发挥一定的调控作用。
与拟南芥ARF家族基因的进化关系比较表明,FvARF10与AtARF10关系较近,而FvARF18则与AtARF16进化关系较近,ARF 家族基因具有保守的功能结构域和显著的序列特征。同一物种中的ARF 成员之间和不同物种之间的ARF 基因具有一定的同源性。在拟南芥中,AtARF10与AtARF16存在一定的功能冗余性,同时参与了拟南芥根冠细胞的分化,IAA处理后,ARF16表达水平提高3倍[37-38]。生长素被认为是调控子房发育成果实的最主要激素[39], 番茄ARF10对叶的形态建成和果实早期发育起着重要作用[40],大豆GmARF10参与了叶片的衰老过程[41]。本研究中,IAA诱导草莓FvARF10和FvARF18的上调表达并呈现类似的表达趋势,且启动子元件在种类及数量上具有一定的相似性,因此,FvARF10和FvARF18在功能上是否具有一定的冗余性?FvARF10在果实中的表达量较高,是否在调控草莓果实发育过程中行使主要功能?仍有待进一步研究。下一步的工作中,将验证草莓FvARF10、FvARF18基因DNA 结合域、蛋白互作结构域及核定位功能,并通过转基因直接验证FvARF10和FvARF18调控草莓果实发育的相关功能。从分子水平上揭示生长素调控草莓果实发育的机理,为将来草莓优良品种的培育提供理论基础。

