菠萝VOZ转录因子序列特征及其对非生物胁迫的响应
夏 杨,苏初连,晁 骏,康 浩,蒲金基,2,张 贺*
(1 海南大学 热带农林学院,海口 570228;2 中国热带农业科学院 环境与植物保护研究所,海口571101)
VOZ(vascular plant one-zinc finger protein)即维管植物锌指蛋白,它是一类广泛存在于植物中的转录因子,与植物的进化和发育密切相关。在拟南芥中,VOZ转录因子家族包含2个成员,分别称为AtVOZ1和AtVOZ2,AtVOZ1和AtVOZ2的同源物被发现存在于各种维管植物以及小立碗藓中[1],它们能与V-PPase(Vacuolepyrophosphatase)AVP1启动子中的38 bp顺式作用区域结合[2],AtVOZ1在韧皮部组织中特异性表达,而AtVOZ2在根部强烈表达。研究表明,拟南芥的AtVOZ1和AtVOZ2转录因子能调节从营养生长到开花的过渡,Atvoz1Atvoz2双突变体在长日照条件下表现出推迟开花的表型[3]。在水稻中,OsVOZ1受包括干旱、低温、高温、高盐等在内的多种逆境的诱导表达,而且在不同的组织中,该基因的表达也存在明显的差异,在茎和叶中的表达要明显高于根中。与此同时,还发现该基因过量表达的转基因株系对高盐有一定的表型[4]。在齿肋赤藓中,ScVOZ1具有转录调控功能和核定位潜力,且与AtVOZ1具有高度的相似性[5]。
菠萝 (Ananascomosus)属凤梨科凤梨属,原名凤梨。原产美洲热带和亚热带,性喜温暖,最适生长的年均气温为24~27 ℃。15 ℃以下生长缓慢,5 ℃是受冻的临界温度,43 ℃高温即停止生长。性耐旱,需一定水分,年降雨量需1 000~1 500 mm且分布均匀为宜。中国是菠萝十大主产国之一,主要种植在广东、海南、广西、福建、云南等省[6]。近年来,在许多地区,干旱和盐渍化面积迅速扩张,估计到2050年将有50%可耕地面积严重盐渍化[7]。干旱、盐碱、极端温度等非生物胁迫能够对植物的生长发育造成严重的危害[8],导致产量下降,是引起全球粮食作物减产的首要原因[9]。诸如干旱、盐碱、极端温度等非生物胁迫严重危害着菠萝生产,进而制约菠萝产业又好又快发展,因而有必要运用现代分子生物学技术开展菠萝的花果调控、抗旱耐寒性新品种选育。
1 材料和方法
1.1 菠萝非生物胁迫处理
将株高约10 cm均匀一致的菠萝组培苗,移栽于花盆中,置于25 ℃温室中,以相对湿度约80%、14 h光照/10 h黑暗光周期下进行胁迫处理,每个处理10株组培苗,以0 h处理为对照。
以300 mmol/L NaCl溶液、20%PEG6000溶液、200 mmol/L甘露醇溶液、100 mmol/L双氧水(H2O2)溶液分别淋灌菠萝组培苗,干旱处理以菠萝组培苗自然失水6%时、移植缺水基质后,分别于0、12、24、48、72、96和120 h取样;以15 mmol/L乙烯利(Eth)溶液、0.5 mmol/L水杨酸(SA)溶液、0.5 mmol/L脱落酸(ABA)溶液分别淋灌菠萝组培苗,以及4 ℃低温处理菠萝组培苗,48 h后移至25 ℃温室中,分别于0、1、3、6 、12、24和72 h取样;剪取菠萝叶,液氮速冻,-80 ℃保存、备用。
1.2 方 法
1.2.1总RNA提取与cDNA第1链的合成参照天根生化科技有限公司的RNAprepPure多糖多酚植物总RNA提取试剂盒中的方法提取菠萝的总RNA。使用超微量紫外分光光度计(Nano-drop 2000C型)测定总RNA的浓度,-80 ℃保存,备用。采用RevertAid First Strand cDNA Synthesis Kit试剂盒反转录成第1链cDNA,10倍稀释后备用。
1.2.2菠萝VOZ转录因子家族基因的扩增根据Plant Transcription Factor Databasev4.0(http://planttfdb.cbi.pku.edu.cn/)数据库[10]中菠萝VOZ转录因子家族的相关信息,利用Primer Primer 5.0软件设计扩增引物AcoVOZ1-F / AcoVOZ1-R和AcoVOZ2-F/AcoVOZ2-R(表1),以菠萝叶片cDNA为模板进行扩增。RT-PCR反应扩增程序为:95 ℃预变性3 min;95 ℃变性30 s,50 ℃退火40s,72 ℃延伸2 min,共30个循环;72 ℃延伸10 min。利用1%琼脂糖凝胶电泳检测PCR产物。
1.2.3菠萝VOZ转录因子家族的生物信息学分析通过DNAMAN6.0软件进行高同源蛋白的氨基酸序列比对,并对菠萝VOZ转录因子保守区域进行分析。通过ExPASy蛋白分析专家系统[11](Expert Protein Analysis System,https://www.expasy.org/)提供的蛋白质在线分析工具ProtParam (http://web.expasy.org/protparam/)预测蛋白质的相对分子质量、等电点、稳定性指数、脂肪系数、总平均亲水性等理化性质,利用PSORT(https://psort.hgc.jp/)在线工具预测菠萝VOZ蛋白的亚细胞定位。通过在线工具SOPMA(https://www.expasy.org/)预测蛋白质的二级结构,SWISS-MODEL(https://swissmodel.expasy.org/)对蛋白质的三维结构进行预测。
1.2.4菠萝VOZ转录因子家族的差异表达分析为研究不同非生物胁迫下菠萝VOZ家族基因的差异表达情况,利用Quant Studio 6 Flex的实时荧光定量PCR检测系统,采用UltraSYBR Mixture试剂盒(北京康为世纪)作为荧光试剂进行实时荧光定量PCR操作。建立10 μL的反应体系,每个处理样本设置3个重复。qRT-PCR反应程序为:95 ℃预变性10 min;95 ℃变性15 s,60 ℃退火/延伸1 min,40个循环;在60 ℃时收集荧光信号。根据AcoVOZ1和AcoVOZ2基因序列设计实时荧光定量PCR引物qAcVOZ1-F/qAcVOZ1-R和qAcVOZ2-F/qAcVOZ2-R(表1)。以菠萝Actin基因作为内参基因,设计引物qAcoActF / qAcoActR。通过实时荧光定量PCR仪自带软件(QuantStudioTM6 Flex)获得各个样品的Ct值,以0 hpi的表达量为对照,运用2-ΔΔCt法进行数据统计,并对数据采用邓肯新复极差法进行方差分析[12],确定AcoVOZ1、AcoVOZ2的相对表达量。
2 结果与分析
2.1 菠萝VOZ转录因子家族基因扩增
PlantTFDB 4.0显示,菠萝VOZ转录因子家族有2个成员,分别为AcoVOZ1和AcoVOZ2。AcoVOZ1基因包含一个长度为1 542 bp的开放阅读框(ORF),编码513个氨基酸;AcoVOZ2基因包含一个长度为1 782 bp的开放阅读框(ORF),编码593
个氨基酸。以菠萝叶片cDNA为模板,通过RT-PCR扩增得到的AcoVOZ1扩增产物约1 500 bp,AcoVOZ2扩增产物约1 800 bp(图1),与预期大小相一致。
2.2 菠萝VOZ转录因子家族特征结构分析
利用DNAMAN对菠萝AcoVOZ1(Aco000305.1)和AcoVOZ2(Aco005321.1)、拟南芥AtVOZ1(AT1G28520.1、AT1G28520.2)和AtVOZ2(AT2G42400.1)、水稻OsVOZ1(LOC_Os01g54930.1)和OsVOZ2(LOC_Os05g43950.1)的VOZ基因编码的蛋白进行多序列比对分析,发现AcoVOZ1、AcoVOZ2与拟南芥、水稻的VOZ转录因子家族存在相似的2个保守域A和B。菠萝AcoVOZ1的保守域A由约87个氨基酸残基组成,位置为27~113,B由约217个氨基酸残基组成,位置为221~437;AcoVOZ2保守域A由约83个氨基酸残基组成,位置为129~211,B由约206个氨基酸残基组成,位置为325~530。多重序列比对分析结果显示B的氨基酸残基Lys(K)和Leu(L)高度保守(图2)。
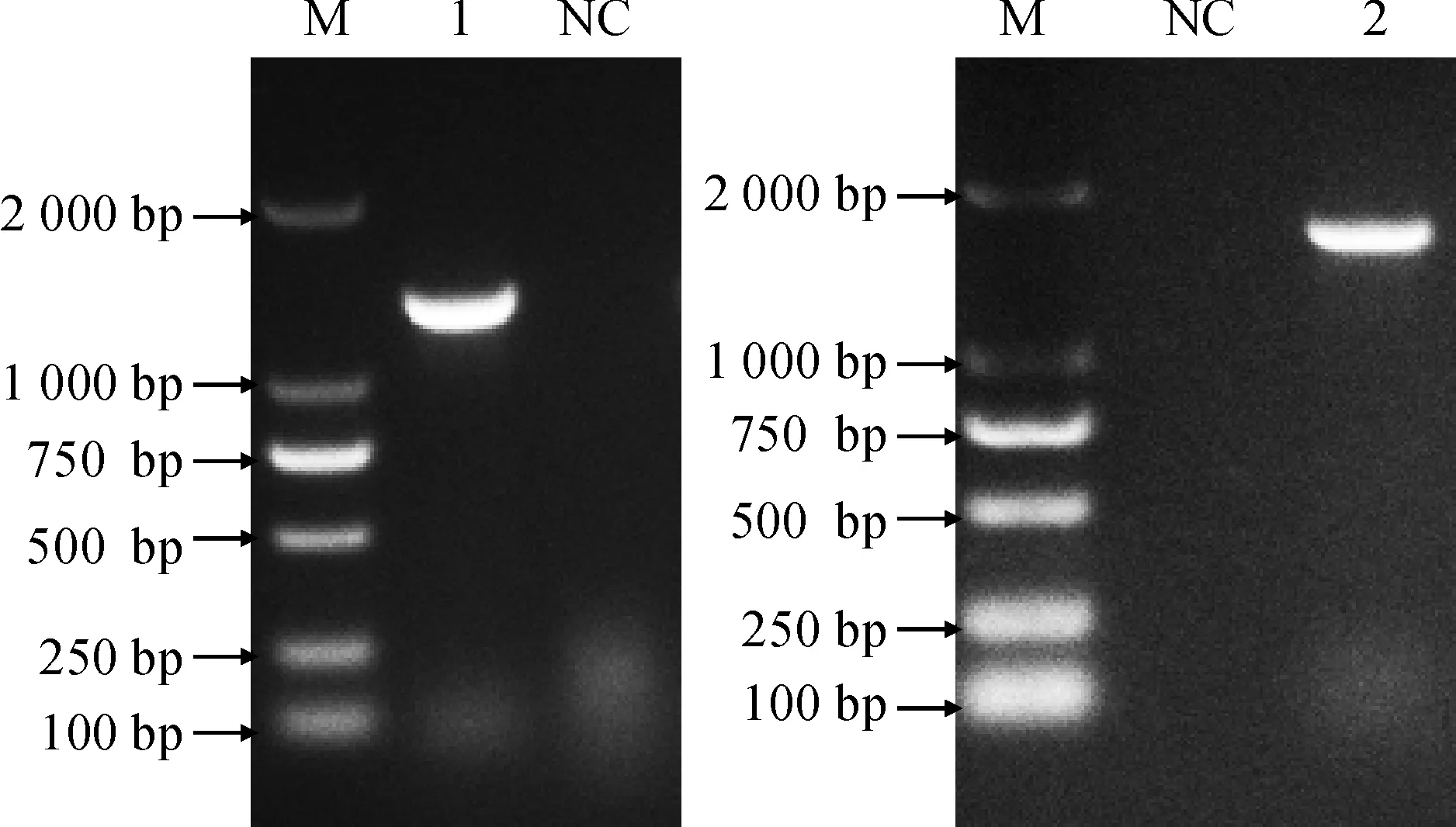
M. DL2000; 1. AcoVOZ1;2. AcoVOZ2;NC.阴性对照图1 菠萝VOZ家族基因的扩增M.DL2000;1. AcoVOZ1;2. AcoVOZ2;NC. Negative controlFig.1 Amplification of VOZ genes from pineapple

AcoVOZ1、AcoVOZ2.菠萝;AtVOZ1、AtVOZ2.拟南芥;OsVOZ1、OsVOZ2.水稻图2 菠萝与拟南芥、水稻VOZ家族特征结构域的多重序列比对AcoVOZ1, AcoVOZ2. Pineapple; AtVOZ1, AtVOZ2. Arabidopsis; OsVOZ1, OsVOZ2. RiceFig.2 Multiple sequence alignment of VOZ family in pineapple, Arabidopsis and rice
2.3 菠萝VOZ转录因子家族理化性质及亚细胞定位
通过ExPaSy-ProtParam Tool对AcoVOZ1、AcoVOZ2编码蛋白的理化性质进行了分析,结果表明,AcoVOZ1编码的蛋白质分子式为C2497H3897N715O769S17,相对分子质量为56.78 kD,等电点为5.97,不稳定系数为55.18,脂肪系数为74.62,亲水平均数为-0.586;AcoVOZ2编码的蛋白质分子式为C2883H4453N811O899S17,相对分子质量为65.40 kD,等电点为5.36,不稳定系数为45.47,脂肪系数为73.17,亲水平均数为-0.547。因此,预测这2个蛋白都为不稳定亲水酸性蛋白。
利用PSORT对AcoVOZ1和AcoVOZ2进行亚细胞定位预测,结果显示,AcoVOZ1蛋白定位于细胞核的可能性为47.8%,AcoVOZ2蛋白定位于细胞核的可能性为69.6%,表明AcoVOZ1和AcoVOZ2定位于细胞核内。
2.4 菠萝VOZ转录因子家族结构预测
通过在线分析工具SOPMA 对AcoVOZ1、AcoVOZ2蛋白的二级结构预测分析结果表明(图3),AcoVOZ1蛋白二级结构主要元件是α-螺旋(39.77%)和无规则卷曲(38.79%),其次是延伸链(12.28%)和β-转角(9.16%);AcoVOZ2的蛋白二级结构主要元件是无规则卷曲(40.3%)和α-螺旋(38.28%),其次是延伸链(13.32%)和β-转角(8.09%)。
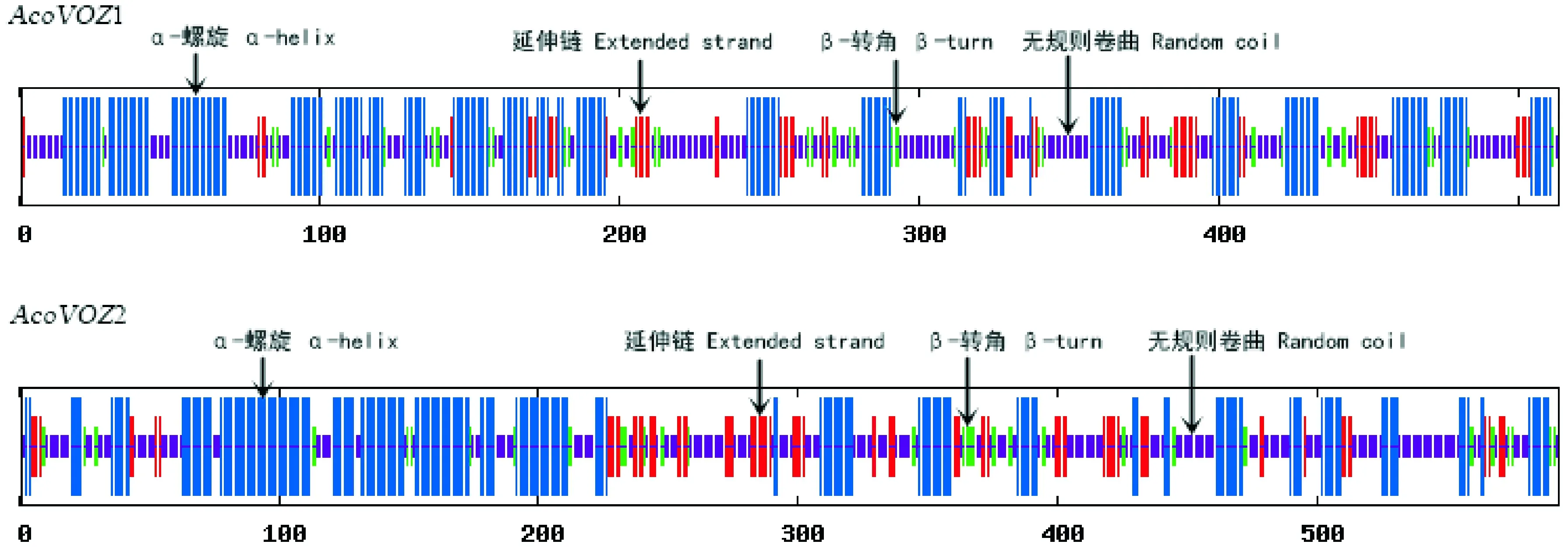
横坐标表示氨基酸序列位点图3 菠萝VOZ家族的二级结构预测The abscissa indicates the position of the amino acid sequence.Fig.3 Secondary structure prediction of VOZ family in pineapple
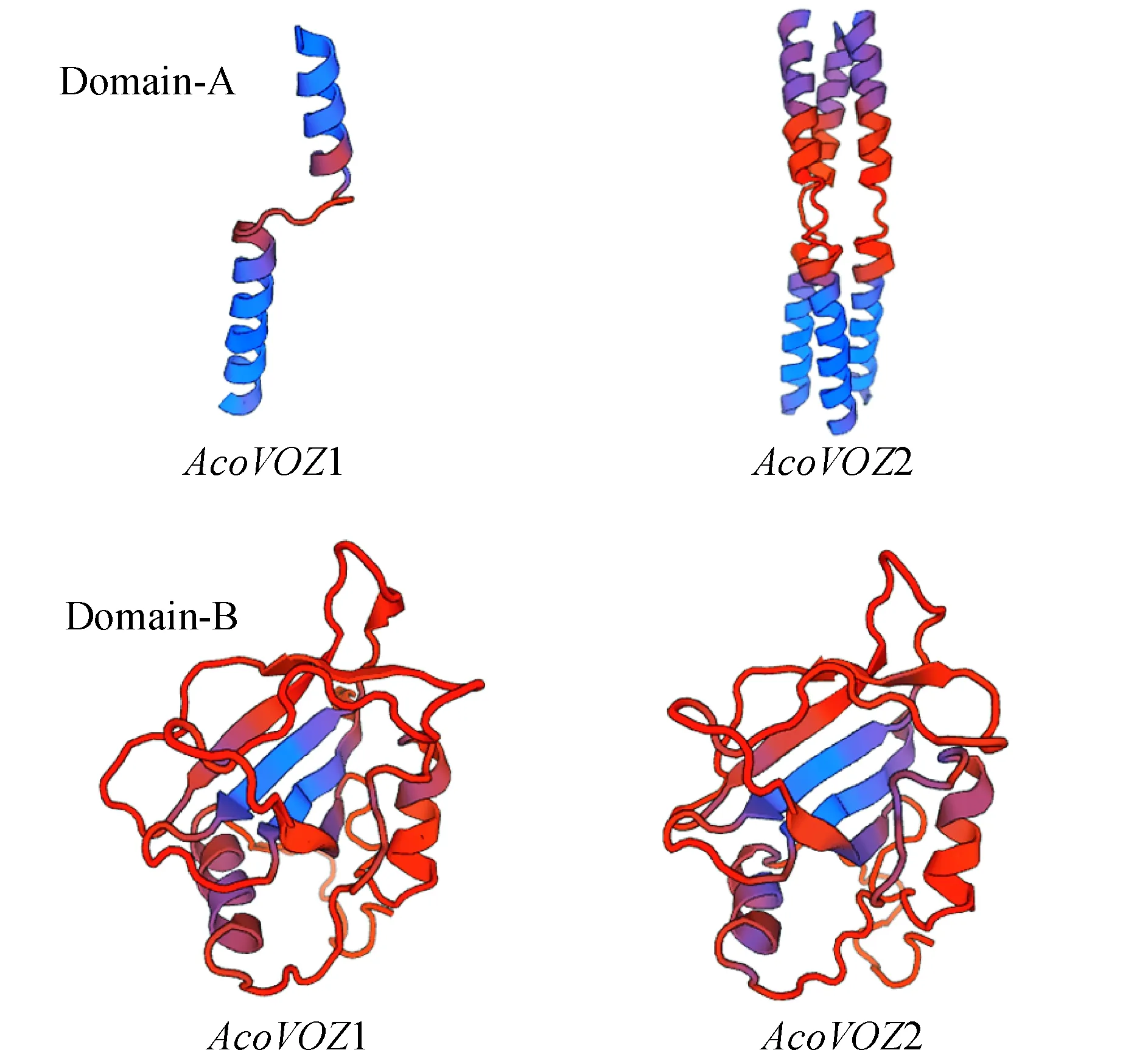
图4 菠萝VOZ家族保守域A和B的三级结构预测Fig.4 Tertiary structure prediction of domain A and B of VOZ family in pineapple
基于同源建模原理,通过SWISS-MODEL软件对菠萝AcoVOZ1、AcoVOZ2和拟南芥AtVOZ1(AT1G28520.1)、AtVOZ2(AT2G42400.1)蛋白中保守域A和B的三维结构进行预测(图4),在保守域A中,AcoVOZ2含有3个螺旋—环—螺旋结构,而AcoVOZ1只有1个螺旋—环—螺旋结构;在保守域B中,AcoVOZ1与AcoVOZ2结构类似,根据结构决定功能的原理,推测AcoVOZ1与AcoVOZ2功能上也具有相似性。
2.5 不同非生物胁迫下菠萝VOZ家族基因的表达分析
以菠萝Actin基因为内参基因,0 h处理为空白对照组。利用实时荧光定量PCR检测并分析了不同非生物胁迫下菠萝VOZ家族基因的表达程度。
盐(NaCl)胁迫条件下(图5,A),AcoVOZ1和AcoVOZ2的表达量呈显著下降趋势,并在48 h之后趋于稳定,整个过程中AcoVOZ1的表达量均高于AcoVOZ2;PEG6000胁迫条件下(图5,B),在处理12 h后,AcoVOZ1和AcoVOZ2的表达量均明显上升,其中AcoVOZ1的表达量达到对照的2.6倍,随后均显著下降,但AcoVOZ1在120 h时显著升高至对照的2.8倍;甘露醇胁迫条件下(图5,C),AcoVOZ1和AcoVOZ2的表达量呈显著下降趋势,并在24 h之后趋于稳定;H2O2胁迫条件下(图5,D),在处理12 h后,AcoVOZ1表达量明显上升,随后下降,在48 h时上升至对照组的6.5倍,随后下降,而AcoVOZ2在H2O2处理后的表达量显著下降,随后在48 h时陡然上升后迅速下降,最后恢复至处理前水平;干旱胁迫条件下(图5,E),在处理12 h后,AcoVOZ1和AcoVOZ2的表达量均明显下降,并在24 h后趋于稳定。
乙烯利(Eth)胁迫条件下(图5,F),在处理1 h后,AcoVOZ1的表达量明显下降并趋于稳定,在72 h时陡然上升,且达到对照的3.2倍,而在Eth处理后AcoVOZ2的表达量显著下降并趋于平稳;水杨酸(SA)胁迫条件下(图5,G),在处理1 h后,AcoVOZ1的表达量显著上升至对照的3.4倍,并在6 h恢复至处理前水平,而在SA处理后AcoVOZ2的表达量显著下降并趋于平稳;脱落酸(ABA)胁迫条件下(图5,H),AcoVOZ1的表达量呈下降趋势,而AcoVOZ2的表达量迅速下降,随后在12 h时上升后缓慢下降,但总体低于对照水平;低温(4 ℃)胁迫条件下(图5,I),AcoVOZ1和AcoVOZ2的表达量呈明显下降趋势,整个过程中AcoVOZ1的表达量均高于AcoVOZ2。
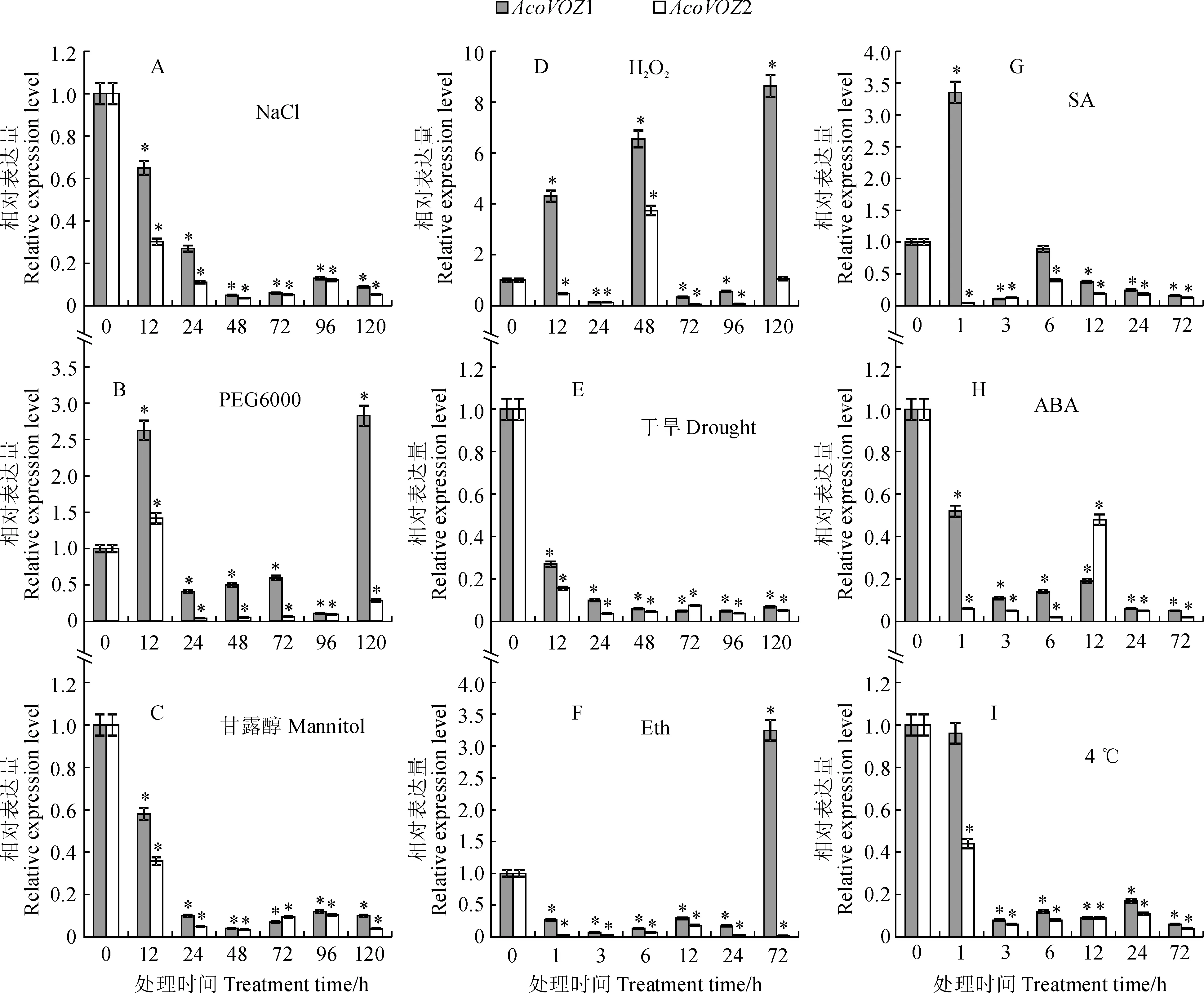
*表示在处理与对照0.05水平上差异显著图5 菠萝VOZ转录因子家族在不同非生物胁迫下的表达* indicates significant difference between treatments and control at 0.05 levelFig.5 Expression analysis of VOZ transcription factors in pineapple under different abiotic stress treatments
3 讨 论
植物遇到干旱、盐碱、极端低温等非生物胁迫时,可以在生理生化和细胞水平上产生响应,以适应或忍耐环境胁迫,实现正常的生长发育,确保作物产量和质量[13]。在这个响应过程中,转录因子能够与逆境胁迫相关基因的启动子区域的作用元件结合,正向或负向调控相关基因的表达[14],VOZ转录因子便是其中一类。VOZ转录因子已经在拟南芥[15]、水稻、苔藓中得到鉴定,并在调控非生物胁迫响应中发挥重要的作用。
本研究通过生物信息学方法,分析了菠萝VOZ转录因子家族成员的理化性质、二级结构、三级结构等信息,表明AcoVOZ1和AcoVOZ2蛋白都为不稳定亲水酸性蛋白,与拟南芥、水稻VOZ转录因子家族进行序列比对后发现,VOZ蛋白均包含2个保守域,且保守域B在三级结构上具有一定的相似性,推测它们在功能上也十分相似。qRT-PCR结果显示,在不同非生物胁迫下,AcoVOZ1和AcoVOZ2的表达量与对照差异显著,这表明AcoVOZ1和AcoVOZ2对非生物胁迫有响应。Nakai等[16]研究认为拟南芥中VOZ蛋白调节各种逆境,许多与逆境相关的基因在正常生长状况下发生了改变,与逆境应答基因的改变相一致,抗冻性和抗旱性在双突变体voz1voz2中増加,这与本研究结果较为类似。但拟南芥的VOZ基因的双突变体voz1voz2对病原真菌和病原细菌的抗性却受到了严重的抑制,这可能与非生物胁迫与生物胁迫的机理不同有关。
植物对非生物胁迫的响应极为复杂,非生物胁迫引起的植物生理生化指标改变由植物体内的保护系统和相关基因表达共同调控的,且基因的表达具有组织特异性[17]。本研究中,在盐(NaCl)、干旱、低温(4 ℃)、甘露醇、脱落酸(ABA)、乙烯利(Eth)胁迫下,AcoVOZ1和AcoVOZ2的表达量均呈显著下降趋势,推测它们以负调控机制响应盐(NaCl)、干旱、低温(4 ℃)等非生物胁迫的应答反应。Nakai等[18]发现在拟南芥中,过度表达VOZ2损害了冷冻和干旱胁迫的耐受性,即损害了非生物胁迫的耐受性,这与本实验的结果较为类似。
本研究初步确定了菠萝VOZ转录因子家族成员对盐(NaCl)、干旱、低温(4 ℃)等非生物胁迫中的响应效应,表明它们在调控非生物胁迫响应中发挥重要的作用。以上研究,加深了对菠萝非生物胁迫分子水平上的认识,同时也为后续对菠萝VOZ转录因子家族成员的功能和作用机制的研究奠定了基础。

