甜瓜细菌性果斑病抗性基因连锁的SSR分子标记
俞志杰, 宁雪飞, 王贤磊, 李 冠
(新疆大学生命科学与技术学院,新疆乌鲁木齐 830046)
甜瓜(CucumismeloL.)是葫芦科(Cucurbiaceae)甜瓜属(CucumisL.)1年生蔓性草本植物,基因组大小为 450 Mb[1]。甜瓜在国内外广泛种植,尤其新疆甜瓜在国内外享有盛誉,远销全国各地并出口到东南亚许多国家[2]。但近年来,细菌性果斑病已成为危害甜瓜产业的主要病害之一。国外研究报道,该病最早于1969年在美国福罗里达州被发现,近年来已迅速蔓延至13个国家和地区[3-4]。甜瓜大部分的经济损失是由细菌性果斑病引起的病害,病发严重时细菌性果斑病引起的损失超过90%,甚至绝收[5-6]。我国新疆、内蒙古、海南等9个省份的甜瓜作物曾大规模暴发细菌性果斑病[7]。
1978年Schaad等将甜瓜细菌性果斑病病原菌鉴定为类产碱假单胞菌西瓜亚种(Pseudomonaspseudoalcaligenessubsp.citrulli)[8]。1992年Willems等根据rRNA-DNA和DNA-DNA分子杂交的结果,将该病原菌更名为燕麦嗜酸菌西瓜亚种(Acidovoraxavenaesubsp.citrulli,简称Aac)[9]。在国内,赵延昌等最早对新疆甜瓜细菌性果斑病病原菌进行了鉴定,认为引起甜瓜细菌性果斑病发生的病原菌是燕麦嗜酸菌西瓜亚种(Acidovoraxavenaesubsp.citrulli),属革兰氏阴性菌[10]。田间发生瓜类细菌性果斑病主要是由于病原菌通过伤口和气孔侵染寄主,病害远距离传播是通过种子带菌进行传播[11-12]。目前,由于细菌性果斑病导致瓜类商品的经济效益严重下降,对瓜类产业造成威胁,因此,必须采取有效的措施防治该病害的发生。
目前,田间防治果斑病主要依靠含铜的化学药剂[13],长期使用化学试剂,不仅导致病原菌对化学试剂产生抗药性,而且污染环境、威胁人类的健康。而在选育抗果斑病品种方面,目前主要集中在传统杂交育种上。传统的杂交育种不仅耗时耗力还在表型选择上存在局限性,致使育种工作进展缓慢[14]。随着分子生物学研究的不断深入,利用分子标记辅助育种具有巨大的潜力,也为抗病育种提供了一项方便、快捷、高效的方法[15]。尤其是甜瓜基因组序列已于2012年6月公布[16],科研工作者利用基因组序列开展甜瓜相关的分子育种工作变得非常方便。因此,发掘抗细菌性果斑病资源,利用分子标记手段辅助培育高抗果斑病的新品种是解决问题的有效途径。虽然国外和国内的科学家在抗果斑病种质鉴定方面做出了很多努力,但关于抗果斑病基因的遗传机制研究较少,对遗传规律的发掘相对滞后[17],因此,研究甜瓜果斑病抗性基因的遗传分析及定位已迫在眉睫。本试验以辽宁神帅抗病品系和皮山奎瑞克感病品系的F2分离群体作为试验材料,采用集群分离分析法(bulked segregation analysis,简称BSA)和简单重复序列(simple sequence repeat,简称SSR)分子标记的方法进行果斑病抗性基因的遗传规律和定位研究,以期了解抗病品种辽宁神帅所含的抗性基因,为今后的抗果斑病基因精细定位和抗性种质资源应用于甜瓜品种的改良奠定基础。
1 材料与方法
1.1 试验材料
用于构建分离群体的抗病亲本材料辽宁神帅和感病亲本材料皮山奎瑞克,均由国家瓜类工程研究技术中心提供。果斑病病原菌采自国家瓜类工程技术研究中心试验田(新疆昌吉地区),在新疆大学生物工程研究中心冻存。
1.2 主要试验试剂
溴化十六烷三甲基铵(cetyltrimethyl ammonium bromide,简称CTAB)、β-巯基乙醇、聚乙烯吡咯烷酮(PVP-40)、Tris-base、RNase A等,均购自生工生物工程(上海)股份有限公司;用于PCR相关反应的试剂及Marker,均购自贝思汀生物科技有限公司;SSR引物由华大基因合成。其他分子试剂均为国产或进口分析纯。
1.3 试验方法
1.3.1 病原菌菌悬液的制备 果斑病病原菌的扩繁活化采用LB固体培养基(5 g胰化蛋白胨、2.5 g酵母提取物、2.5 g NaCl、7.5 g琼脂,用蒸馏水定容至500 mL,pH值为7.4),在28 ℃温度下培养36 h,并在无菌条件下挑取单菌落于LB液体培养基中,在28 ℃、220 r/min条件下培养24 h,用无菌水将菌悬浮液浓度调至5×108CFU/mL用于接种[18]。
1.3.2 接种及病情鉴定 抗病鉴定试验于2016年6—7月在新疆大学生物研究中心进行,将抗病亲本、感病亲本各10粒、F2分离群体120粒种子种植于营养钵中。当幼苗生长至2~4张真叶完全展开时(约生长25 d)[17],将待用的菌悬液采用喷雾接种的方法接种,并及时用塑料膜保温保湿。10~15 d充分发病后调查病情等级,本研究参照Hopkins等的分级标准[12],并适当修改(表1)。
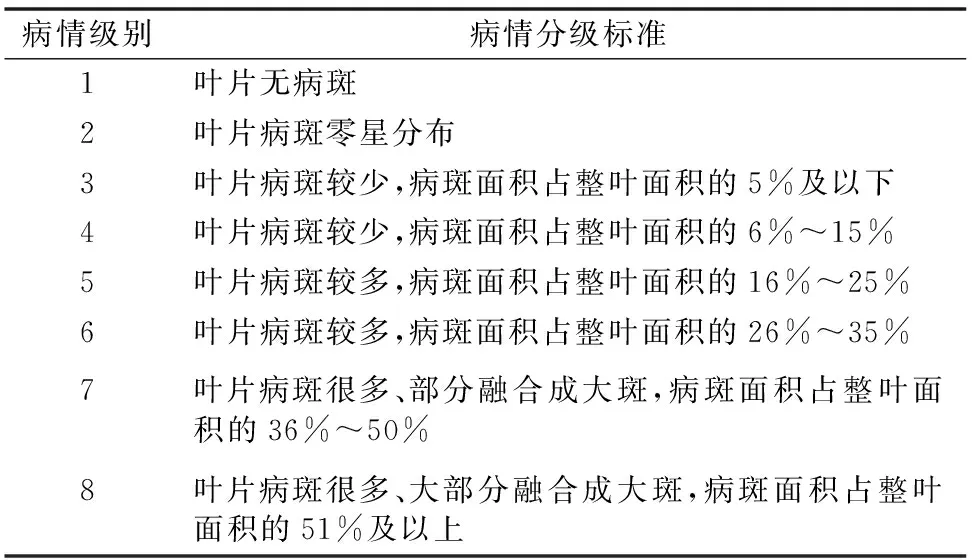
表1 单株幼苗感果斑病分级标准
1.3.3 抗感池的构建和基因组DNA的提取 用病情级别为 0~1级的21个极抗植株构建抗病池,用病情级别为7~8级的11个感病植株构建感病池。采用Porebski等的CTAB法[19]提取各单株的DNA,并将提取的DNA溶液稀释至 100 ng/μL,-20 ℃保存备用。
1.3.4 抗果斑病基因的初步定位 参照文献[20-21],均匀选取分布于甜瓜12条连锁群上的288个SSR标记,对2个基因池进行检测,筛选在抗病池、感病池之间表现多态性的SSR分子标记。SSR扩增体系为20.00 μL,其中DNA模板0.40 μL,10×PCR buffer(含15 mmol/L Mg2+)2.00 μL,上、下游引物(50 μmol/L)各0.20 μL,10 mmol/L dNTPs 0.40 μL,TaqDNA酶(Biomed,China,5 U/μL)0.24 μL,用ddH2O补足20.00 μL。SSR扩增程序:94 ℃预变性3 min;94 ℃变性 30 s,55 ℃退火30 s,72 ℃延伸30 s,35个循环;72 ℃延伸 5 min;4 ℃保存。SSR扩增产物用6%变性聚丙烯酰胺凝胶电泳检测,银染显色。
1.3.5 数据处理与初步定位的结果验证 用Excel 97-2003和JoinMap 4.0处理、分析试验数据。在抗病池、感病池之间有多态性的标记用F2个体验证,从而确定初步定位的结果。与感病亲本的带型相同记为“A”,与抗病亲本的带型相同记为“B”,F1带型记为“H”,缺失或模糊不清记为“-”。
2 结果与分析
2.1 F2群体抗性分析
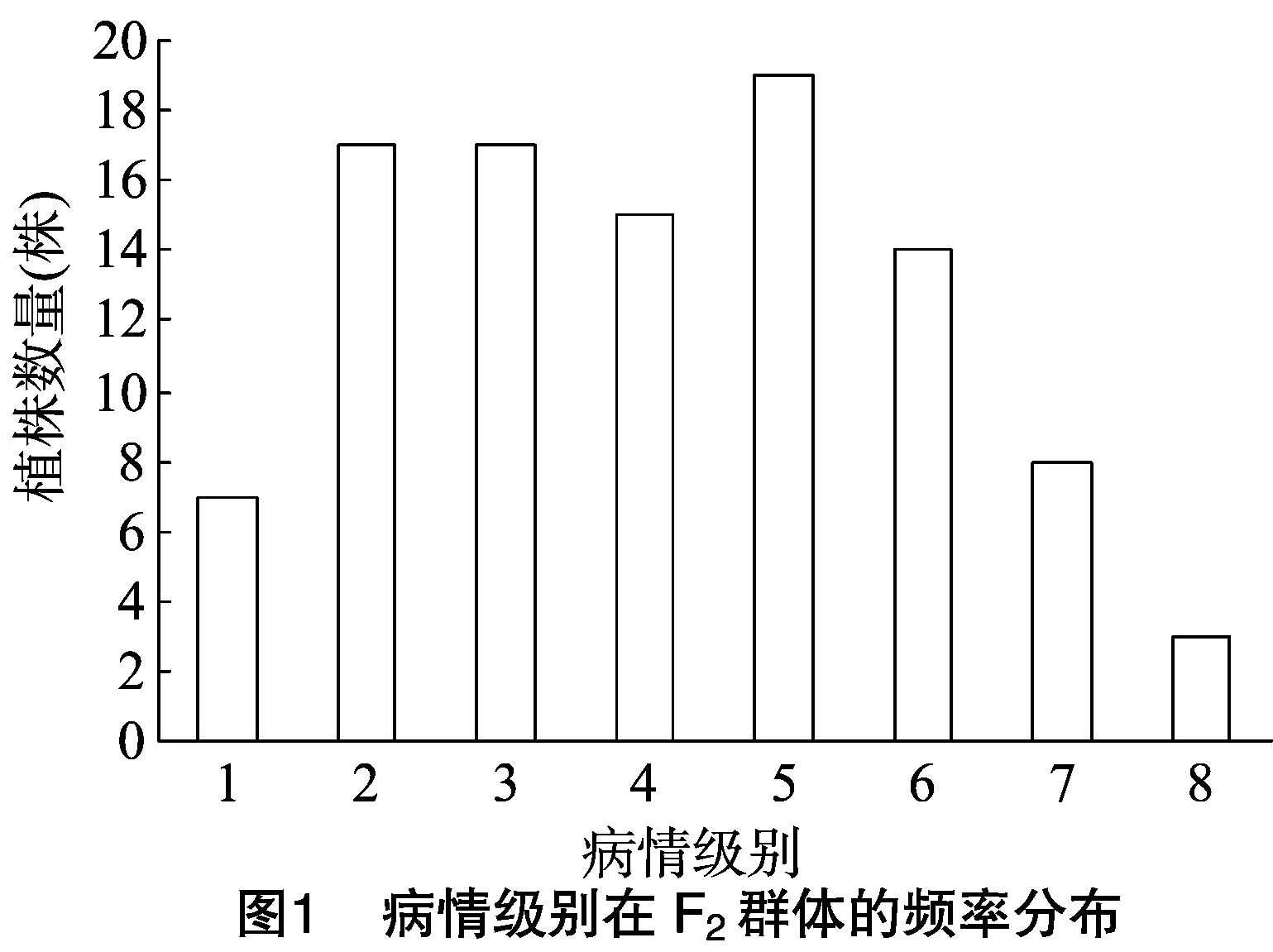
种植的120粒F2分离群体种子,除去未发芽和弱小植株外,对剩余的100株幼苗进行病情调查。由图1可知,将1~5级记为抗病,6~8级记为感病,F2世代的病情分级呈连续性分布,说明甜瓜抗果斑病基因属于数量性状位点(quantitative trait locus,简称QTL)。
2.2 抗病池、感病池引物的筛选
用288对SSR引物分别对抗病池、感病池进行PCR,经过多次重复后,由图2可知,有7对引物在抗病池、感病池之间能够稳定地扩增出多态条带,多态性比率为2.43%,依次为EMAGN73(95)、ECM122(96)、GCM336(101)、ECM53(102)、ECM231(106)、GCM246(111)、CMAGN61(114),其多态性引物序列如表2所示。7对标记都分布于连锁群(linkage group,简称LG)Ⅳ上,因此将抗果斑病基因初步定位到LGⅣ上。
2.3 初步定位结果验证
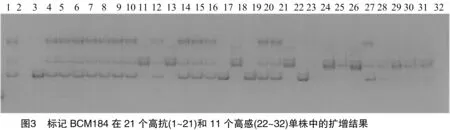
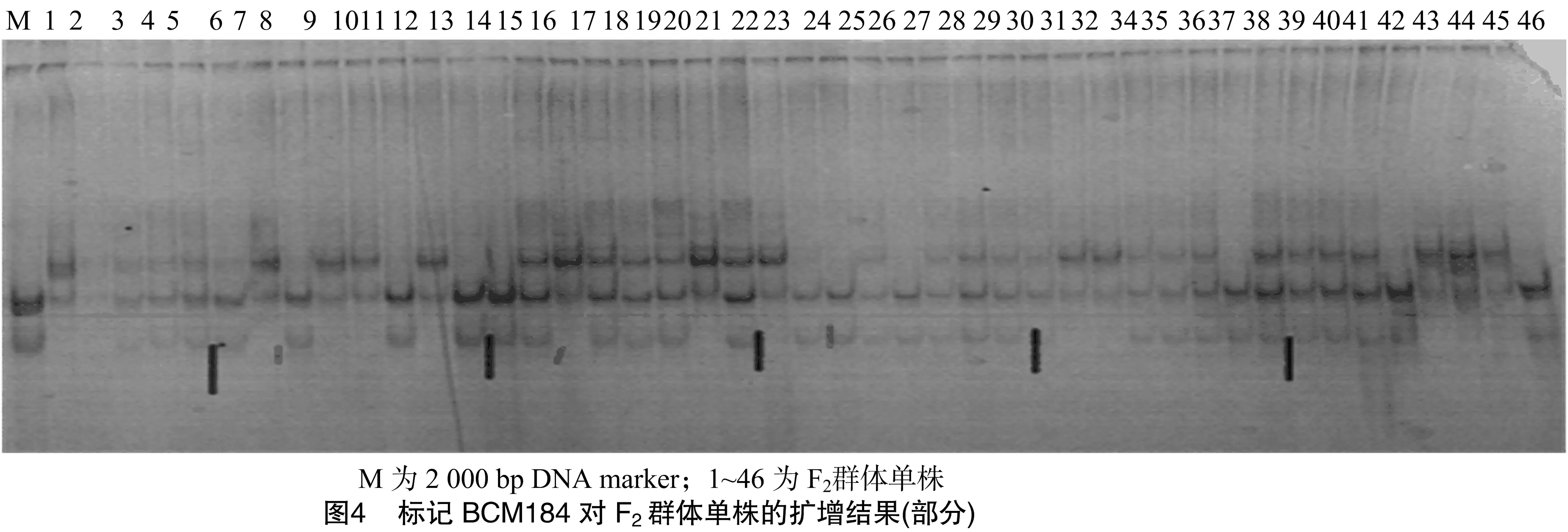
筛选出的7对引物分别在100个F2群体的单株中进行扩增、检测,其中BCM184标记与抗性基因连锁最为紧密。由图3可知,BCM184标记在21个高感单株中扩增,除个体2无扩增条带外,个体11、13、18均扩增出感亲多态性条带。在11高感单株中,个体24没有扩增出条带,个体23扩增出抗亲多态性条带。由此说明,BCM184标记与甜瓜果斑病抗性基因具有连锁关系。用100个F2分离群体进行个体验证(结果如图4),BCM184标记与抗果斑病基因的连锁距离为12.4 cM。

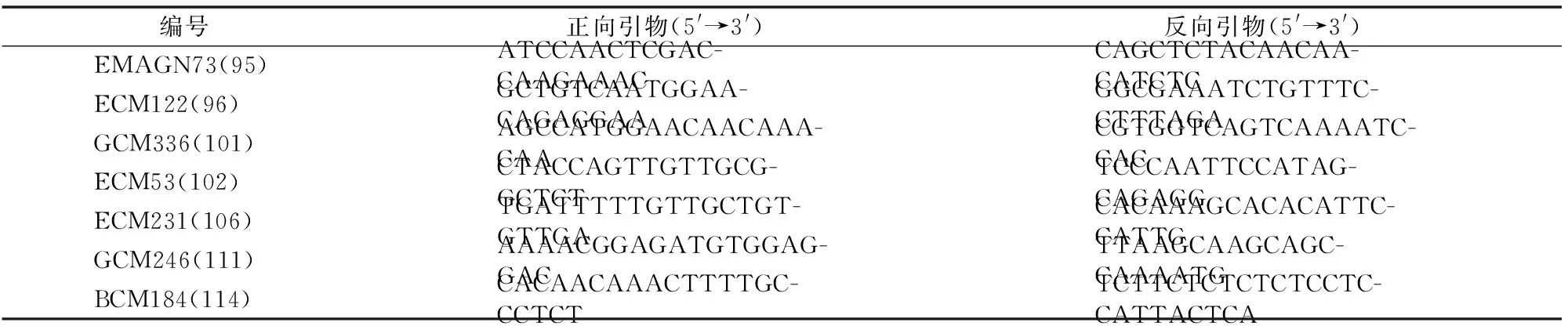
表2 抗感基因池间表现多态性的SSR引物
3 讨论与结论
关于果斑病的报道,国内外主要围绕瓜类细菌性果斑病病菌的分离检测、致病机制、遗传多样性及防治等方面的研究[13]。笔者所在实验室多年来一直从事甜瓜抗病研究,积累了较为丰富的经验,笔者认为果斑病已成为威胁甜瓜产业的主要病害之一,但其抗性基因的定位之所以鲜有报道,原因是抗病种质资源有待发掘、抗性基因的遗传机制符合QTL遗传等[22-23],导致后续定位难度增加。
国内外果斑病接种方法包括浸种法、喷雾法、瓜期接种法、离体法等。浸种法是将种子在菌液中浸泡10~12 h,虽然该方法能够快速接种,但会造成幼苗迅速死亡,损失率高达80%[24],因此不适合本试验接种。瓜期接种法一般选择开花授粉15 d后大小一致、健康、坐果节相同的甜瓜果实[7],此方法的缺点是不适合实验室等小规模试验,且周期较长。离体法具有简便、准确可靠、易于人工控制温度、湿度等外界环境因素,但此法与瓜期接种法的缺点相同。本试验采用的接种方法是喷雾法,李俊阁用浸种、喷雾、针刺、离体等4种方法对种质资源进行抗性种质的筛选,其中用喷雾法接种病原菌后对甜瓜叶片可溶性蛋白、过氧化物酶、多酚氧化酶、苯丙氨酸解氨酶等生理指标进行测定,结果发现抗病材料和感病材料有明显的差异[7]。通过苗期喷雾接种鉴定,调查植株所有叶片病斑面积大小统计病情指数,以此确定不同甜瓜材料之间的抗病指数,可以较准确地反映不同材料之间存在的差异[17]。
SSR标记相比于其他的分子标记如扩增的限制性内切酶片段长度多态性(amplified fragment length polymorphism,简称ARLP)、随机扩增多态性(randomly amplified polymorphism,简称RAPD)、相关序列扩增多态性(sequence-related amplified polymorphism,简称SRAP)等,明显的优势在于分布广、共显性、操作简单、高度可重复等[25-26]。因此,SSR标记被广泛应用于遗传图谱的构建、基因定位、分子辅助育种、种子纯度鉴定、亲子鉴定、遗产多样性等研究中[27-30]。近年来,利用SSR分子标记定位的甜瓜基因包括裂叶基因pll、矮化基因mdw1、短侧枝基因slb、抗白粉病基因Pm-2F、Pm-Edisto47-1、Pm-AN等[31]。鉴于SSR分子标记的诸多优点以及前人采用SSR分子标记技术在甜瓜多项研究中取得的良好试验结果,本试验采用SSR分子标记技术对甜瓜抗细菌性果斑病进行定位研究。
本试验中病情调查结果显示,F2抗病植株和感病植株分别有75、25株。因此,将抗病植株细化分为5个等级,而感病品种分为3个等级。BCM184标记在高感21个单株中扩增,扩增出17个抗亲多态性条带和F1多态性条带,3个感亲多态性条带。在高感单株中,扩增出2个抗亲多态性条带和F1多态性条带,8个感亲多态性条带。这一结论与表型性状相吻合,说明抗果斑病基因受部分显性基因控制。本试验对抗性品种辽宁神帅所含的抗性基因的遗传规律及所属连锁群的研究,为进一步开展甜瓜抗细抗菌性果斑病基因定位克隆和抗性甜瓜的选育奠定了基础。

