翘鳞香菇菌丝体多糖的分离纯化、抗氧化及体外抗肿瘤活性研究
陈艳娟 卢文露 张玉英 伍 燕
(兴义民族师范学院, 贵州 兴义 562400)
翘鳞香菇(Lentunussquarrosulus)属真菌界、担子菌亚门、层菌纲、伞菌目、多孔菌科、香菇属[1],春末夏秋子实体群生、丛生或叠生于腐木及倒伏木桩上[2],在我国主要分布于贵州、云南、四川、海南等地。翘鳞香菇可食用,老百姓俗称“八担柴”,在国内已可人工驯化栽培[3],是一种食用兼药用型真菌,其提取物具有抑菌作用[4]、免疫调节作用[5]、抗氧化作用[6]及潜在的抑制肿瘤功效[8]。
近年来研究表明,真菌多糖是一种优良的免疫抑制剂[10],从香菇子实体中提取的香菇多糖(lentinan),在临床上已作为抗肿瘤抑制药物使用[11],与香菇同属的翘鳞香菇在许多理化活性上也表现良好。本实验通过水煮醇沉得到粗多糖,进一步通过纤维凝胶柱分离纯化,得到翘鳞香菇精制多糖。采用红外对精制多糖的糖类特征吸收谱进行了研究,比较了粗多糖和精制多糖的抗氧化活性,并对精制多糖的体外抗肿瘤活性进行了初步研究,为进一步对该翘鳞香菇多糖的产品研发提供依据。
一、材料与方法
(一)材料与试剂
翘鳞香菇子实体采自贵州省册亨县,菌丝分离得到纯培养物保存于兴义民族师范学院微生物实验室[12]。氯化717阴离子交换树脂,索莱宝公司;DEAE-纤维素52,Sephadex G-100,上海瑞永生物科技公司;3500Mw透析袋,美国sigma公司;磷酸二氢钠、盐酸、硫酸、蒽酮、无水乙醇、氢氧化钠、葡萄糖:分析纯国药集团化学试剂有限公司。
(二)仪器与设备
旋转蒸发仪RE52-2型,上海亚荣生化仪器公司;恒温水浴锅HH-2型,江苏省金坛市新航仪器厂;真空冷冻干燥机LGJ-10,北京松源华兴科技有限公司;VERTEX 70傅里叶变换显微红外/拉曼光谱仪(德国Bruker公司);紫外分光光度仪Cary-60,安捷伦科技有限公司;Thermo Scientific Multiskan FC酶标仪,美国赛默飞公司。
(三)方法
1.翘鳞香菇菌丝多糖的提取、分离与纯化
翘鳞香菇菌丝以10%的接种量接种于马铃薯葡萄糖液体培养基中,28℃,静置培养20天,取出烘干后磨成粉待用。取5g干菌粉以料液比1:20的比例加入蒸馏水,沸水提取2h,收集提取液,重复一次。在提取液中加入无水乙醇,终浓度调整到75%,4℃冰箱过夜沉淀,离心、弃上清得粗多糖,干燥后复溶于水;采用717阴离子交换树脂脱色,sevage脱蛋白,粗多糖溶液过DEAE-纤维素52柱分离,用不同浓度的 NaCl溶液(0.05、0.1、0.2、0.3mol/L)洗脱,Sephadex G-100柱进一步纯化,收集多糖组分,透析除盐后冷冻干燥,得到精制翘鳞香菇多糖[13]。蒽酮硫酸法测多糖含量[14]。
2.紫外、红外光谱分析
溶解适量的多糖样品,全波长扫描(扫描范围200~800nm);称取干燥的精制多糖样品1mg与50mg干燥的KBr晶体混匀研磨后压片,采用傅里叶变换红外光谱仪扫描分析(扫描范围400~4000cm-1)。
3.抗氧化活性实验
还原力测定[15]:配制粗多糖和精制多糖不同浓度样液 0.5、1.0、1.5、2.0 和 2.5mg/mL,取 1.5mL EP管6支,依次加入250μL的磷酸缓冲液(0.2M,pH6.6),不同浓度样液100μL(ddH2O作空白对照),1%(m/m)铁氰化钾 250μL,混匀后 50℃水浴20min,加入10%(m/m)三氯乙酸溶液250 μL终止反应,混匀取各样品上清液250μL于新的各EP 管中,加入 0.1%(m/m)氯化铁 250μL,静置10min,取200μL于96孔板中,在700nm处用酶标仪测定其吸光度,记为Ai;同时做空白处理,用ddH2O代替样品,本底吸光记为Aj,以Vc为阳性对照。重复3次,总还原力=Ai-Aj。
DPPH自由基清除测定[16]:配制粗多糖和精制多糖不同浓度样液 0.04、0.08、0.2、0.4、0.6、0.8 和1mg/mL,各取不同浓度样液100μL加入0.1 mmol/L DPPH乙醇溶液300μL,混匀后避光放置30min,取200μL在517nm波长处用酶标仪测定吸光度,记为A1;另取不同浓度样液100μL加入无水乙醇300μL,同法测定吸光度,记为A2;另取ddH2O 100μL加入DPPH乙醇溶液300μL,测定吸光度记为A0;以Vc为阳性对照。重复3次,DPPH 清除率 =[1-(A1-A2)/A0]×100%。
羟自由基清除测定[17]:配制粗多糖和精制多糖不同浓度样液 0.4、0.8、1.2、1.6、1.8 和 2.0mg/mL,取不同浓度样液100μL,依次加入9.0mmol/L水杨酸乙醇溶液 100μL、9.0mmol/L FeSO4溶液100μL、8.8mmol/L H2O2溶液 100μL启动反应,混匀后 37℃水浴30min,取200μL各样液在510nm波长处测定吸光度,记为Ai;另取试管以ddH2O代替样液,同法加入上述药品,同法测定,记为A0;另取试管以ddH2O代替样液和H2O2,测定吸光度,记为Aj;以Vc为阳性对照。重复三次,·OH 清除率 =[A0-(Ai-Aj)]/A0×100%。
4.MTT法抑制HELA肿瘤细胞增殖实验
取对数生长期的HELA细胞[18],用含10%胎牛血清DMEM培养液调整细胞浓度至1×105/mL。接种于96孔培养板,每孔加细胞悬液100μL(1×104个细胞)。实验设阴性对照组(含10%胎牛血清DEME培养液),翘鳞香菇多糖各浓度 (1200、600、300、150、75μg/mL), 阳 性 对 照(5-FU),共7组,每组设5个重复孔。培养置37℃、5%CO2和95%湿度条件下24h,每孔加入5 mg/mL的MTT磷酸缓冲液20μL,同样条件下继续培养4h,终止培养,弃去培养液,每孔加入150 μL的DMSO,待形成的甲臜颗粒溶解后,酶标仪490nm波长测定吸光度,按公式计算细胞生长抑制率:抑制率=1-实验孔A490平均值/对照空A490平均值。
5.数据统计分析
数据用Excel2016处理洗脱曲线和抗氧化数据、origin 8.0处理红外数据、GraphPad-Prism-5处理IC50值。
二、结果与分析
(一)翘鳞香菇菌丝体多糖的分离纯化
如图1所示,粗多糖过DEAE-52柱,以不同浓度NaCl洗脱后收集得到组分Ⅰ、组分Ⅱ和组分Ⅲ,三个组分的多糖洗脱液分别经3500Mw透析、冷冻干燥后,从组分Ⅲ得到白色晶体的精制多糖,组分Ⅰ和组分Ⅱ未收集到多糖。取10mg组分Ⅲ多糖复溶于2mL的ddH2O中,0.05mol/L的NaCl溶液作洗脱液过Sephadex G-100柱,收集吸光度较高的组分,透析冻干后得到精制翘鳞香菇多糖,经0.1%蒽酮硫酸法检测纯度为96.6%。
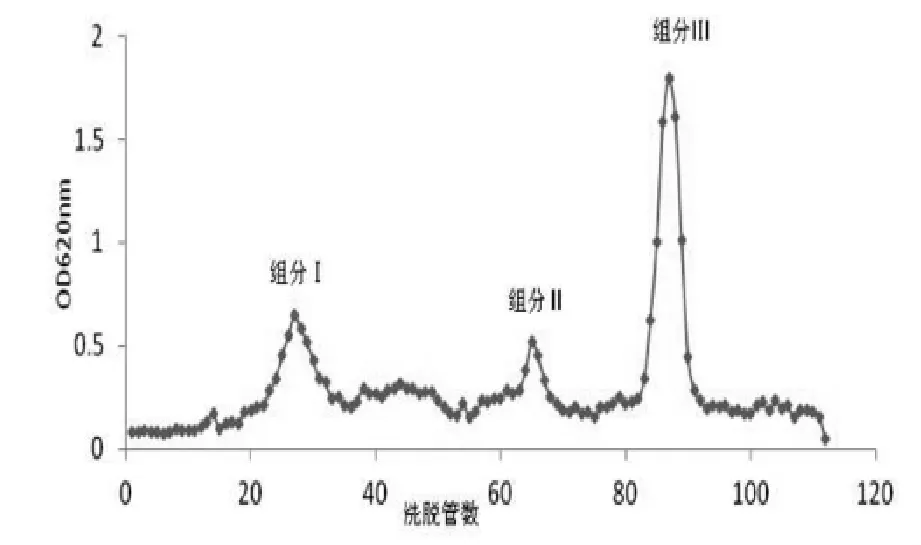
图1 翘鳞香菇菌丝体多糖通过DEAE-52柱洗脱曲线>Figure 1 Elution curve of L.squarrosulusmycelium polysaccharide on DEAE-52
(二)翘鳞香菇菌丝体精制多糖的紫外、红外分析
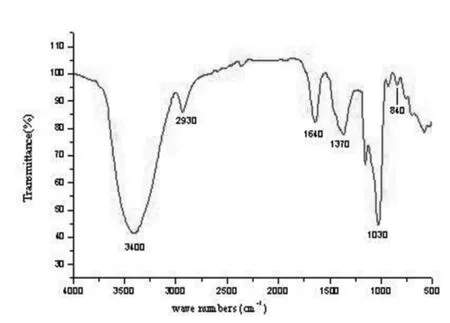
图2 翘鳞香菇多糖的红外光谱图Figure 2 FT-IR spectrum of purified L.squarrosulus polysaccharide
精制多糖紫外扫描,在260nm和280nm处无吸收峰,没有核酸和蛋白质杂质;傅里叶红外扫描如图2所示,3400cm-1处是多糖分子中O-H的伸缩振动引起的吸收峰;2930cm-1处是多糖中C-H或亚甲基伸缩振动峰;1640cm-1处为羰基伸缩振动;1370cm-1处是多糖类 C-H的变角振动;1030cm-1信号峰是C-O-H和吡喃糖环C-O-C中C-O键伸缩振动引起的。此外,840cm-1是典型的吡喃葡聚糖和β-型糖苷键连接特征吸收峰。由图谱分析可知,翘鳞香菇多糖为β-型葡聚糖构型[19]。
(三)翘鳞香菇精制多糖的抗氧化活性
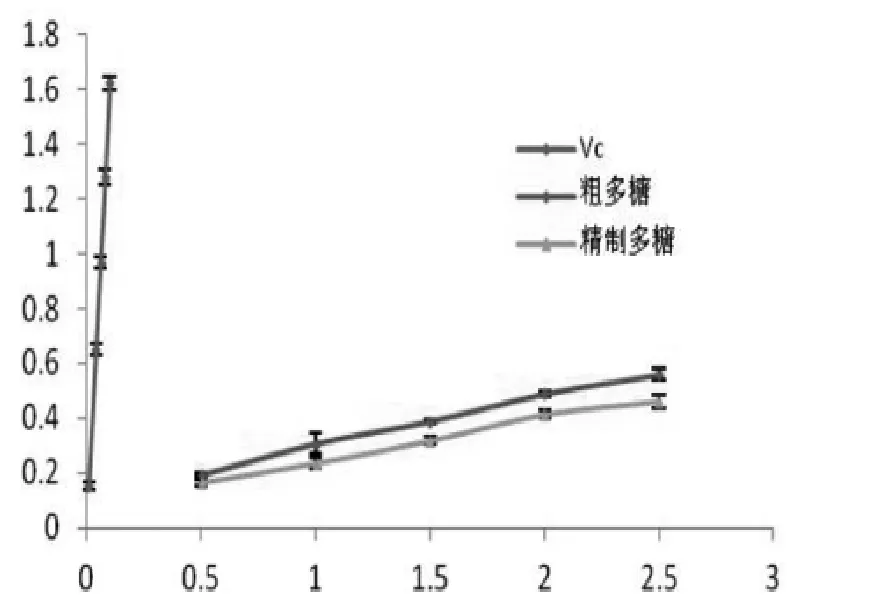
图3 翘鳞香菇精制多糖还原能力Figure 3 Reducing power of polysaccharides of L.squarrosulus
还原能力广泛用于评价抗氧化能力的大小,由图3可知,所测吸光度值越大,表明还原能力越强,翘鳞香菇菌丝粗多糖和精制多糖的还原力随均随多糖浓度的升高而升高,当质量浓度为2 mg/mL时,粗多糖的吸光度值是0.488±0.01,精制多糖的吸光度值为0.414±0.03,表明粗多糖和精制多糖在总还原力上有区别。
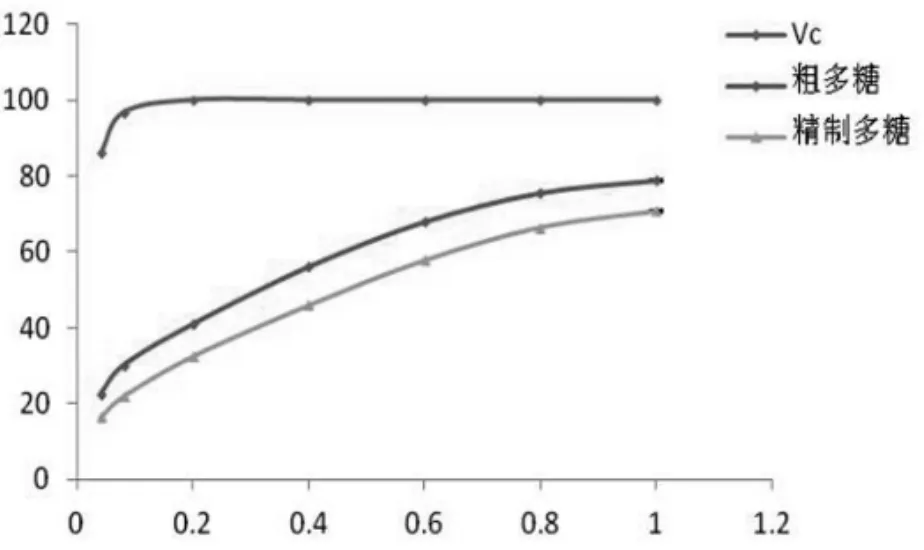
图4 翘鳞香菇多糖DPPH自由基清除能力Figure 4 DPPH radical scavenging activity of polysaccharides of L.squarrosulus
翘鳞香菇菌丝提取多糖对DPPH·的清除作用见图4,粗多糖清除率EC50值是0.394mg/mL,精制多糖清除率EC50值是0.54mg/mL,两者的清除率与质量浓度都有量效关系,粗多糖的EC50值小于精制多糖的EC50值,翘鳞香菇粗多糖对DPPH·的清除率方面优于精制多糖,质量浓度达到1.0mg/mL后清除率达到80%左右,抗氧化活性表现良好。
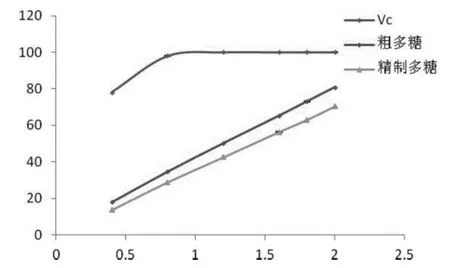
图5 翘鳞香菇多糖羟自由基清除能力(Figure 5 Hydroxylradicalscavenging activity of polysaccharides of L.squarrosulus)
由图5可知,翘鳞香菇菌丝体粗多糖、精制多糖和Vc羟自由基清除力与浓度均呈量效关系,粗多糖清除率EC50值是1.20mg/mL,精制多糖清除率EC50值是1.42mg/mL,随着浓度增大到2.5 mg/mL时与Vc的清除率相差不大,说明翘鳞香菇多糖具有略低于Vc的羟自由基清除力。
(四)翘鳞香菇菌丝体多糖抑制HELA肿瘤细胞增殖实验
由表1可知,在翘鳞香菇多糖浓度在75~1200μg/mL范围内,与阴性组和5-Fu阳性组相比,翘鳞香菇对HELA细胞具有显著抑制作用,并随浓度的增加,细胞的生长抑制率也随之升高,呈明显量效关系,IC50值用数据软件 Graph-Pad-Prism-5计算得712μg/mL。
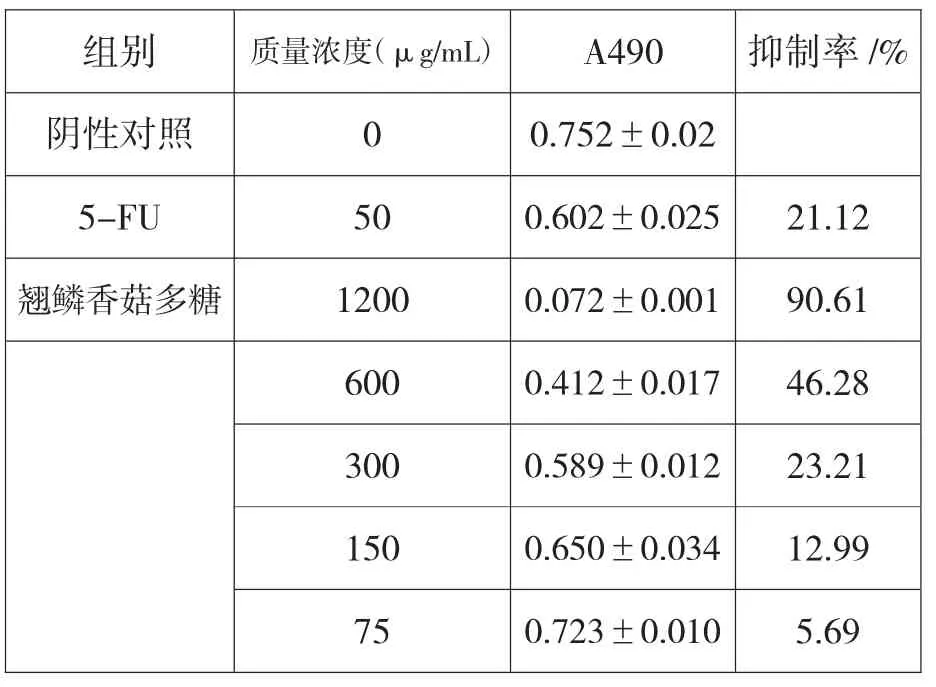
表1 翘鳞香菇多糖对HELA细胞生长抑制作用Table 1 Inhibitory effect of polysaccharides of L.squarrosuluson growth of HELA rumor cells(X±S,n=5)
三、讨论
本研究对深层发酵后的翘鳞香菇菌丝体进行粗多糖和精制多糖的提取,采用蒽酮硫酸法定量、红外和紫外定性,研究表明进一步纯化后的多糖为高纯度均一多糖,其红外特征谱显示是β-型葡聚糖构型为主。据文献报道[10],具有分支侧链的β-吡喃葡聚糖是抗肿瘤活性的主要物质。
翘鳞香菇粗多糖和精制多糖抗氧化实验比较表明,精制多糖在总还原力、DPPH·和·OH清除率方面没有粗多糖活性高,可能是sevage除蛋白过程中损失了部分有抗氧化活性的糖蛋白,或是透析过程除掉了一些可能具有相关活性的小分子。粗多糖成分复杂,精制多糖是均一多糖,故对精制多糖的提取和活性研究对深入了解其机理具有重要作用。
对HELA细胞的抑制实验表明,翘鳞香菇的菌丝体多糖具有良好的抗肿瘤活性,和李石军等人[18]研究香菇多糖LNT2对H22肿瘤细胞抑制比较,翘鳞香菇在抑制肿瘤细胞生长方面表现出来的活性和香菇多糖LNT2类似,都具有良好的抑制肿瘤细胞活性的能力。另一方面,据Bussaman等人[20]研究表明,翘鳞香菇菌丝培养特性良好,长势快,对翘鳞香菇子实体和菌丝体活性成分的分离纯化,可为深入了解其药理活性,为开发相关产品和产业化发展开提供理论依据。

