靶向HP-PRRSV ORF7基因siRNA体外抑制HP-PRRSV HN1株复制研究
曹素芳
(河南牧业经济学院动物医学院,河南郑州450046)
猪繁殖与呼吸综合征是由猪繁殖与呼吸综合征病毒引起的传染病,主要特点是母猪繁殖障碍,仔猪严重呼吸道疾病,公猪精液质量下降。该病最早发生于北美洲和欧洲[1,2]。自从1996年我国出现该病后长期存在。近年来,PRRSV不断发生变异,出现了高致病性毒株,其感染率、死亡率大大提高。尽管已有疫苗预防该病,但高致病性PRRSV毒力强,易变异,现有疫苗提供的保护有限,且目前仍无特效药,导致该病仍在我国呈广泛性区域流行。因此,寻找新的抗病毒策略,对控制高致病性PRRSV感染十分必要。
PRRSV包含12个开放性阅读框。其中ORF7基因编码PRRSV的核蛋白,该蛋白是最早产生的,且具有很好的抗原性,常被用作早期诊断抗原[3]。核蛋白间通过二硫键形成同源二聚体,参与病毒粒子的装配[4]。
目前,RNA干扰技术已经广泛用于病毒性疾病的控制,许多研究表明,靶向病毒特异性基因的小干扰RNA(small interference RNA, siRNA)具有明显的抗病毒效果,能显著抑制病毒的复制。近年来,国内外许多研究者应用RNA干扰技术对PRRSV ORF7基因进行了研究,Bao[5]、李治军[6]等利用人工合成法、杆状病毒介导法及腺病毒介导法对ORF7基因的RNA干扰分子抑制PRRSV进行了研究。本研究评价了靶向HP-PRRSV ORF7基因的siRNA重组质粒体外特异性抑制HP- PRRSV的复制,通过IFA试验,测定病毒滴度及有效感染持续时间的检测,观察到siRNA特异性抗病毒活性,以期为防控高致病性猪繁殖与呼吸综合征提供新的策略。
1 材料与方法
1.1 材料 质粒提取试剂盒,购自QIAGEN公司;抗PRRSV N蛋白特异性单抗、β-actin单克隆抗体,购自TaKaRa公司;脂质体转染试剂盒,购自Invitrogen公司;G418,购自Roeh公司;siRNA重组质粒pSilencer-N2、pSilencer-Negti ve和HP-PRRSV HN1株分别由本人构建保存。FITC标记羊抗鼠I,购自Santa Crus公司;Marc-145细胞由王旭光博士惠赠。DMEM培养,购自Gbico公司。
1.2 方法
1.2.1 siRNA重组质粒pSilencer-N2的大量制备与纯化 将冻存的含有重组质粒pSilencer-N2、阴性对照质粒pSilencer-Negtive(5′-AGCTT CTGACGACGGATCAGCGCTACTCTCTT GAAGTAGCGCTGATCCGTCGTGCG-3′)的细菌划线培养,挑取单个菌落接种于Amp+ LB中培养过夜,按质粒提取试剂盒说明书提取质粒,保存备用。
1.2.2 细胞中接种HP-PRRSV HN1株剂量及时间的确定
1.2.2.1 HP-PRRSV HN1最佳接种剂量 将Marc-145细胞培养至丰度约为80%,分别接种0.1MOI、0.01MOI和0.001MOI HP-PRRSV HN1株,48 h后用 500 μL 80%冷丙酮于-20 ℃固定细胞过夜,干燥,用PBS洗涤3次,每孔加入200倍稀释的抗PRRSV N蛋白荧光抗体200 μL,37 ℃温育1 h;弃抗体,用 PBS洗涤4次,于荧光显微镜下进行观察。在 200×视野下,每孔随机挑选10个视野进行照相,计算被荧光染色的细胞数目,以确定病毒最佳接种剂量。
1.2.2.2 HP-PRRSV HN1最佳接种时间 将Marc-145培养至丰度80%,按脂质体转染试剂盒的说明书分别转染pSilencer-N2和pSilencer-Negtive,转染后 6 h、12 h、18 h 和24 h分别以最佳接种剂量接种HP-PRRSV HN1,接毒后48 h收集细胞上清,按1.2.4方法进行TCID50测定,比较不同接毒时间pSilencer-N2对病毒的抑制效率,最终确定最佳接毒时间。
1.2.3 间接免疫荧光法(IFA)检测 siRNA 在转染细胞中对HP-PRRSV HN1的抑制 将Marc-145细胞培养至丰度约80%时,用无血清的DMEM洗涤3遍,分别将纯化后的3 μg重组质粒pSilencer-N2、pSilencer- Negti ve按照脂质体转染试剂盒的使用说明书转染Marc-145细胞,转染24 h后接种0.01细胞MOI HP- PRRSV HN1,同时做病毒对照和细胞空白对照。接毒48 h后收集所有细胞上清,-20 ℃保存备用。将细胞用胰酶消化,离心收集细胞,用PBS洗涤3次,取适量细胞滴在载玻片上,冷丙酮固定15min,PBS洗涤3遍,加N蛋白特异性单抗,37 ℃孵育l h,弃单抗,用PBST洗涤5次,弃尽洗液后,每片加1∶200稀释的FICT羊抗鼠IgG,37 ℃孵育l h,PBST洗涤4次,封片,荧光显微镜观察。
1.2.4 测定HP-PRRSV的TCID50各取100 μL上述收集的细胞上清进行10倍稀释(10-1~10-8),每个稀释度做3个重复,将各稀释度的病毒液接种于96孔板中已长成单层的Marc-145 细胞,每孔接种100 μL病毒液,培养48 h后,观察细胞病变,按Reed与Muench法[7]计算病毒的TCID50。
1.2.5 Western Blot检测 HP-PRRSV N 蛋白的表达 收获上述接种病毒48 h后的Marc-145细胞裂解,离心取上清,SDS-PAGE电泳,转移至NC膜上,NC膜用10%脱脂乳封闭过夜,加抗核蛋白单克隆抗体或抗β-actin单克隆抗体室温作用2 h,PBST洗涤3次,加辣根过氧化物酶标记的羊抗鼠抗体作用1 h,用PBST洗涤3次,用化学发光显色试剂盒显色。同时以β-actin为内参,检测其表达水平。
1.2.6 siRNA重组表达质粒抑制HP-PRRSV复制持续时间 将重组质粒pSilencer-N2和pSilencer- Negtive分别转染Marc-145细胞中,检测病毒感染后24 h、48 h、72 h、96 h和120 h的细胞病变,同时测定病毒滴度。
1.2.7 统计分析 所有的数据用SPSS16.0软件进行统计分析,差异显著(P< 0.05)。
2 结果
2.1 HP-PRRSV最佳接种剂量 分别以0.1 MOI、0.01 MOI和0.001 MOI接种转染siRNA的Marc-145细胞,48 h后进行直接免疫荧光检测,结果表明,当接毒量为0.1 MOI和0.001 MOI 时,荧光显微镜视野中出现了少量的荧光细胞,而接毒剂量为0.01 MOI时,视野中几乎均是荧光细胞,细胞感染HP- PRRSV近100%(见中插彩版图1),故此确定HP-PRRSV 最佳接种剂量为0.01 MOI。
2.2 HP-PRRSV最佳接毒时间 将pSilencer-N2和pSilencer-Negtive分别转染Mac-145细胞,6 h、12 h、18 h、24 h后分别接种0.01 MOI HP-PRRSV HN1株,接毒后48 h收集细胞上清,测定其TCID50,统计分析结果(图2),与转染pSilencer-Negtive细胞上清中病毒的TCID50相比,当转染24 h后接种HP- PRRSV 时,pSilencer-N2对HP-PRRSV HN1株的抑制效率最高,转染pSilencer-N2的细胞上清中病毒 TCID50显著下降(P<0.05),而转染后6 h、12 h和18 h接种HP-PRRSV HN1株时pSilencer-N2干扰病毒效果不明显,与pSilencer-Negtiveg组TCID50相比差异不显著。从而确定转染后24 h为最佳接种时间。
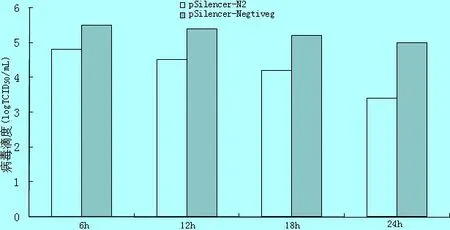
图2不同时间接种0.01MOIHP-PRRSV干扰效果比较
2.3 IFA法检测pSilencer-N2对HP-PRRSV的抑制作用 荧光显微镜观察,红色为N蛋白阴性细胞,绿色为N蛋白阳性细胞。IFA结果显示,pSilencer-N2转染细胞中的N蛋白阳性细胞明显比pSilencer-Negative转染细胞中的少,而pSilencer-Negative转染细胞中的N蛋白阳性细胞数和未转染的接毒对照细胞相比,变化不明显(见中插彩版图3)。
2.4 病毒滴度的测定 将pSilencer-N2和pSilencer-Negtive分别转染96孔板中Marc-145细胞,转染后24 h接种HP-PRRSV HN1株,48 h后测定各孔病毒滴度TCID50,结果发现,与病毒对照(105.6TCID50/mL)和pSilencer-Negtive(105.4TCID50/mL)转染孔相比,pSilencer-N2转染孔的病毒滴度(103.0TCID50/mL)降低了2.6个数量级(图4),表明pSilencer-N2能够显著抑制HP-PRRSV在Marc-145细胞中的复制。
2.5 Western Blot检测 用抗HP-PRRSV N 蛋白的单克隆抗体进行Western Blot检测N蛋白表达水平,结果显示,与病毒对照和pSilencer-Negtive转染孔相比,pSilencer-N2能显著抑制HP-PRRSV N蛋白的表达,蛋白条带明显减弱(图5)。
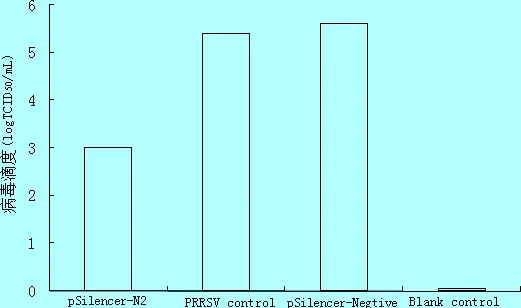
图4TCID50检测siRNA对HP-PRRSV抑制效果
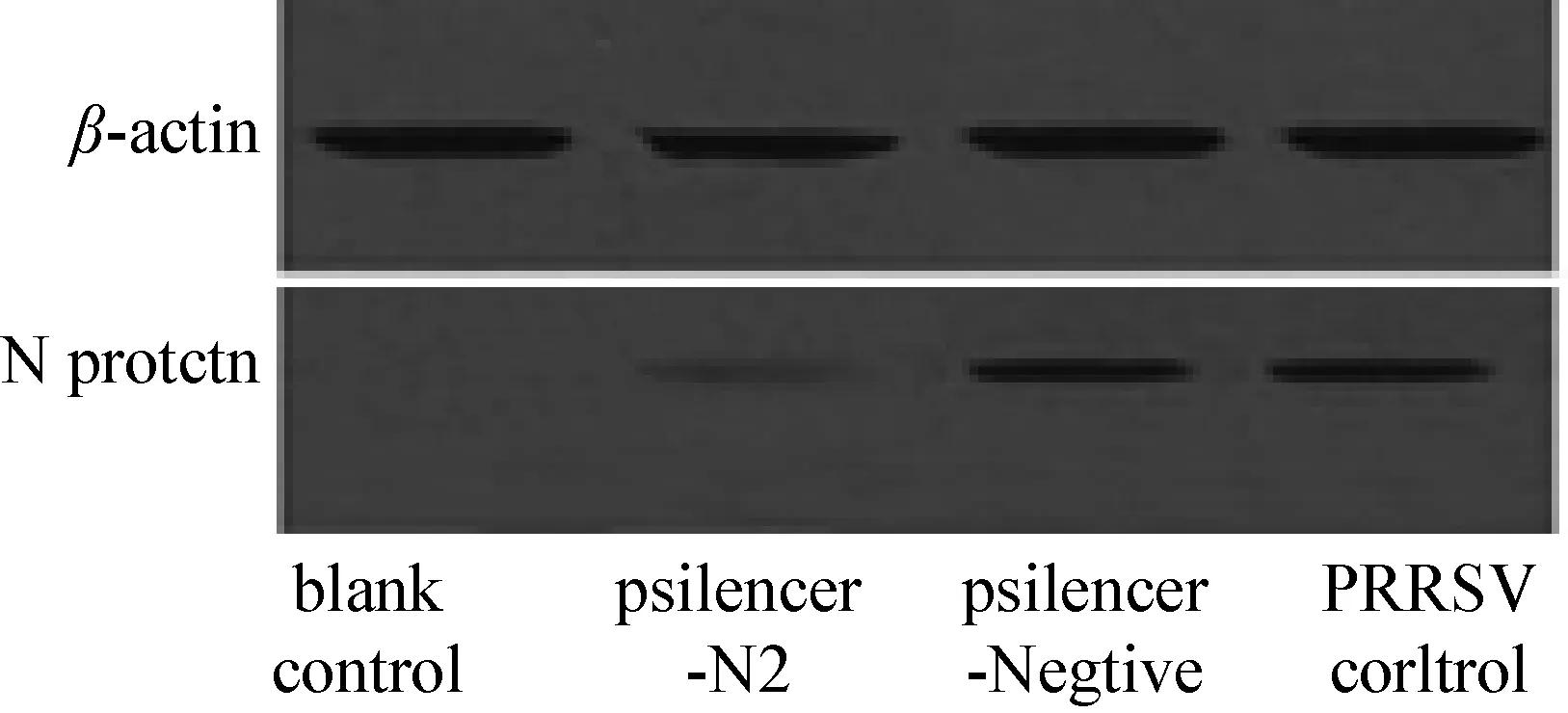
图5 Western Blot 检测
2.6 有效干扰持续时间检测 将siRNA重组质粒pSilencer-N2和对照质粒pSilencer-Negtive分别转染Marc-145细胞,24 h、48 h、72 h、96 h和120 h后观察细胞病变,并测定细胞上清中病毒TCID50。结果表明,与病毒对照和pSilencer-Negtive组相比,转染pSilencer-N2的Marc-145细胞显著抑制HP-PRRSV的增殖,在病毒感染后72 h才出现的细胞病变,到96 h才出现明显的细胞病变,推迟CPE 的发生时间 (图6)。与pSilencer-Negtive组相比,从24 h到 96 h pSilencer-N2实验组TCID50显著下降(P<0.05),至96 h时升高达到对照组水平,表明筛选出的有效siRNA对HP-PRRSV的显著干扰时间可持续96 h(图7)。
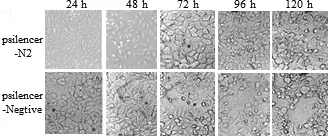
图6 siRNA对HP-PRRSV持续抑制的细胞病变观察
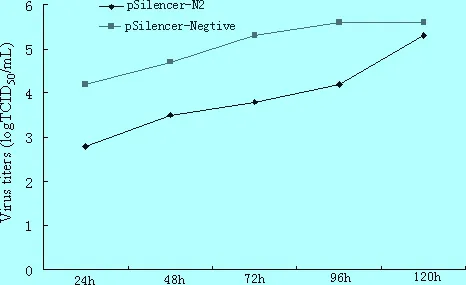
图7 siRNA持续抑制HP-PRRSV 在Marc-145细胞中的复制
3 讨论
RNAi是生物自身体内的一种防御机制,也是抗病毒治疗强有力的工具。许多研究表明,人工合成的siRNA或用质粒、病毒载体介导siRNA均可实现对病毒复制的干扰,因此RNAi在抗病毒感染中发挥着重要的作用。鉴于目前还没有有效防控高致病性猪繁殖与呼吸综合征手段,寻找新的抗病毒策略十分必要。
ORF7编码PRRSV的核衣壳蛋白(N蛋白),N蛋白不但是PRRSV的主要抗原,且参与病毒粒子的组装。如果利用RNAi技术抑制N蛋白基因的表达,就会阻止PRRSV的组装,从而抑制PRRSV的复制。前期研究表明,siRNA重组质粒pSilencer-N2在细胞中能有效抑制N蛋白基因的表达,本试验继续探索其体外对HP-PRRSV复制的抑制效果,结果表明,在HP-PRRSV最适接毒剂量0.01MOI和最佳接毒时间24 h的条件下,病毒感染后48 h,通过间接荧光免疫试验、病毒滴度测定及N蛋白表达检测,结果显示,表明pSilencer-N2能够显著抑制HP-PRRSV在Marc-145细胞中的复制,与病毒对照和阴性对照质粒pSilencer-Negtive转染孔相比,pSilencer-N2转染孔的病毒滴度降低了2.6个数量级,且能明显抑制N蛋白基因在表达。然而,本试验观察到pSilencer -N2在Marc-145细胞中并未完全抑制HP-PRRSV,究其原因可能有以下几点:一可能是转染siRNA重组质粒的剂量及与脂质体的比例没有进行有效优化。本试验转染siRNA重组质粒为3 μg,与脂质体的比例的1∶2,而黄良宗等[8]转染干扰质粒的量为0.7 μg,与脂质体的比例为1∶1,黄娟[9]转染干扰质粒的量却为0.4 μg,与脂质体的比例为1∶3;二可能是与选择靶序列的位点有关。本研究选择的靶向HP-PRRSV N蛋白基因的N179位点,尽管对HP-PRRSV有很好的抑制效果,但不能完全抑制HP-PRRSV在细胞中的复制,杨闽楠等[10]选择PRRSV N蛋白基因的N12、N23、N263个靶位点,研究证明N12干扰靶位可以高效抑制PRRSV的增殖,说明N蛋白基因高效siRNA靶位点的选择对siRNA干扰病毒的复制至关重要;三可能是HP-PRRSV变异快,在培养细胞中可能出现逃逸现象,从而逃脱了siRNA的干扰,导致HP-PRRSV在感染细胞中大量复制。
对siRNA干扰的持续时间检测结果表明,与病毒对照和阴性干扰质粒Silencer-Negtive组相比,转染siRNA重组质粒pSilencer-N2在Marc-145细胞中明显抑制HP-PRRSV的增殖,在病毒感染后72 h才出现的细胞病变,到96 h出现明显的细胞病变,推迟CPE 的发生时间,而且从24 h到96 h,pSilencer-N2实验组的TCID50显著下降(P<0.05),至96 h时达到对照组水平,表明靶向HP-PRRSV N蛋白基因的siRNA在细胞中抑制HP-PRRSV的复制可持续到感染后第4天,随后子代病毒产生逐渐上升,到感染后第5天达到对照组的水平,与黄娟[13]研究结果不尽相同,其可能的原因是选择的靶位点不同、接种病毒量不同以及转染质粒的量不同。

