A型肉毒素局部注射对兔耳瘢痕增生影响实验研究*
陶 谏,刘 宾,汪 阳,崔 鑫,韩 悦
西安市中心医院烧伤整形外科(西安710003)
主题词 瘢痕/病理生理学 肉毒杆菌毒素类,A型 增生 注射,肌肉内 耳部 兔
瘢痕的产生与伤口愈合过程中成纤维细胞异常增生以及伤口创缘两侧局部的张力有着密切的关系。在创面和伤口愈合过程中,异常的成纤维细胞增生以及周围肌肉反复收缩牵拉引起的微创伤可诱发持续的炎症反应和增强的生化代谢过程,导致细胞外胶原蛋白和黏多糖的过度沉积,从而引起瘢痕的过度增生以及色素沉着[1]。为了减少伤口愈合过程中的瘢痕增生,我们需要在抑制成纤维细胞异常增生和降低伤口局部张力方面寻找好的解决办法。
肉毒素A(Botulinum toxins type A,BTXA)作为一种研究和应用广泛的生物制剂,治疗范围已深入临床各个领域,包括耳鼻喉、神经科、疼痛科、整形美容外科等。其化学去神经作用,使肌纤维不能收缩,进一步导致肌肉组织变软萎缩[2],从而降低创缘两侧因局部肌肉收缩而产生的张力。近年来,关于肉毒素A对于瘢痕组织中成纤维细胞活性抑制作用的研究一直是瘢痕治疗领域中的热点。本研究的目的是观察BTXA对于兔耳瘢痕组织中成纤维细胞活性的影响,以及对于与瘢痕增生密切相关的细胞因子TGF-β表达的关系。
材料与方法
1 实验动物及分组 10只新西兰大耳白兔,体重3~3.5 kg,雌性,由西安交通大学医学院动物中心提供。分笼饲养1周后,以3%戊巴比妥1 ml/kg静脉麻醉,于兔耳腹侧面近、中、远端水平的内外侧各切除1个(共6个)直径1 cm的创面,间隔≥1 cm,建立兔耳增生性瘢痕模型。每只兔耳的外侧3个创面为BTXA(兰州衡力)治疗组(T组),内侧3个创面为瘢痕组(S组),每组60个创面。T组术后立即于创面周围皮下注射BTXA(兰州衡力),每个创面5 IU。S组在切口相应层次注射相同体积生理盐水,术后全身应用抗生素7 d预防感染,术后第2、4、6天予以伤口换药,大体观察创面愈合和瘢痕增生情况。术后28 d时,切取两组瘢痕组织,并将各组瘢痕组织随机三等分,收集标本,分别进行HE染色、MTT法检测成纤维细胞增殖活性和电泳法测定细胞因子TGF-β1表达。
2 实验方法
2.1 瘢痕形态大体观察: 观察治疗组(T组)与瘢痕组(S组)创面上皮化的时间及瘢痕的色泽、 质地与充血等情况。
2.2 HE染色及瘢痕增生指数(Hypertrophic index,HI)的测量:用于HE染色的标本采集需包括瘢痕组织周边5mm的健康皮肤,中性甲醛固定,石蜡包埋,苏木精一伊红染色。150倍显微镜下大体观察细胞增生和细胞外基质排列情况。瘢痕增生指数的测量:兔耳创面上皮化后,测量瘢痕增生指数以了解瘢痕增长的趋势。其方法为:将 Manson 染色的组织切片用计算机图像分析系统 (德国Zeiss公司)分别测定创面上皮化后的真皮厚度及邻近正常组织中的真皮厚度。瘢痕增生指数 =(兔耳腹面创面愈合后的真皮厚度 - 邻近正常组织中的真皮厚度)/ 邻近正常组织的真皮厚度。
2.3 MTT法检测治疗组(T组)与瘢痕组(S组)成纤维细胞增殖活性:酶消化法处理收集的T组及S组瘢痕组织进行细胞培养。取第3代对数期细胞,常规传代以细胞密度约 5×106/ 孔分别接种于 6 块 96孔培养板中。每孔加入细胞悬液200 μl,移入37℃、5%CO2孵箱培养 24 h。生长至铺满80% 孔底后,取T组6块96孔培养板,加入4IU/ml的 BTA 100 μl进行培养[3]。S组6块96孔培养板,加入正常的培养液100 μl。以上每个试验浓度设5个复孔,并设对阴性对照孔(PBS液100μl)。12 块板继续培养不同时间(12 h、24 h、36 h)后进行 MTT 实验。先吸去孔内培养液,每孔加入 MTT 溶液 20 μl(5mg/ml用PBS稀释pH=7.4),37℃、5%CO2恒温孵箱培养 4 h,终止培养,弃上清液。每孔加二甲基亚砜(杭州四季青生物有限公司) 150μl,在酶标仪内振荡 10 min,于 492 nm 波长处测定各孔吸光度(A值)。每组实验重复 5 次,取平均 A 值。以时间为横坐标,吸光值为纵坐标绘制细胞生长曲线。
2.4 电泳法测定治疗组(T组)与对照组(S组)TGF-β1表达差异:分别收集T组及S组细胞刚融合及融合后12 d成纤维细胞。细胞经冷PBS冲洗3次,加0.5%NP-40裂解液,冰浴20 min,将裂解液及刮下的细胞残渣移入离心管,12000 r/min离心5 min,取上清液,蛋白定量,分装,-70 ℃贮存备用。蛋白与加样缓冲液按4∶1混合,100 ℃煮沸5 min,高速离心5 mim,上清加样,以浓缩胶100V,分离胶160V,电泳90 min,转膜,丽春红染色1min, TBS.T清洗,5%脱脂奶封闭1h,加一抗室温1h(TGF-β1 Chemical公司1∶500,); TBS.T清洗;辣根过氧化物酶标记二抗(1∶3000)室温1h;TBS.T清洗,ECL底物发光。
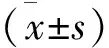
结 果
1 瘢痕形态大体观察 术后18 d, 大部分治疗组(T组)与瘢痕组(S组)兔耳创面均完全上皮化。术后第28天,疤痕组(S组)肉眼可见皮肤出现隆起的瘢痕,其逐渐增生变厚、变硬、充血肿胀,颜色为暗红色。治疗组(T组)创面大部未见明显的隆起性增生瘢痕, 但少部分创面仍可见轻度持续存在的扁平瘢痕增生。提示治疗组与瘢痕组兔耳瘢痕增生差异与BTXA局部注射有关。
2 光镜下瘢痕组织学形态及瘢痕增生指数 镜下见T组瘢痕的表皮增厚,细胞外基质较薄且排列较整齐(图1)。S组瘢痕皮肤较薄,层次紊乱,可见大量排列致密且紊乱的细胞外基质(红染) (图2)。S、T组的瘢痕增生指数HI分别为2.23±0.27和1.14±0.23,二者比较差异具有明显统计学意义(P<0.05)。提示BTXA局部注射可抑制兔耳瘢痕组织内成纤维细胞的过度无序增殖。
3 MTT法测定成纤维细胞增殖活性 不同时间经BTXA作用后治疗组(T组)与未经BTXA作用的瘢痕组(S组)成纤维细胞吸光度变化见表1。
注:同一时段相邻各浓度组间比较,P< 0.05
测定结果发现,不同时间经BTXA作用后的成纤维细胞活性明显较未治疗组降低,提示BTX A可以抑制兔耳瘢痕组织中成纤维细胞的增殖活性。
4 治疗组(T组)对照组(S组)TGF-β1表达活性差异 治疗组(T组)的TGF-β1条带明显小于对照组(S组),且差异有统计学意义(P<0.05)(图3)。提示:BTX A可以通过降低兔耳瘢痕组织中成纤维细胞TGF-β1的表达而起到抑制瘢痕增生的效果。


图3 T组及S组成纤维细胞TGF-β1电泳条带
手术或外伤后的瘢痕一直是外科医生面临的难题。临床上对于瘢痕的治疗方法包括激素注射、压力疗法、放射性治疗、超声疗法、以及局部应用硅酮类药物等[4]。皮质类固醇药物的局部注射疗法目前仍很常见,但远期观察表明,类固醇药物注射后局部皮肤可能表现为变薄、萎缩、毛细血管扩张以及发红,因此仍不能作为理想的抗瘢痕疗法。其余方法尽管能部分改善瘢痕状况,但并不能预防由于肌肉牵拉所致的瘢痕增宽这一病理过程,因此总的效果仍不十分满意。
瘢痕的产生与伤口愈合过程中成纤维细胞异常增生以及伤口创缘两侧局部的张力有着密切的关系。为了减少伤口愈合过程中的瘢痕增生,我们需要在抑制成纤维细胞异常增生和降低伤口局部张力方面寻找好的解决办法。BTXA可以作用于胆碱能运动神经末梢,通过拮抗钙离子的作用,干扰乙酰胆碱从运动神经末梢的释放,这种去神经化作用在注射治疗后可维持2~6个月[5],从而降低肌肉收缩而产生的牵拉张力。近年来,关于肉毒素A对于瘢痕组织中成纤维细胞活性抑制作用的研究一直是瘢痕治疗领域中的热点。
成纤维细胞作为一类重要的炎症细胞,是疏松结缔组织的主要细胞成分和创面愈合的主要修复细胞。它在创面修复过程中活化、增殖并合成胶原等细胞外基质,其异常增殖是增生性瘢痕发生、发展的重要因素之一[6]。国内外对增生性瘢痕模型的研究发现,A型肉毒毒素局部应用于创面能减少瘢痕组织中Ⅰ、Ⅲ型胶原的合成,降低胶原Ⅰ/Ⅲ比值,从而能抑制增生瘢痕的形成[7]。在本研究中,我们通过对兔耳瘢痕模型治疗组与瘢痕组的大体观察,发现治疗组瘢痕大小较非治疗组增生明显降低,两组瘢痕增生指数存在明显统计学差异。成纤维细胞增殖活性结果提示:BTXA治疗组瘢痕内的成纤维细胞活性明显较未治疗组降低。提示BTXA可以抑制成纤维细胞活性,降低成纤维细胞对于胶原蛋白等细胞外基质的合成水平,从而减轻瘢痕的增生。另外,BTXA可能影响成纤维细胞生长周期,诱导其启动正常的凋亡程序,加速成纤维细胞的自然凋亡,降低成纤维细胞活性,进而抑制瘢痕的异常增生。
TGF-β有3 种亚型,分别是 TGF-β1,TGF-β2,TGF-β3,其中TGF-β1所占的比例最高。TGF-β1是调节细胞增殖,分化细胞间质的一类多功能细胞因子,对很多纤维化疾病具有促进作用,是目前发现的与瘢痕增生关系最密切的细胞因子之一[8]。TGF-β1在增生性瘢痕中含量的高表达,提示其在瘢痕形成的多个阶段均有重要作用[9]。其不仅能够促进胶原 mRNA的转录,增加胶原的表达、调节成纤维细胞的增殖和凋亡、 还可以通过抑制胶原酶等金属蛋白酶的分泌及刺激蛋白酶抑制剂的表达,从而抑制胶原等细胞外基质的降解[10]。在本实验中,我们发现肉毒素治疗组(T组)兔耳瘢痕成纤维细胞的TGF-β1表达含量较瘢痕组(S组)明显减少,提示BTXA可以通过降低瘢痕组织内成纤维细胞TGF-β1的表达以降低胶原的表达、抑制成纤维细胞的增殖、促进成纤维细胞凋亡,从而达到抑制瘢痕增生的效果。
本动物实验证明,通过对兔耳瘢痕中成纤维细胞活性和增殖的抑制,肉毒素A可以降低成纤维细胞对于胶原等细胞外基质的合成以及下调细胞因子TGF-β1的表达,从而起到抑制瘢痕增生的效果。

