ABCA1基因与原发性开角型青光眼研究进展
胡春春 宋毛毛 雷苑 孙兴怀
青光眼是一类以进行性视神经损害、视网膜神经节细胞凋亡与视野缺损为特征的全球第2位致盲性眼病[1]。预测全球青光眼患病人数将由2013年的6 430万人增加到2020年的7 600万人[2]。根据病因,青光眼可以分成不同的类别,原发性开角型青光眼(primary open-angle glaucoma, POAG)是其中最常见的类型之一[3]。
POAG的发病机制极其复杂,眼压增高是POAG发病中最主要的危险因素,降低眼压是控制POAG持续进展的主要治疗方式[4]。另一个主要危险因素是基因的遗传变异[5]。随着家系连锁分析、全基因组关联分析等研究方法的发展,目前已报道多个染色体位点与POAG相关,如CAV1-CAV2,TMCO1,CDKN2B-AS1 及ARHGEF12[6-8]。近年来,3个团队通过全基因关联分析发现了三磷腺苷结合盒转运蛋白A1(ATP-binding cassette transporter A1 ,ABCA1)基因上游的遗传变异与POAG高度相关[9-11]。ABCA1是ATP结合盒转运子(ATP binding cassette transporter ABC)超家族的成员, 1994年被发现后,其功能被广泛研究。本文就ABCA1及其相关的信号通路蛋白在高眼压症及青光眼中可能发病机制的研究进展做简述,为POAG进一步的遗传研究提供理论参考。
1 ABCA1的概述
ABCA1是以ATP为能源的具有转运胆固醇功能的一类膜整合蛋白。人类ABCA1基因定位于9q31,长度约149 kb,包含50个外显子和49个内含子。完整的人类ABCA1基因序列包含1 453 bp启动子,有多个调节脂代谢的转录因子结合位点[12]。ABCA1基因编码的蛋白质是由2 261个氨基酸组成的相对分子质量为254 kD的转运体。在结构上ABCA1蛋白具有2个跨膜结构域(TMD)的对称结构和2个核苷酸结合区域(NBD1和NBD2),核苷酸结合位点是ATP结合位点,由2个肽链组成,为跨膜转运提供能量。每个跨膜部分有6个跨膜螺旋,在蛋白质中间部分有1个高疏水性的调节域(RD)[13]。
ABCA1蛋白的主要功能是将细胞内的胆固醇转运至细胞外,在高密度脂蛋白胆固醇的逆向转运中起重要作用[14]。也有研究[15]表明,ABCA1通过多条信号途径参与抗炎功能,如JAK2/STAT3通路及Toll样受体等信号通路。此外,近来研究[9-10, 16]表明,ABCA1作为肝脏X受体(LXRs)的靶基因,可通过LXRs信号通路参与调节视网膜神经节细胞的凋亡;与POAG患者高眼压的形成密切相关。ABCA1基本结构模式图[17]见图1。
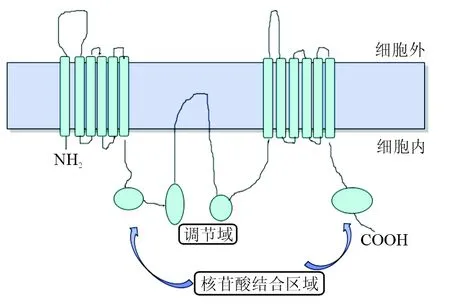
图1. ABCA1基本结构模式图[17]
2 ABCA1在眼内组织的分布
Gharahkhani等[10]用定量反转录聚合酶链反应(RT-PCR)证实ABCA1在人的眼部组织中广泛表达,如虹膜、睫状体、视网膜、视神经、小梁网及Schlemms管细胞中都有表达。同时利用免疫标记发现,ABCA1蛋白表达于正常人的小梁网、视神经和视网膜各层(如视网膜神经节细胞层、视网膜色素上皮层及光感受器细胞上皮层,在视网膜神经节细胞层表达最丰富)。Duncan等[18]用免疫荧光显微镜技术观察发现,小鼠的视网膜各层都有ABCA1的表达,在光感受器细胞层内段表达量最高。Tserentsoodol等[19]研究表明,猴的视网膜ABCA1表达在视网膜神经节细胞、视网膜色素上皮层以及视杆细胞内段。
3 ABCA1与青光眼关系
近年来许多临床研究表明,ABCA1周围的遗传变异与POAG相关。孙兴怀教授领衔的青光眼遗传学研究小组与四川省人民医院等单位合作,经过多个阶段,共有1 007例高压眼型青光眼患者和1 009例正常人参与研究,经过反复验证,最终筛选出ABCA1基因附近的遗传标记位点,并证实该基因变异与POAG,特别是高眼压的表型密切相关[9]。Gharahkhan等[10]用全基因关联研究纳入1 155例青光眼患者和1 992例正常对照,并用meta分析证实ABCA1基因下游的遗传变异位点与POAG密切相关。Hysi等[11]的研究同样证实了ABCA1与POAG及高眼压症的相关性。
另外,一些动物实验研究也揭示ABCA1参与POAG发病的可能机制。有研究[20]表明,ABCA1基因能影响神经元和神经胶质细胞炎症和变性的发生、发展,并且在DBA/2J青光眼小鼠模型中,ABCA1基因的转录水平与神经节细胞凋亡相关。ABCA1参与POAG发病的机制目前仍不清楚,有待进一步研究。
4 ABCA1及其相关信号蛋白与高眼压的关系
家系连锁分析、全基因组关联分析已经发现多个基因与高眼压症密切相关,如CAV1、ARHGEF12、TGF-β和ABCA1[6, 8-9, 21]。以下总结目前ABCA1及与其相关联的一些基因导致眼压增高可能的机制研究(图2)。
4.1 ABCA1与Rho/ROCK信号通路 Rho是Rho家族中的小分子鸟苷三磷酸酶,属于Ras超家族。通过其下游最主要的效应分子Rho激酶或ROCK来调节细胞肌动蛋白骨架的重组、细胞黏附运动、神经元的形成以及轴突的伸长等。有研究[22]表明,Rho/ROCK抑制剂可通过调节小梁网中肌动蛋白细胞骨架、细胞外基质及Schlemms管内皮细胞功能,从而降低眼压。同时,抑制Rho/ROCK途径可增加视乳头血流量、维持视网膜神经节细胞的生存率及促进轴突再生[23]。Rho信号通路作为青光眼基因治疗的潜在靶点得到广泛研究,而近年发现Rho家族G蛋白CDC42可调节ABCA1介导的胆固醇流出[24]。 Nofer等[25]研究表明,ABCA1与CDC42相互关联,CDC42可直接与ABCA1结合并相互作用。Kheirollah等[26]研究证实,在大鼠星形胶质细胞中,ABCA1/CDC42/Rho激酶信号通路在apoA-Ι介导的细胞内胆固醇转运和apoA-Ι介导的胆固醇流出中起重要作用。
4.2 ABCA1与ARHGEF12 Rho鸟苷交换因子12(ARHGEF12)在Rho/ROCK激酶信号通路中的重要作用是,能特异性催化与Rho结合的GDP和GTP进行交换,形成Rho-GTP,从而激活Rho并参与下游信号通路而发挥生物学功能[27]。Springelkamp等[8]用全基因关联研究证实,ARHGEF12基因遗传变异是POAG及高眼压的危险因素之一。ARHGEF12可将报道过的一些POAG及高眼压相关基因,如ABCA1、CAV1/CAV2和GAS7基因与遵循孟德尔遗传规律的POAG基因,如MYOC、OPTN和WDR36相互联系[8]。ARHGEF12能与ABCA1相互作用,通过激活RhoA阻止ABCA1蛋白凋亡,从而延长ABCA1蛋白的半衰期。ABCA1是细胞内外物质转运重要的膜整合蛋白,半衰期的延长能更好地发挥其生物学功能[28]。
4.3 ABCA1与TGF-β TGF-β是一类由多种组织细胞合成的多功能细胞因子,影响细胞的增殖、分化、黏附、周期、转移和凋亡。TGF-β可促进细胞外基质和成纤维细胞的增生,从而使小梁网的弹性及机械负荷发生变化,造成房水流出阻力增加和眼压增高[29]。有研究[30]表明,TGF-β能通过激活核受体LXR信号通路明显增加ABCA1基因的表达。也有研究[31]表明,TGF-β可通过增加ABCA1的表达促进巨噬细胞源性泡沫细胞胆固醇的流出。ABCA1的表达增加可能通过参与TGF介导的胆固醇代谢,引起细胞外基质蛋白数量及质量的比例失调,导致小梁网细胞外基质蛋白的堆积,使房水引流阻力增加,从而参与青光眼发病[32]。其参与TGF-β信号通路致使青光眼发生、发展的具体机制还有待进一步的研究。
5 展望
多个临床研究证实,ABCA1基因遗传变异是高眼压及POAG发病过程中重要的危险因素,但ABCA1参与POAG发病的机制尚不清。对ABCA1深入的基础机制研究,不仅能明确其作用机制,为寻找更有效的青光眼治疗手段提供一条新途径,也能将报道过与POAG高度相关的基因及相关信号通路在青光眼发病过程的作用机制连成一个更加完整的体系,为发现更多与POAG相关的位点与基因,实现青光眼的基因筛查、基因诊断及治疗提供可能。
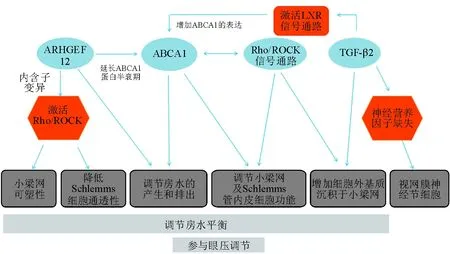
图2. ABCA1及其相关信号通路蛋白与眼压调节关系

