高脂饮食对小鼠胃蛋白质组表达水平的影响
李先菊,李志科,赵文娟,秦钧
高脂饮食对小鼠胃蛋白质组表达水平的影响
李先菊1,李志科2,赵文娟1,秦钧1
1 军事科学院军事医学研究院生命组学研究所 国家蛋白质科学中心·北京 北京蛋白质组研究中心 蛋白质组学国家重点实验室,北京 102206 2 中国人民解放军空军军医大学(第四军医大学),陕西 西安 710032

李先菊, 李志科, 赵文娟, 等. 高脂饮食对小鼠胃蛋白质组表达水平的影响. 生物工程学报, 2018, 34(11): 1840–1849.Li XJ, Li ZK, Zhao WJ, et al. Effect of high fat diet on proteome in mice stomachs. Chin J Biotech, 2018, 34(11): 1840–1849.
以高脂饮食小鼠为模型,多角度分析高脂饮食对小鼠胃蛋白组表达的影响。实验小鼠 (C57BL/6)随机分配两组,实验组食用高脂饲料,对照组食用正常饲料,喂养110 d后,把胃组织分为前胃、胃体和胃窦3个区分别进行蛋白质谱鉴定,随后比较两组实验的蛋白表达谱,分别筛选两组之间的差异蛋白以及胃分区的差异蛋白 (差异倍数≥2),并对其进行GO富集及蛋白相互作用网络分析。对照组和实验组共鉴定到9 307种蛋白,筛选特异性肽段≥1且重复实验中至少鉴定到2次的蛋白,最后剩余4 066种蛋白,其中对照组3 654种,实验组3 832种。进一步从生物功能角度整体分析了胃组织的蛋白表达谱,结果发现实验组小鼠胃组织中高表达蛋白主要参与蛋白稳定和运输等生物学过程。而在对胃分区差异蛋白的功能分析表明,前胃主要参与角质化和肌动蛋白组装相关生物学过程,且受饮食影响程度较小;胃体和胃窦主要执行消化功能,高脂饮食后对胃的基本消化功能并无显著影响,但与对照组相比,参与蛋白转运和脂肪代谢相关生物学过程的蛋白显著高表达。
高脂饮食,胃,蛋白质组学
胃由前肠发育而来,具有特征性弯曲,作为近端消化道的肌肉和存在于所有的颚脊椎动物中,主要功能是食物储存或在酸性环境中对食物进行消化[1-4]。它能够直接与外界食物接触,因此相对于肝胆等其他内部器官,其更容易受到外界的干扰,进而引起胃组织中蛋白表达或激素水平发生改变,导致胃功能失调或者代谢紊乱,引起慢性炎症及胃疾病的发生[5-9]。
由于生活方式和饮食习惯发生改变,人们摄入更多的高脂肪食物[5-9]。目前,针对食用高脂肪食物的相关研究大都集中在高脂饮食与肥胖[10-12]、脂肪肝[13-14]以及糖尿病[15-16]等疾病的相关研究中,高脂饮食对胃的影响只有少许报道。例如高脂饮食 (High fat diet,HFD) 会使胃肠道中的有益菌群乳酸杆菌和双歧杆菌等菌群数量降低,菌群平衡遭到破坏,免疫力下降,更容易受到外部致病菌的入侵[7,9,17-18]。正常情况下,生长素释放肽在饥饿时会高表达,但是高脂饲料喂养大鼠的生长素释放肽的表达在饥饿与非饥饿状态下的变化却无显著差异[19];研究者对ob/ob和高脂饲料喂养的小鼠胃组织的转录组分析发现,肥胖和胃组织的代谢具有一定相关性,但具体机理尚不明确[8]。
以上研究均是针对高脂饮食对胃肠菌群多样性、特定蛋白或转录组表达进行的研究,那么高脂饮食对胃组织的蛋白质表达水平有怎样的影响呢?在本研究中,我们以C57BL/6小鼠为研究对象进行连续110 d的高脂饲料喂养,把整体胃组织在前胃、胃体和胃窦3个区基础上进行蛋白质质谱鉴定,并从整体上和胃分区两个方面对差异蛋白进行GO生物功能富集及相互作用网络分析,首次从蛋白质组层面研究了高脂饮食对胃组织蛋白质组表达水平的影响。
1 材料与方法
1.1 材料
1.1.1 实验动物
纯系雄性6周至8周龄C57BL/6小鼠10只,体重 (20±2) g,SPF级,购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2012-0001。
1.1.2 试剂
高脂饲料购自Research Diets公司,PBS购自Gibco公司,尿素和质谱级去离子水购自J. T. Baker公司,蛋白酶抑制剂购自Thermo公司,FASP管购自Sartorius公司。
1.1.3 主要仪器
离心机 (Thermo),真空抽干机 (Eppendorf),高效液相色谱EASY-nLC1000 (Thermo),Q Exactive HF (Thermo)。
1.2 方法
1.2.1 动物模型构建
纯系雄性10只6周至8周龄C57BL/6小鼠于北京蛋白质组研究中心动物房饲养30 d后,随机分成2组,即对照组和高脂饲料组,对照组喂食普通饲料,高脂饲料组喂食高脂饲料,持续时间为110 d,饲养期间所用饲料、垫料、饮用水均经过高压灭菌处理,鼠房的温度控制在(23±1) ℃,相对湿度40%−60%,灯光循环周期为12 h。
1.2.2 胃组织获取
饲养110 d后,取出实验组和对照组的小鼠,每一组选取体重差异较小的3只小鼠,采用断颈方式处死,获取小鼠的胃组织,并在PBS缓冲液中,剔除胃组织相连的脂肪、血管以及食管和十二指肠,按照胃的生理分区,把胃组织分为3个主要区域:前胃 (Forestomach,F)、胃体 (Corpus,C) 和胃窦 (Antrum,A)。使用PBS彻底清洗胃组织,去除胃组织中的残留食物,避免食物中的蛋白等物质对实验结果产生影响。
1.2.3 蛋白样品制备与质谱鉴定
把分为前胃和胃体、胃窦的胃组织,每一区域取约10 mg组织,加入含有1×蛋白酶抑制剂的8 mol/L 尿素裂解液中充分裂解,各组织分别取50 μg蛋白进行还原烷基化,加入DTT至终浓度为1 mmol/L,56 ℃金属浴30 min,冷却至室温后,加入吲哚乙酸至终浓度为2 mmol/L,避光反应 30 min,再次加入DTT至终浓度为1 mmol/L,避光反应15 min。把蛋白反应体系转移至FASP管中,离心使蛋白挂在FASP膜上,加入150 mL 50 mmol/L的碳酸氢铵和1 μg胰酶,37 ℃消化8–12 h,得到的肽段真空抽干后–20 ℃保存。
1.2.4 蛋白的定性与定量
将抽干的肽段分别溶解于30 μL水溶液 (5%甲醇,0.2%甲酸) 中,16 000×离心10 min,取1 μL上清进行质谱检测。色谱分析柱:自制,填料为1.9 μm C18,柱内径为150 μm,长度30 cm;流动相A为质谱水 (含有0.2%甲酸),流动相B乙腈 (含有0.2%甲酸)。150 min检测梯度,B相浓度由5%逐渐升至40% 。使用电喷雾离子源,电压为2.0 kV,采用正离子采集模式,一级和二级采集质量范围分别是300−1 400/,流速为600 nL/min。
搜索软件:Firmiana;搜索引擎:MASCOT;数据库:NCBI_Mus musculus Ref-seq (34 361种蛋白质,2013年7月更新)。一级误差:20 ppm (parts per million),二级误差:0.05 Da。蛋白的假阳性率为1%的严格卡值。
使用基于强度的绝对定量方法 (Intensity based absolute quantification,iBAQ)[20],对鉴定到的蛋白质进行定量。针对同一实验鉴定到的蛋白,使用FOT (Fraction of total) 方法进行归一化,即使用蛋白的相对定量值比上同一实验中所有蛋白定量值之和,乘105,定义为iFOT[21]。
1.2.5 生物信息学分析
重复实验之间的相关性使用Spearman方法计算;使用R (版本3.4.1) 进行基因共表达网络分析 (Weighted gene co-expression network analysis , WGCNA) 计算实验之间的欧几里得距离;-TEST方法用来寻找差异蛋白 (<0.01,fold change≥2),差异蛋白使用DAVID Bioinformatics Resources 6.8进行功能富集分析,String和Cytoscape进行蛋白相互作用网络分析。
2 结果与分析
2.1 实验组和对照组小鼠胃组织蛋白质组数据筛选
随机分配的两组小鼠,对照组 (CTRL) 喂食普通饲料,实验组 (HFD) 喂食高脂饲料,持续时间为110 d,解剖发现胃组织的表观形态没有明显差异,后分3个区域对胃部进行蛋白质组学分析 (图1A)。胃组织肽段样品首先经过高效液相色谱分离,然后进行质谱进行定性和定量。一共鉴定到9 307种蛋白,随后对蛋白进行进一步的质控:1) 特异性肽段的数量≥1;2) 3次重复实验中至少鉴定到2次。最后鉴定到4 066种蛋白,HFD组有3 832种 (前胃:2 685,胃体:3 267,胃窦:3 154),CTRL组3 654种 (前胃:2 542,胃体:2 974,胃窦:3 038),后续分析均是基于此数据 (图1B)。蛋白数目统计分析发现,在蛋白种类上,胃体 (C) 和胃窦 (A) 相近,且均高于前胃 (F) (图1B)。重复实验之间的相关性均大于0.8,且与前胃相比,胃体和胃窦的相关性相当高,说明其蛋白质组的表达更相近 (图1C)。
2.2 整体胃组织差异蛋白分析
以整体胃组织为研究对象,通过WGCNA分析发现,HFD组和CTRL组实验已经完全分开 (图2A),说明虽然胃的生理形态未发生明显变化,但是高脂饮食对胃组织蛋白质的表达已经造成明 显的影响。对照组和实验组的数据统计发现,只在HFD组表达的蛋白有412种,只在CTRL组表达的蛋白有234种 (图2B)。随后我们采用-TEST方法进行差异蛋白的计算,共得到差异蛋白175种 (<0.01,fold change≥2),其中HFD组共有上调蛋白139种 (与CTRL组的iFOT比值≥2),下调蛋白36种 (与CTRL组的iFOT比值≤0.5) (图3A)。
通过对HFD组上调蛋白进行GO富集分析发现,这些蛋白主要倾向于参与代谢过程(Metabolic process)、运输 (Transport)、蛋白质稳定 (Protein stabilization)、自噬体装配的正调控(Positive regulation of autophagosome assembly) 和蛋白质运输 (Protein transport) (<0.01) (图3B);而下调蛋白没有明显的功能富集。上述分析说明高脂饮食之后,胃组织中部分功能簇蛋白发生了高表达。有趣的是,我们发现HFD组发生差异变化的蛋白之间具有密切的相互作用且部分表达上调蛋白参与多种疾病过程。通过对相互作用网络的连接度进行分析发现,连接度相对较高的蛋白主要包括与ATP和ADP转化相关的Gmps、参与蛋白转运的Vamp7、与脂质运输相关的Apoa1,以及具有GTP酶活性的Rab11a等 (图3C)。表达上调的蛋白有很多与疾病相关,如Arid1a参与Coffin-Siris 综合征(Coffin-Siris syndrome)、Ptpn11参与包括代谢类疾病(Disease of metabolism) 以及扩张型心肌病(Dilated cardiomyopathy) 等在内的多种疾病,Gns与Ⅲ型粘多糖病 (Mucopolysaccharidosis Ⅲ) 密切相关 (图3C)。

图1 小鼠胃组织的全蛋白表达谱鉴定流程 (A) 和数据筛选后蛋白的保留数目 (B) 及重复实验之间的相关性(C)

图2 两组胃组织全蛋白的WGCNA分析(A) 和蛋白交叉分析(B)
已知胃组织的主要功能是进行蛋白质的消化和脂质的初步消化[22-27],我们的分析结果揭示了长时间食用高脂饲料,小鼠胃组织与蛋白运输和稳定相关的蛋白以及参与能量转化及代谢的相关蛋白高表达,说明胃组织中部分代谢功能增强,这或许是其他代谢性疾病发生的诱因之一。
2.3 胃组织分区差异蛋白分析
接下来对HFD和CTRL组的胃部分区分别进行差异蛋白分析,根据前面相关性分析结果,分析时把胃体和胃窦作为胃腺体与前胃进行对比分析。HFD组中,差异蛋白有856种 (<0.01,fold change≥2),其中前胃中相对高表达蛋白有292种 (与胃体和胃窦的iFOT比值≥2,下同),胃体和胃窦中相对高表达蛋白有564种 (与前胃的iFOT比值≥2,下同) (图4A)。前胃中高表达蛋白主要参与角质化 (Keratinization)、肽酶活性负调控 (Negative regulation of peptidase activity)、胶原纤维组装 (Collagen fibril organization) 等生物过程 (图4B),胃体和胃窦中高表达的蛋白与胃的消化代谢功能相关,例如基本的氧化还原过程 (Oxidation- reduction process)、运输 (Transport) 和三羧酸循环 (Tricarboxylic acid cycle) 外,另外还包括了脂质代谢 (Lipid metabolic process) 和脂肪酸代谢(Fatty acid metabolic process) 等初步脂质代谢过程(图4C)。
CTRL组中,前胃和胃体胃窦差异分析得到差异表达蛋白591种(<0.01),其中前胃中相对高表达蛋白有299种,胃体和胃窦中相对高表达蛋白有292种(图4D)。前胃中高表达蛋白参与的生物过程多了细胞外基质组织(Extracellular matrix organization),其他与HFD组一样(图4E);胃体和胃窦中高表达蛋白同样参与胃的生理功能,例如基本的氧化还原过程(Oxidation- reduction process),与HFD组不同的生物过程有翻译(Translation)、线粒体组装(Mitochondrion organization)、嵴形成(Cristae formation) 和碳水化合物代谢(Carbohydrate metabolic process) 等生物过程(图4F)。分析结果进一步证实胃体和胃窦参与胃的消化功能,高脂饮食之后,胃的消化功能相关的氧化还原过程仍旧不变,但是部分生物过程如线粒体组装以及碳水化合物代谢等受到饮食影响,且相比前胃,高脂饮食会对胃体和胃窦区域的蛋白表达变化产生更显著的影响。
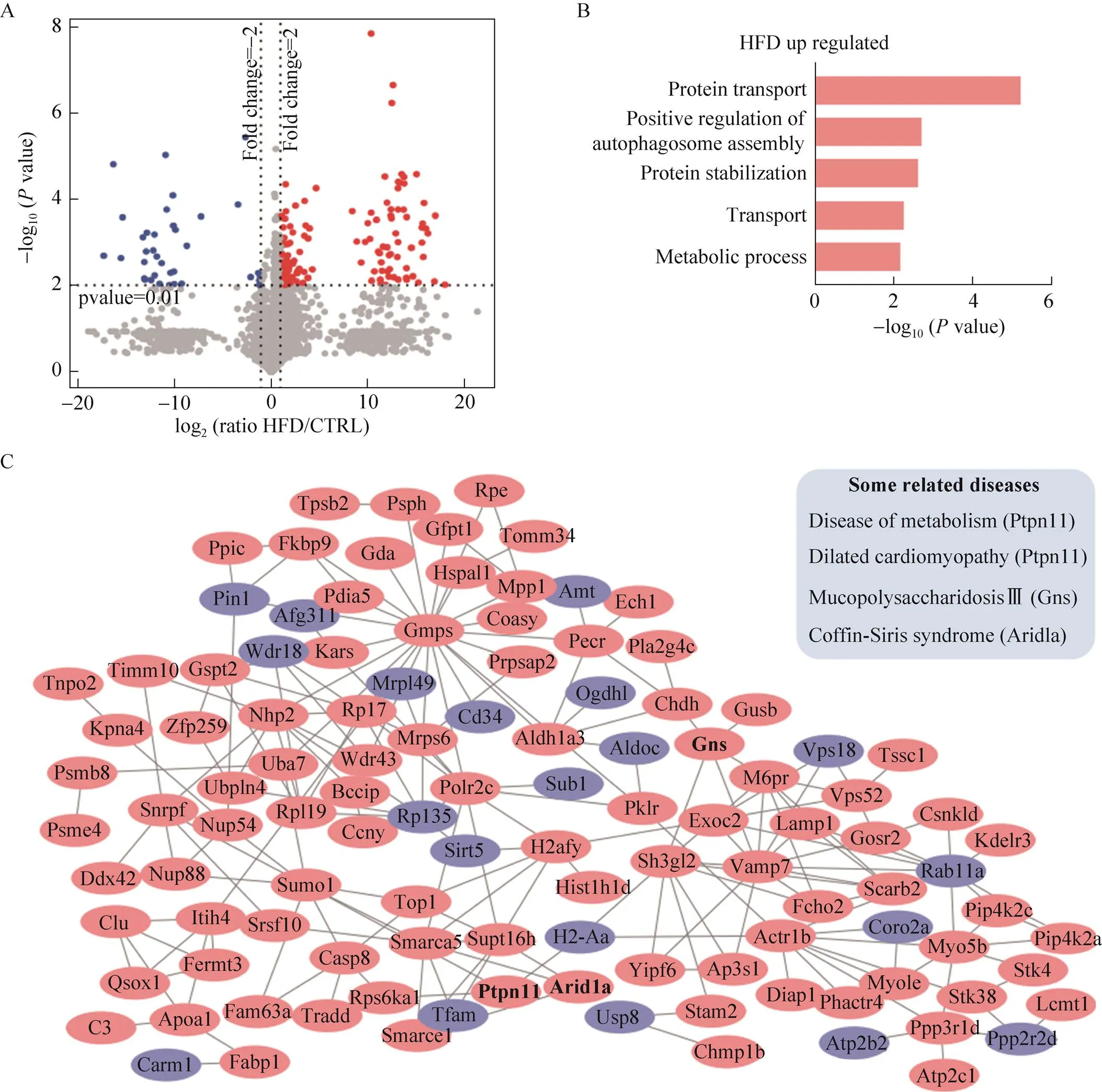
图3 差异蛋白分析

图4 同组胃组织区域差异蛋白分析
2.4 不同胃组织相同区域差异蛋白质分析
由于前胃和胃体胃窦受到高脂饮食影响的程度不同,接下来在HFD和CTRL组分别进行对比分析。在HFD组前胃中,上调蛋白有42种,下调蛋白20种,胃体和胃窦中上调蛋白最多,有96种,下调蛋白14种(图5A)。其中,前胃中上调蛋白主要涉及肌动蛋白组装和蛋白运输等与蛋白质相关的生物过程(图5B);胃体和胃窦中上调蛋白主要参与视黄酸受体信号通路的调控(Positive regulation of retinoic acid receptor signaling pathway)、代谢过程(Metabolic process,主要是脂质代谢)、mRNA加工过程(mRNA processing) 和运输(Transport,主要是定位和蛋白运输) 等(图5C)。下调蛋白都没有显著性富集的功能以及通路。高脂饮食会诱使胃组织部分涉及维管束蛋白的组装、蛋白质的运输和脂质代谢等功能的蛋白发生高表达,表明且进一步显示胃腺体受到高脂饮食的影响更显著。
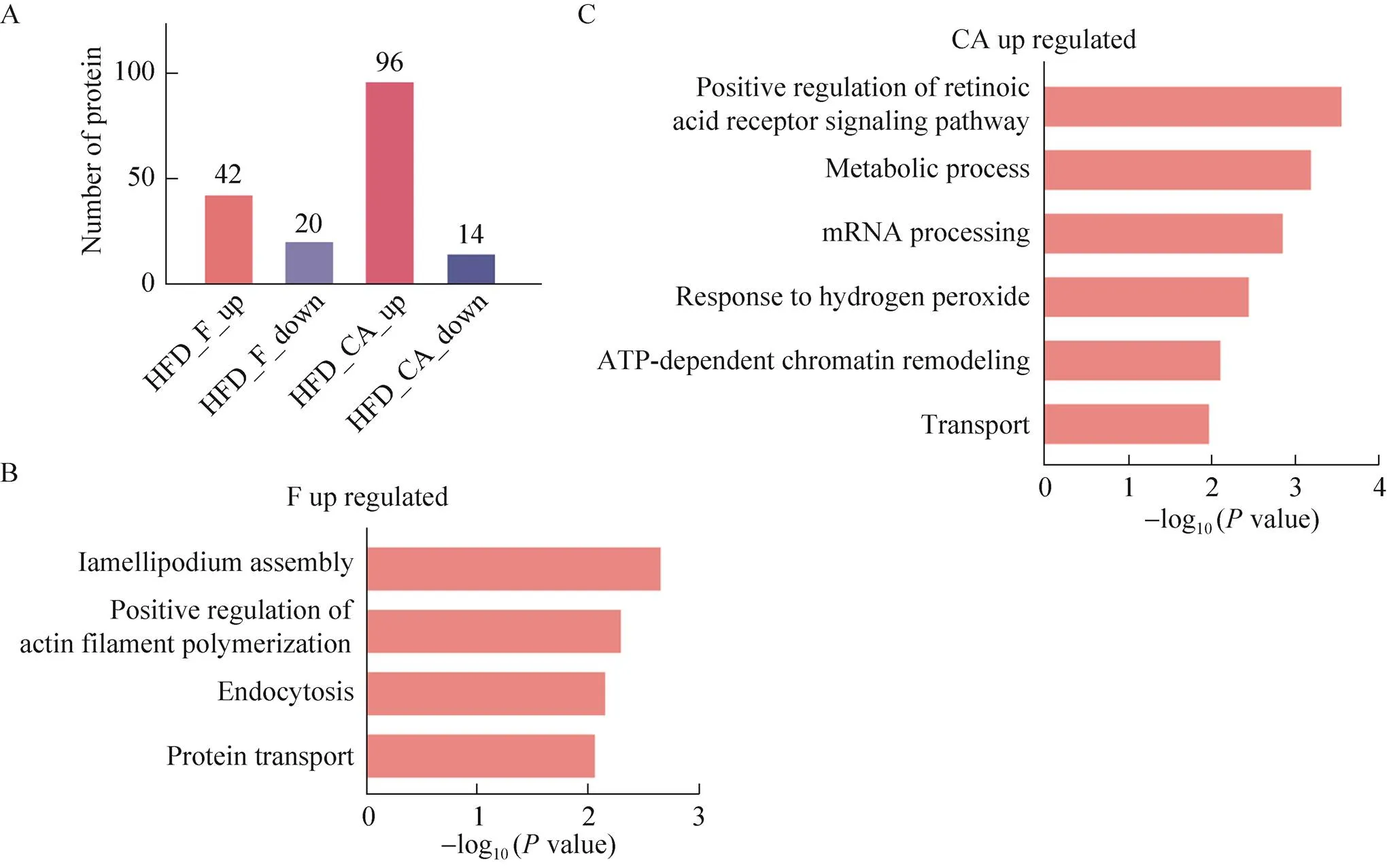
图5 两组胃组织同一区域差异蛋白分析
3 讨论
蛋白质是生命活动的承担者,蛋白质组学从整体水平上对细胞、组织以及器官蛋白组成的变化规律进行研究。随着基因组和转录组的相继发展和成熟,测序技术也得到了飞速发展,为进行蛋白质组学研究提供了基础。基于液质连用和串联质谱检测技术的快速发展,使高通量、深度覆盖检测蛋白成为可能。现在检测蛋白的方法很多都使用液相色谱进行组分分离,之后进行质谱检测,既加长了实验周期,又增加了实验成本。在本实验中,我们使用自制的分离柱,120 min的鉴定时间,提高了蛋白鉴定深度,达到了每2 h可鉴定约6 000种蛋白,大大减少了样品鉴定时间。
已有研究发现长时间食用高碳和高脂肪食物不但会引起肥胖[28-29]、二型糖尿病[30-32]和肝脏疾病[33-34]等多种代谢性疾病,还会造成胃肠道细菌多样性的下降,进而引起其他代谢性疾病。食物需要先经过胃组织进行消化,最终在肝脏中脂肪和碳水化合物被代谢和合成。与肝脏器官的研究相比[14,16,35-39],食物对胃组织的影响,尤其是胃组织蛋白质组表达水平的影响研究较少。我们使用无标定量基于质谱检测方法,首次在蛋白质水平对小鼠的胃组织蛋白质组学进行了全景式研究。
近年来,高碳或者高脂饮食对肝脏蛋白质组表达水平变化的研究是热点,而高脂饮食小鼠的胃蛋白质组学方面研究也得到了部分与之相似的结果。2016年Nagarajan等对大鼠肝脏中的泛素化蛋白质组进行研究发现,在高脂肪高蔗糖饮食和胰岛素刺激条件下,涉及葡糖异生/糖酵解、氧化磷酸化和脂肪酸代谢相关蛋白质的泛素化明显增多[36]。我们的胃蛋白质组学研究结果中同样发现胃体和胃窦区域与脂肪代谢相关蛋白表达水平增高。Xia等对高脂饮食和食用无壳全麦大鼠的肝脏蛋白质组的抗氧化活性分析发现HSP60、PEBP1和ECH在内的参与脂质代谢的7种蛋白在高脂饮食大鼠中高表达[35]。其中Ech1在高脂饮食小鼠的胃中也高表达(=0.000 2,fold change=2.8)。无独有偶,Chaves等在高脂/高碳水化合物后外周血单个核细胞的蛋白质组学研究中发现,高脂、高碳饮食后载脂蛋白A-II、血浆铜蓝蛋白和血红素结合蛋白表达水平增高[37]。同样在高脂饮食的小鼠全胃的蛋白质组中发现多种载脂蛋白表达水平升高,如Apoa1 (=0.005,fold change=2),Apoa4 (=0.02,fold change=2.4) 和Apoe (=0.03,fold change=3.4),但不包含Apoa2。以上结果一方面反映了高碳和高脂肪食物均能够引起组织中脂质代谢相关蛋白的高表达;另一方面不同组织器官中高表达的脂质蛋白类型不同,说明不同器官代谢参与的主要代谢不同。因此,合理膳食是维持身体组织器官的正常生理功能、避免组织器官负担过重、进而引发代谢性疾病的基础。
[1] Kim TH, Shivdasani RA. Stomach development, stem cells and disease. Development, 2016, 143(4): 554–565.
[2] Oidovsambuu O, Nyamsuren G, Liu S, et al. Adhesion protein VSIG1 is required for the proper differentiation of glandular gastric epithelia. PLoS ONE, 2011, 6(10): e25908.
[3] Zorn AM, Wells JM. Vertebrate endoderm development and organ formation. Annu Rev Cell Dev Biol, 2009, 25(1): 221–251.
[4] Aubin J, Déry U, Lemieux M, et al. Stomach regional specification requires Hoxa5-driven mesenchymal-epithelial signaling. Development, 2002, 129(17): 4075–4087.
[5] Sano T. Gastric cancer: Asia and the world. Gastric Cancer, 2017, 20(S1): 1–2.
[6] Ha XQ, Peng JH, Zhao HB, et al. Enhancement of gastric ulcer healing and angiogenesis by hepatocyte growth factor gene mediated by attenuated salmonella in rats. J Korean Med Sci, 2017, 32(2): 186–194.
[7] Murphy EA, Velazquez KT, Herbert KM. Influence of high-fat diet on gut microbiota: a driving force for chronic disease risk. Curr Opin Clin Nutr Metab Care, 2015, 18(5): 515–520.
[8] Chen J, Chen LH, Sanseau P, et al. Significant obesity-associated gene expression changes occur in the stomach but not intestines in obese mice. Physiol Rep, 2016, 4(10): e12793.
[9] Zhang M, Yang XJ. Effects of a high fat diet on intestinal microbiota and gastrointestinal diseases. World J Gastroenterol, 2016, 22(40): 8905–8909.
[10] Cho YR, Lee JA, Kim YY, et al. Anti-obesity effects ofin high-fat diet-induced obese mice. Biomed Pharmacother, 2018, 99: 253–260.
[11] Casacchia T, Scavello F, Rocca C, et al.prevents metabolic disorders in rats with high-fat diet-induced obesity. Eur J Nutr, 2018, doi:10.1007/s00394-018-1609-1.
[12] François M, Barde S, Legrand R, et al. High-fat diet increases ghrelin-expressing cells in stomach, contributing to obesity. Nutrition, 2016, 32(6): 709–715.
[13] Yao FF, Zheng PY, Huang H, et al. Effects ofN1115 combined with fructooligosaccharides on non-alcoholic fatty liver disease induced by high-fat diet in mice. Chin J Hepatol, 2017, 25(12): 927–933 (in Chinese). 姚芳芳, 郑鹏远, 黄煌, 等. 副干酪乳杆菌N1115联合低聚果糖对高脂饮食诱导小鼠非酒精性脂肪性肝病的影响. 中华肝脏病杂志, 2017, 25(12): 927–933.
[14] Carmiel-Haggai M, Cederbaum AI, Nieto N. A high-fat diet leads to the progression of non-alcoholic fatty liver disease in obese rats. FASEB J, 2005, 19(1): 136–138.
[15] Miranda CL, Johnson LA, De Montgolfier O, et al. Non-estrogenic xanthohumol derivatives mitigate insulin resistance and cognitive impairment in high-fat diet-induced obese mice. Sci Rep, 2018, 8(1): 613.
[16] Zuloaga KL, Johnson LA, Roese NE, et al. High fat diet-induced diabetes in mice exacerbates cognitive deficit due to chronic hypoperfusion. J Cereb Blood Flow Metab, 2016, 36(7): 1257–1270.
[17] Proctor C, Thiennimitr P, Chattipakorn N, et al. Diet, gut microbiota and cognition. Metab Brain Dis, 2017, 32(1): 1–17.
[18] Cani PD, Neyrinck AM, Fava F, et al. Selective increases of bifidobacteria in gut microflora improve high-fat-diet-induced diabetes in mice through a mechanism associated with endotoxaemia. Diabetologia, 2007, 50(11): 2374–2383.
[19] Shao L, Li RY, Zhang YB, et al. Effect of different fasting stages on ghrelin expression in stomach of rats fed with routine or high-fat diet. Chin J Endocrinol Metabol, 2005, 21(3): 265–268 (in Chinese). 邵莉, 李荣英, 张一波, 等. 不同饥饿时段对常规及高脂饮食大鼠胃壁组织胃促生长素(ghrelin)表达的影响. 中华内分泌代谢杂志, 2005, 21(3): 265–268.
[20] Schwanhäusser B, Busse D, Li N, et al. Global quantification of mammalian gene expression control. Nature, 2011, 473(7347): 337–342.
[21] Jung SY, Choi JM, Rousseaux MWC, et al. An anatomically resolved mouse brain proteome reveals parkinson disease-relevant pathways. Mol Cell Proteomics, 2017, 16(4): 581–593.
[22] Dasilva G, Boller M, Medina I, et al. Relative levels of dietary EPA and DHA impact gastric oxidation and essential fatty acid uptake. J Nutr Biochem, 2017, 55: 68–75.
[23] O’Connor A, O’Morain C. Digestive function of the stomach. Dig Dis, 2014, 32(3): 186–191.
[24] Ramsay PT, Carr A. Gastric acid and digestive physiology. Surg Clin North Am, 2011, 91(5): 977–982.
[25] Iqbal J, Hussain MM. Intestinal lipid absorption. Am J Physiol Endocrinol Metab, 2009, 296(6): 1183–1194.
[26] Fink CS, Hamosh P, Hamosh M. Fat digestion in the stomach: stability of lingual lipase in the gastric environment. Pediatr Res, 1984, 18(3): 248–254.
[27] Ianiro G, Pecere S, Giorgio V, et al. Digestive enzyme supplementation in gastrointestinal diseases. Curr Drug Metab, 2016, 17(2): 187–193.
[28] Stemmer K, Perez-Tilve D, Ananthakrishnan G, et al. High-fat-diet-induced obesity causes an inflammatory and tumor-promoting microenvironment in the rat kidney. Dis Model Mech, 2012, 5(5): 627–635.
[29] Li Y, Liu X, Fan Y, et al. Radix Stellariae extract prevents high-fat-diet-induced obesity in C57BL/6 mice by accelerating energy metabolism. Peer J, 2017, 5: e3305.
[30] Thanopoulou AC, Karamanos BG, Angelico FV, et al. Dietary fat intake as risk factor for the development of diabetes: multinational, multicenter study of the Mediterranean Group for the Study of Diabetes (MGSD). Diabetes Care, 2003, 26(2): 302–307.
[31] Marshall JA, Bessesen DH. Dietary fat and the development of type 2 diabetes. Diabetes Care, 2002, 25(3): 620–622.
[32] Cheema SK, Clandinin MT. Dietary fat-induced suppression of lipogenic enzymes in B/B rats during the development of diabetes. Lipids, 2000, 35(4): 421–425.
[33] Chiu CC, Ching YH, Li YP, et al. Nonalcoholic fatty liver disease is exacerbated in high-fat diet-fed gnotobiotic mice by colonization with the gut microbiota from patients with nonalcoholic steatohepatitis. Nutrients, 2017, 9(11): 1220–1236.
[34] Ma ZH, Chu L, Liu HY, et al. Beneficial effects of paeoniflorin on non-alcoholic fatty liver disease induced by high-fat diet in rats. Sci Rep, 2017, 7: 44819.
[35] Xia XJ, Li GN, Xing YX, et al. Antioxidant activity of whole grain highland hull-less barley and its effect on liver protein expression profiles in rats fed with high-fat diets. Eur J Nutr, 2017, doi:10.1007/s00394-017-1494-z.
[36] Nagarajan SR, Brandon AE, McKenna JA, et al. Insulin and diet-induced changes in the ubiquitin-modified proteome of rat liver. PLoS ONE, 2017, 12(3): e0174431.
[37] Chaves DFS, Carvalho PC, Brasili E, et al. Proteomic analysis of peripheral blood mononuclear cells after a high-fat, high-carbohydrate meal with orange juice. J Proteome Res, 2017, 16(11): 4086–4092.
[38] Jung CH, Choi KM. Impact of high-carbohydrate diet on metabolic parameters in patients with type 2 diabetes. Nutrients, 2017, 9(4):322–342.
[39] Rabot S, Membrez M, Blancher F, et al. High fat diet drives obesity regardless the composition of gut microbiota in mice. Sci Rep, 2016, 6: 32484.
Effect of high fat diet on proteome in mice stomachs
Xianju Li1, Zhike Li2, Wenjuan Zhao1, and Jun Qin1
1 State Key Laboratory of Proteomics, Beijing Proteome Research Center, National Center for Protein Sciences (The PHOENIX Center, Beijing), Beijing Institute of Life Omics, Beijing 102206, China 2 The Fourth Military Medical University, Xi’an 710032, Shaanxi, China
To explore the effect of high fat diet on proteome in mice stomachs, we constructed a model in which the mice were fed with high fat diet as the high fat diet (HFD) group or normal diet as the control (CTRL) group for 110 days. The stomachs were collected and divided into three regions (forestomach (F), corpus (C) and antrum (A)) for protein extraction and mass spectrometry analysis. Of all 9 307 identified proteins in two groups, 4 066 proteins (HFD: 3 832, CTRL: 3 654) were strictly identified by at least one unique peptide and identified twice in three replicates. Using gene ontology (GO) and interaction network analysis we analyzed differentially expressed proteins (fold change≥2) in two groups or between regions. In the whole stomach tissues, proteins up-regulated in HFD group mainly were associated with protein stabilization and protein transport. Differentially expressed proteins between regions showed that forestomach was related to the biological process of keratinization and actin assembly, while corpus and antrum mainly performed digestive function. Compared with forestomach, the corpus and antrum were more affected by the diet. Though there was no significant effect on the basic digestive function of the stomach, proteins that were involved in protein transport and lipid metabolism-related biological processes were significantly highly expressed in HFD group.
high fat diet, stomach, proteome
March 13, 2018;
April 16, 2018
National Basic Research Program of China (973 Program) (No. 2014CBA02000), International Science & Technology Cooperation Program of China (No.2014DFA33160).
Jun Qin. Tel: +86-10-61777103; E-mail: jqin@bcm.edu
10.13345/j.cjb.180085
国家重点基础研究发展计划(973计划) (No.2014CBA02000 ),国家国际科技合作专项(No.2014DFA33160) 资助。
2018-05-19
http://kns.cnki.net/kcms/detail/11.1998.Q.20180516.1027.004.html
(本文责编 陈宏宇)

