猪肺炎支原体HN0613株高密度发酵工艺研究及效力评价
刘 鹏,李鹏昊,张 翼,朱巧燕,李向东,黄玉欣,田克恭
(国家兽用药品工程技术研究中心,河南 洛阳 471003)
猪支原体肺炎是一种猪慢性呼吸道疾病,病原是猪肺炎支原体 (Mycoplasma hyopneumoniae,Mhp)[1]。猪支原体肺炎的临床症状主要表现为发热、咳嗽、气喘、呼吸困难和食欲减退等,患病猪往往生长缓慢,且常诱发其他病原感染,如猪繁殖与呼吸综合征病毒 (PRRSV)、猪2型圆环病毒(PCV2)等,增加了猪病诊断和防控的难度[2-3]。该种疾病具有流行范围广、发病率高、净化难度大的特点,对国内外养猪业造成了巨大的经济损失。目前,疫苗免疫是该病的主要防控手段。
Mhp具有完整的糖酵解途径,能代谢葡萄糖产酸,因此,可利用酚红作为指示剂,通过颜色变化来反映其生长情况。其免疫原性的高低,目前多通过变色单位CCU对其滴度进行定量来反映[4]。Mhp生长条件苛刻,其常规培养多采用改良KM2或其衍生培养基,培养滴度可达 1×108CCU/mL[5]。有研究者通过优化Mhp的培养方法,使其CCU滴度提高至 1×109CCU/mL[6]。此外,一些中间代谢物如丙酮酸的添加对Mhp的生长也具有一定的促进作用[7]。Mhp属于兼性厌氧型微生物,无完整细胞壁,对活性氧(ROS)及剪切力极为敏感;其底物代谢相关膜转运系统及前体合成相关酶促反应途径不完善,不能通过氧化磷酸化为其生长提供能量来源,因此,规模化培养难度较大[8]。朱秀同等[9]通过优化培养时间、pH值、搅拌转速及通气量等条件,最终实现在500 L发酵规模条件下培养滴度达到1×109CCU/mL,达到国内领先水平。国外对Mhp更多侧重于其感染机制及相关基础理论的研究,根据有关研究报道,Mhp常规培养CCU水平可达到 1×109CCU/mL[10]。
该研究首先确定了Mhp HN0613株的最佳培养代次及复苏条件,通过正交试验筛选得到最优基本培养基及培养工艺条件;然后进行15 L规模的发酵工艺放大与优化,对比不同接种百分比、培养基pH值、搅拌和通气等工艺参变量对Mhp HN0613株发酵的影响,系统优化后确定该规模条件下的最优发酵工艺参数与过程控制路线;最后进行700 L规模条件的发酵工艺放大,确定规模化的发酵生产工艺技术路线。该研究首次采用了pH值回调与平衡kLa相结合的Mhp发酵工艺路线,对Mhp的规模化培养及疫苗产业化研究具有一定的指导意义。
1 材料与方法
1.1 主要试剂及设备
猪血清购自Gibco公司,脑心浸液(BHI)、PPLO肉汤均购自BD公司,酵母提取物购自Oxoid公司,注射用青霉素钠购自华北制药股份有限公司;Mhp抗体检测试剂盒及猪繁殖与呼吸综合征抗原检测试剂盒购自IDEXX公司;恒温培养箱购自赛默飞世尔科技有限公司,15 L发酵罐购自赛多利斯贸易有限公司,700 L发酵设备购自上海东富龙科技有限公司。
1.2 试验菌株与实验动物
Mhp HN0613株由普莱柯生物工程股份有限公司分离保藏[11],攻毒所用Mhp YC株组织毒由普莱柯生物工程股份有限公司制备保藏;猪繁殖与呼吸综合征病毒抗原阴性及Mhp血清抗体阴性仔猪20头(14~21日龄),日本大耳白兔(体重1.0~1.5 kg)20只,由普莱柯生物工程股份有限公司国家兽用药品工程技术研究中心动物房提供。
1.3 Mhp HN0613株培养基及培养工艺优化
1.3.1 种子复苏培养:Mhp HN0613株种子复苏培养基参考猪肺炎支原体Friis培养基配制[11]。活化Mhp HN0613株冻干菌,首先用1 mL Friis培养基将其溶解,然后按10%比例接种静置瓶,置于37℃恒温培养箱内静置培养,每天观察颜色变化,并对培养基pH值进行检测;待培养至培养基颜色由红色变为橙黄色时(pH值为7.0左右),进行接种或传代培养。
1.3.2 发酵培养基及培养工艺:发酵培养基采用经正交试验优化后的最佳培养基配方(初始pH值为7.6),一级种子接种后静置培养至对数期后期(pH值为7.0左右),接种15 L发酵罐进行培养,其中,带压封闭培养过程压力设置为100 m bar;700 L规模发酵共需进行三级种子培养,一级种子为静置瓶培养,二级种子采用15 L发酵罐培养,采取间歇通气搅拌的培养方式,待pH值降低至7.0左右时转接50 L发酵罐作为三级种子进行培养,最后接种700 L发酵罐开始发酵。

表1 不同代次对Mhp HN0613株培养滴度的影响CCU/mL

表2 种子复苏时间对Mhp HN0613株培养滴度的影响CCU/mL
1.4 猪肺炎支原体培养滴度检测方法
采用10倍稀释法,即1.8 mL Friis培养基添加200 μL菌种样品倍比稀释。取菌种样品在无菌条件下依次按照1∶10比例进行倍比稀释,稀释梯度达到 10-1、10-2······10-11, 以 Friis 培养基作为空白对照,于37℃培养箱内静置培养,每日观察记录培养基颜色变化,与空白对照比较颜色变黄计为一个滴度,即1×10 CCU/mL,未完全变色则计为半个滴度。
1.5 Mhp HN0613株灭活疫苗制备与效力评价
1.5.1 Mhp HN0613株灭活疫苗制备:用自制的以卡波姆为基础的水性佐剂,按10%的比例与Mhp抗原充分搅拌均匀,制备Mhp灭活疫苗,Mhp抗原由3批次700 L规模Mhp HN0613株发酵所得,抗原含量为 4×108CCU/mL[12]。
1.5.2 Mhp HN0613株灭活疫苗免疫猪效力评价:将20头合格实验仔猪随机分成4组,每组5头;其中,第1~3组分别免疫3批次700 L发酵抗原所配灭活疫苗,第4组未免疫。疫苗免疫采用颈部肌肉注射的方法,剂量为2 mL/头,免疫后35 d用Mhp YC株组织强毒进行攻毒,每头猪气管注射10 mL,含 100 MID(最小发病剂量);攻毒后 28 d对实验猪进行剖杀,并按28分法进行病变评分,计算肺炎病变减少率;肺炎病变减少率=(攻毒对照组实验猪肺炎病变平均得分-免疫组实验猪肺炎病变平均得分)/攻毒对照组实验猪肺炎病变平均得分×100%。
1.5.3 Mhp HN0613株灭活疫苗免疫兔效力评价:将20只日本大耳白兔随机分成4组,第1~3组分别腿部肌肉注射3批自制Mhp灭活疫苗,剂量为0.5 mL/只,第4组不接种作为空白对照;免疫后35 d采血,用IHA法检测兔血清Mhp抗体效价,抗体效价>1∶20即判为阳性,试验组结果大于4/5为合格,具体参照刘志南等[13]报道的IHA检测Mhp抗体方法进行。
1.6 数据处理
正交试验结果以 “平均值±标准差”表示,用SPSS 14.0统计软件对试验数据进行方差分析。
2 结果与分析
2.1 种子活化与复苏培养
种子活力对接种后菌体生长状态有着至关重要的作用,为了使Mhp HN0613株保持最佳接种活性,设计了2组平行试验,通过对比不同菌株代次及种子复苏时间,并根据CCU这一反映菌体生长活性的重要指标,考查其对Mhp HN0613株培养的影响。
由表1可知,Mhp HN0613株F11代较其他代次CCU水平高,可达1×109CCU/mL,为最佳活力代次。使用该代次菌株进行复苏培养,不同时间取样进行CCU水平检测。由表2可知,Mhp HN0613株F11代种子在复苏72 h后pH值降为7.0左右,CCU水平达到最高,为1×109CCU/mL。该试验最终确定了Mhp HN0613株最佳种子代次及复苏工艺条件,为后续发酵接种时机选取提供了依据。
2.2 静置培养筛选Mhp HN0613株最佳培养基配方与工艺条件
Mhp生长条件要求高,培养周期长,培养滴度的高低受培养工艺条件影响较大,为了确定Mhp HN0613株最适培养条件与工艺,设计四因素三水平正交试验考查初始葡萄糖添加量、初始培养基pH值、接种百分比和猪血清添加量对Mhp HN0613株培养的影响。
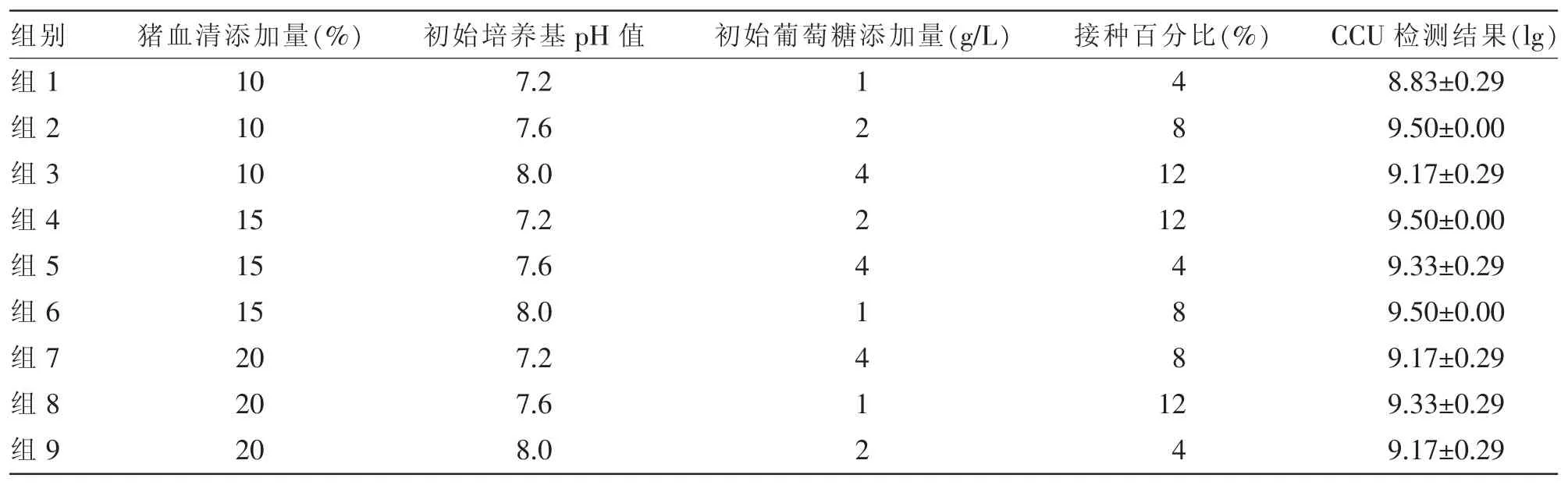
表3 Mhp HN0613 株 L9(34)正交试验结果
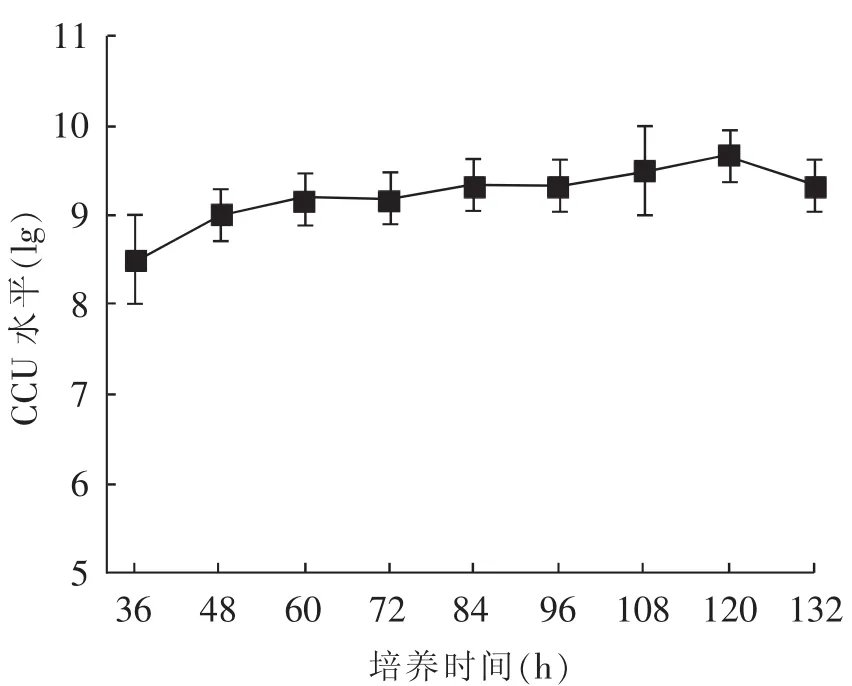
图1 Mhp HN0613株静置瓶培养CCU检测结果
Mhp HN0613株F11代种子复苏72 h(pH值降至7.0左右)后接种静置瓶进行静置培养,根据SPSS 14.0统计软件对表3中正交试验的分析结果,培养体系中,2%的初始葡萄糖添加量、8%接种百分比、初始培养基pH值7.6、15%猪血清添加量为Mhp HN0613株的最适培养条件;其中,葡萄糖添加量对Mhp HN0613株培养结果影响最大,但所有试验因素影响均不显著。在试验所得最适培养条件下,对Mhp HN0613株进行静置培养,不同时间点取样测定其CCU水平。由图1可知,Mhp HN0613株在培养120 h时滴度水平达到最高值,为5×109CCU/mL。该试验为Mhp HN0613株工艺放大试验确定了最佳的培养基配比。

图2 Mhp HN0613株15 L发酵工艺优化及CCU检测结果
2.3 平衡kLa联动pH值回调工艺技术的建立
Mhp为兼性厌氧型无细胞壁病原微生物,生长前期ROS需求较低,该试验根据Mhp HN0613菌株的特性,在15 L规模发酵时采用平衡溶氧传质系数kLa(前期带压封闭培养、后期间歇通气搅拌)的工艺策略,并对ROS、接种百分比、带压封闭时长及机械搅拌转速等发酵参数进行筛选。由于Mhp对ROS较为敏感,试验设计了较低水平的通气条件,分别为 100、150、200 L/h;搅拌转速分别设置为 200、300、400 r/min;接种百分比分别为4%、8%、12%。

表4 Mhp HN0613株50 L种子培养滴度变化CCU/mL

表5 3批Mhp疫苗免疫兔效力评价
通过单因素考查对比发现,通气量100 L/h、搅拌转速300 r/min和8%接种百分比条件最有利于Mhp HN0613株15 L发酵培养(见图2A);经工艺调整对比,最终将其确定为Mhp HN0613株发酵最优基本参数。Mhp发酵周期较长,考虑到发酵过程中培养基pH值变化及Mhp HN0613株对底物代谢的利用率,试验采取在一定培养阶段对培养基pH值进行回调的策略,并系统优化了pH值回调时机与参数,首创平衡kLa联动pH值回调的工艺技术路线。此外,优化后发酵罐搅拌结构类型由六直叶平叶涡轮改为推进式叶轮,在相同叶尖线速度的条件下降低了叶轮对菌体的剪切作用力。在该工艺条件下,Mhp HN0613株15 L发酵CCU水平最高可达1×1010CCU/mL,较优化前提高了10倍,且培养周期较工艺优化前缩短了2~3 d(见图 2 B)。
2.4 Mhp HN0613株700 L高密度发酵工艺放大
Mhp HN0613株放大发酵需进行三级种子培养,将发酵培养种子在对数期中后期(CCU达到最高值的时间点)接种至50 L种子罐,配合间歇通气搅拌工艺继续培养;取发酵过程中不同时间点样品进行CCU检测,结果见表4。由表4可知,50 L发酵种子CCU水平在培养60 h后 (pH值为7.0左右)达到最高值,以该点作为700 L发酵移种最佳操作时间节点。Mhp HN0613株700 L规模化培养同15 L发酵优化后工艺技术路线进行,取不同培养时间点样品进行CCU检测。由图3可知,CCU水平在培养50 h左右 (pH值降至 6.7左右)达到最高值,为5×109CCU/mL,最高批次培养滴度可达1×1010CCU/mL,实现了Mhp HN0613株高密度发酵工艺技术平台的建立。
2.5 Mhp HN0613株700 L发酵抗原对动物免疫效力评价结果
用3批700 L发酵抗原制备Mhp灭活疫苗对兔进行免疫,免疫后35 d采血,用IHA法测定血清抗体效价,结果见表5。由表5可知,第1~3组免疫兔血清抗体效价均不低于1∶40,最高可达1∶160,3组结果判定均为5/5阳性,对照组抗体效价均小于1∶5。将3批Mhp灭活疫苗对合格实验仔猪进行免疫,免疫后35 d对实验仔猪进行攻毒,攻毒后28 d进行剖杀,取出肺脏,按28分法对实验猪的肺病变 (“肉样变”“胰样变”)进行评分,计算肺炎病变减少率。由表6可知,免疫组实验仔猪肺炎减少率均高于80%,临床观察精神及食欲未见异常,攻毒对照组实验猪均观察到有典型的“肉变样”或“胰变样”,表明试验所用Mhp灭活疫苗对仔猪具有较好的免疫保护效果。
3 讨论
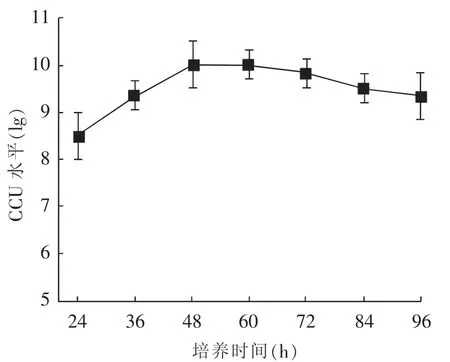
图3 Mhp HN0613株700 L发酵CCU检测结果

表6 3批Mhp疫苗免疫猪效力评价
影响Mhp生长的因素较多,如菌株活力、培养基成分和培养条件等,在同一菌株不同代次之间其活性可能存在着较大的差别。该研究首先确定了Mhp HN0613株的最佳活力种子代次及复苏培养条件,根据CCU水平达到最高值的时间最终确定其复苏培养周期为72 h。对于Mhp的培养,一般需要较高含量的血清来为细胞生长提供氨基酸、维生素、脂肪酸、胆固醇及生长因子等物质。该研究通过对Mhp HN0613株基本培养基成分进行优化筛选,使其在血清浓度为10%~15%的条件下培养滴度达到1×109~1×1010CCU/mL。近来有研究者制备出一种Mhp培养基,可实现在8%猪血清含量条件下CCU水平达到1×109CCU/mL,在一定程度上降低了Mhp的培养成本[14]。但血清浓度的降低可能导致Mhp的培养周期延长,滴度达到最高值后下降较快,收获pH值范围较窄,增加了培养的难度[15]。
Mhp属于兼性厌氧型微生物,对ROS需求量少且对机械搅拌剪切较为敏感,其大规模发酵培养一般在较低通气和搅拌转速条件下进行;有研究者在对Mhp 168株的发酵培养工艺研究中,将接种后培养基pH值调整为7.5左右,设置搅拌转速140 r/min,其前期培养过程中ROS及pH值均无明显变化,后期培养采用间歇通气及反馈补碱的方法维持培养体系ROS水平及pH值恒定,最终获得了较高的培养滴度水平[16]。该研究在对Mhp HN0613株15 L发酵工艺优化中同样发现,低水平的间歇通气及搅拌条件(通气量100 L/h,搅拌转速300 r/min)更有利于菌体发酵培养。补料分批培养是灭活疫苗抗原发酵的常用方式,该法往往能够在一定程度上提高菌体密度,延长菌体生长的稳定期[17];但对于 Mhp HN0613 株发酵,该研究通过15 L发酵工艺条件优化发现补料培养并不能提高其培养滴度,分析可能是由于所用培养基营养较为丰富,无需通过补料来为菌体后期生长提供营养元素。因此,考虑到Mhp HN0613株对培养基底物的代谢利用率,该研究采取在菌体培养后期进行pH值回调的工艺策略,以期为菌体生长提供更为有利的环境条件,提高菌体生长密度与滴度水平。
综合Mhp发酵过程中的影响因素,该研究创新性地采用平衡kLa联动pH值回调的工艺策略,并通过条件优化筛选,最终形成了稳定的Mhp HN0613株规模化发酵工艺技术路线,700 L发酵CCU水平最高可达1×1010CCU/mL,比国内发酵水平高出5~10倍;此外,该工艺条件下MhpHN0613株发酵周期较优化前缩短了2~3 d,且由该工艺生产的抗原制备灭活疫苗对猪具有较好的免疫保护效果。该研究为Mhp疫苗规模化发酵生产提供了一定的理论依据。

