姜黄素干预小鼠肠道菌群并抑制结直肠癌变的实验研究
陈文杰 苏献豪 王跃迁 王会鹏 叶桃 陈骏 赵加应 蔡元坤
结直肠癌(colorectal cancer,CRC)是常见的肠道恶性肿瘤,目前发病率居全球第三位,据统计每年超过120万新发病例,大约60万患者死于结直肠癌,居癌症相关死亡第四位[1]。结直肠癌的发生涉及到多因素、多阶段、多途径,近年来有研究发现肠道菌群失调可能在结直肠癌的发生中扮演重要角色,并且已发现多种细菌(产毒脆弱拟杆菌属、粪肠球菌、梭杆菌属、解没食子酸链球菌等)可能是大肠致癌菌[2-5]。姜黄素是从姜黄中提取的一种天然多酚类物质,因其具有抗炎、抗感染、抗肿瘤、抗氧化、免疫调节等多种药理作用和生物学功能[6],近年来成为研究的热点,本实验拟通过监测姜黄素干预小鼠成瘤过程中小鼠肠道菌群的变化,探究姜黄素的抗癌作用机制,及肠道菌群是否是其可能的作用靶点。
材料与方法
一、材料
实验动物:C57BL/6小鼠,6周龄,25只,体重17~20 g,SPF级饲养环境,由华东师范大学实验动物中心提供,生产许可证号:SCXK(沪)2011-0031。
主要试剂:氧化偶氮甲烷、右旋葡聚糖硫酸钠、姜黄素,均由Sigma-Aldrieh公司(美国)提供。
二、实验方法
实验分组及安排:25只小鼠随机分为基础饮食组(BD)5只、AOM/DSS造模组(MO)10只、姜黄素干预造模组(CU)10只,所有小鼠在同等环境下饲养1周后开始试验,基础饮食组全程自由饮食;造模组于1、4、7周首日腹腔注射AOM(10 mg/kg),然后自由饮用2.5%DSS药水3天后改为自由饮水[7];干预组在造模开始后进行姜黄素隔日灌胃(200 mg/kg)至处死。分别于实验前和处死前收集小鼠粪便,-80℃冰箱保存备用。
DNA提取及高通量测序:采用德国QIANEN公司生产的QIAamp DNA Stool Mini Kit试剂盒提取粪便样品微生物的总DNA,具体步骤按照说明书操作,所提取的DNA于-80℃保存。高通量测序扩增细菌16SrRNA的421~460 bp区 域, 上 下 游 引 物 分 别 为 421F5ʹ-ACTCCTACGGGAGGCAGCA-3ʹ,460R5ʹ-GGACTACHVGGGTWTCTAAT-3ʹ。将得到的PCR产物构建测序文库,采用Illumina Miseq平台测序,对高质量测序数据进行生物信息学分析,该部分由上海美吉生物医药科技有限公司完成。
三、统计学分析
统计学处理采用SPSS 21.0软件,计量数据以(x±s)表示,多组间差异采用方差分析,对于不满足正态分布或方差齐性的数据采用Welch检验和Brown-Forsythe检验,P<0.05为差异有统计学意义。基于样品测序产生的OTU结果,采用Qiime软件计算beta多样性距离矩阵,并用R语言vegan软件包作非线性多维标度(nonmetric multidimensional scaling,NMDS)。
结 果
一、小鼠体重及成瘤变化
造模组与姜黄素组小鼠在后期的体重增量中,造模组小鼠体重增量平均要少于姜黄素干预组(见图1)。在第7周处死小鼠时发现,姜黄素组小鼠结直肠肿瘤的成瘤数量、瘤体体积(见图2、3),明显小于造模组,提示在肿瘤的发生过程中,姜黄素起到了抑制肿瘤生成的作用。
二、测序序列及测序深度
在44例样本中,总共获得2 373 451条原始序列,经过质量过滤且Index完全匹配的有效序列和去除嵌合体之后的优质序列数为1 596 185,样本序列长度主要集中在421~460 bp区域。为了便于进一步研究,对所有有效序列进行了OUT聚类,并按照最小样本序列数进行了抽平,最终获得339OUT单元。(见图4)。

图1 小鼠体重增长图

图2 造模组及姜黄素组成瘤图片

图3 成瘤数目及载瘤负荷图
三、稀释曲线及丰度分布曲线
在OUTs聚类完成的基础上,我们进行稀释曲线和丰度曲线的绘制,稀释曲线图中可以看出开始时曲线快速上升,说明随测序深度增加,新发现的细菌种类也增加;随着测序深度增加(序列数目增多),曲线趋于平缓,当序列数达一定数目时,基本处于平台期,提示测序深度可以覆盖所有细菌物种。从物种丰度曲线可以看出,相对丰度过高的菌种在各样本中较少,随样本中物种组成丰富度的增加,曲线越平坦,物种组成的均匀度也就越高,不同样本在不同的丰度达到平台期,多数样品所测得OTUs丰度在10至200区间。见图5。
四、Alpha多样性分析
通过组间差异检验可以看出,T1点(干预前)时各组小鼠的多样性指数差异无统计学意义,T2点(干预后)时MO组的多样性指数更高,高于其他2组,与BD组比较差异有统计学意义(t=2.73,P=0.02),与CU组比较差异无统计学意义(见表1、2)。另外可以看出T2点时各组的多样性指数均较T1点时明显升高,其中CU组与BD在T2点时多样性指数更接近,均小于造模组,提示化学诱导成瘤过程中,小鼠肠道菌群结构出现变动,而姜黄素能维持肠道菌群相对稳定。
五、各组在门水平的比较分析
对优质序列按照不同相似程度进行聚类获得OUTs,每一OUT中选一条代表性序列同已知数据库比对、注释分析,获得该序列代表的细菌信息。分别按门(Phylum)、纲(Class)、目(Order)、科(Family)、属(Genus)水平统计结果。图6为各小鼠肠道菌群在菌门(Phylum)水平构成的柱状图。可以看出各组小鼠肠道菌群在门水平有其特异性,但是拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、疣微菌门(Verrucomicrobia)以及变形菌门(Proteobacteria)为主要优势菌门。其他如放线菌门(Actinobacteria)、柔膜菌门(Tenericutes)也存在于大部分样品中,但丰度均小于1%。另外可以看出优势菌门的物种在干预前后发生了变化,为了更直观准确的对比菌群的变化,我们对基础组、造模组和姜黄素组小鼠肠道菌群在门水平上进行了对比分析统计(见图7),从统计图中我们可以直观的看出,基础饮食组的肠道菌群在测序前后无明显变化,排除了饲养环境引起的菌群变化因素;造模组和基础饮食组干预前后肠道菌群在门水平没有明显变化,而姜黄素组改变较大,表现为干预后拟杆菌门(Bacteroidetes)增加,厚壁菌门(Firmicutes)减少,差异有统计学意义(P<0.05),另外疣微菌门(Verrucomicrobia)、变形菌门(Proteobacteria)以及放线菌门(Actinobacteria)干预后也有少量增加,差异有统计学意义(P<0.05);干预后造模组与姜黄素组对比,姜黄素组拟杆菌门(Bacteroidetes)较少,疣微菌门(Verrucomicrobia),差异有统计学意义(P<0.05)。

图4 序列长度分布图

图5 稀释曲线及丰度分布曲线图

表1 T1点(干预前)Alpha多样性指数表

表2 T2点(干预后)Alpha多样性指数表

图6 门水平小鼠肠道菌群柱状图
六、各组在属水平的比较分析
从菌属水平可以看出,造模组与姜黄素组干预前后菌属发生了很大改变,造模组干预前后变化有统计学意义的菌属有:Blautia(P<0.05)、Unclassif i ed_f__Enterobacteriaceae(P < 0.01)、Parabacteroides(P < 0.001)、unCUltured_f__Ruminococcaceae(P < 0.01)、Lactobacillus(P<0.05),姜黄素组干预前后变化有统计学意义的菌属有:norank_f__Bacteroidales_S24-7_group(P<0.001)、Akkermansia(P<0.05)、Blautia(P<0.01)。为了进一步观察造模组和姜黄素组干预后菌属有无区别,我们对二者进行了比较,结果发现Akkermansia在姜黄素组富集,而Parabacteroides在造模组富集,差异有统计学意义(P<0.01)。见图8。
讨 论
近年来,从中药中分离提取有效成分进行抗癌研究逐渐成为研究热点,姜黄素便是其中之一。既往的研究表明,姜黄素具有抗炎、抗肿瘤等作用。众所周知,肠炎是引起肠癌的重要原因之一。姜黄素作为一种较安全的中药成分,人们在之前就已经开始了姜黄素作用于肠炎的研究[8],作为对现有治疗的补充。但是,姜黄素生物利用度非常低,限制了它作为药物的应用。
近年来,随着肠道菌群的改变对肠癌发生发展的研究越来越多,人们意识到肠癌的发生和肠道菌群也有着密不可分的关系[9-10],口服姜黄素生物利用率低,但是在肠道内,姜黄素与肠道菌群直接作用,我们猜想姜黄素会与肠道菌群互相作用从而调节肠道菌群的构成,以此来进行对肠炎肠癌的预防。通过使用经典的造模方法,同时在造模的基础上进行姜黄素的干预,我们设计了此实验,并且通过高通量测序的方法,证明了姜黄素在预防肠癌的发生发展上,确实调整了肠道菌群的构成,并在一定程度上维持了肠道菌群的稳定。相比于造模组小鼠,姜黄素组小鼠的肠道菌群虽然在主要菌群中有比较大的变化,但是在种属的分析上,我们可以看出,造模组的小鼠肠道菌群变化更大,而在姜黄素干预组小鼠变化中,我们可以看到属于疣微菌门(Verrucomicrobia)的艾克曼菌(Akkermansia)有明显的增加,在最近的研究中[11]已经确认艾克曼菌(Akkermansia)对于减少肠道炎症有很重要的作用,通过我们的数据,我们可以认识到,姜黄素通过增加艾克曼菌抑制肠道炎症从而减少肠癌的发生。但同时我们也可以看到,在我们的测序数据里面,最主要的拟杆菌属发生了非常大的变化,而造模组的拟杆菌属的变化却没有姜黄素组这么剧烈。结合我们既往的研究[12],推断在造模成瘤的过程中,产毒脆弱拟杆菌属在造模组中占据了主要地位,造成肠癌的发生,而姜黄素组抑制了此类菌种在肠道菌群中的组成,从而进一步抑制肠癌的发生。由于测序深度有限,我们无法在此文中给出确切的数据来证明我们的猜想。但是结合既往的研究结果,我们不难推断出我们的实验从一个基本面上证明了我们的猜想。综合上述结果,我们可以认为,姜黄素一方面通过尽量维持肠道菌群的稳定性来减少肠癌的发生,另一方面,姜黄素也通过增加肠道内的益生菌,抑制有害菌属的增加来抑制肠炎的发生发展,从而进一步的抑制肠癌的发生发展。

图7 各组门水平小鼠肠道菌群差异图。7A:BD组干预前后门水平菌群差异;7B:CU组干预前后门水平菌群差异;7C:MO组干预前后门水平菌群差异;7D:CU组与MO组干预后门水平菌群差异
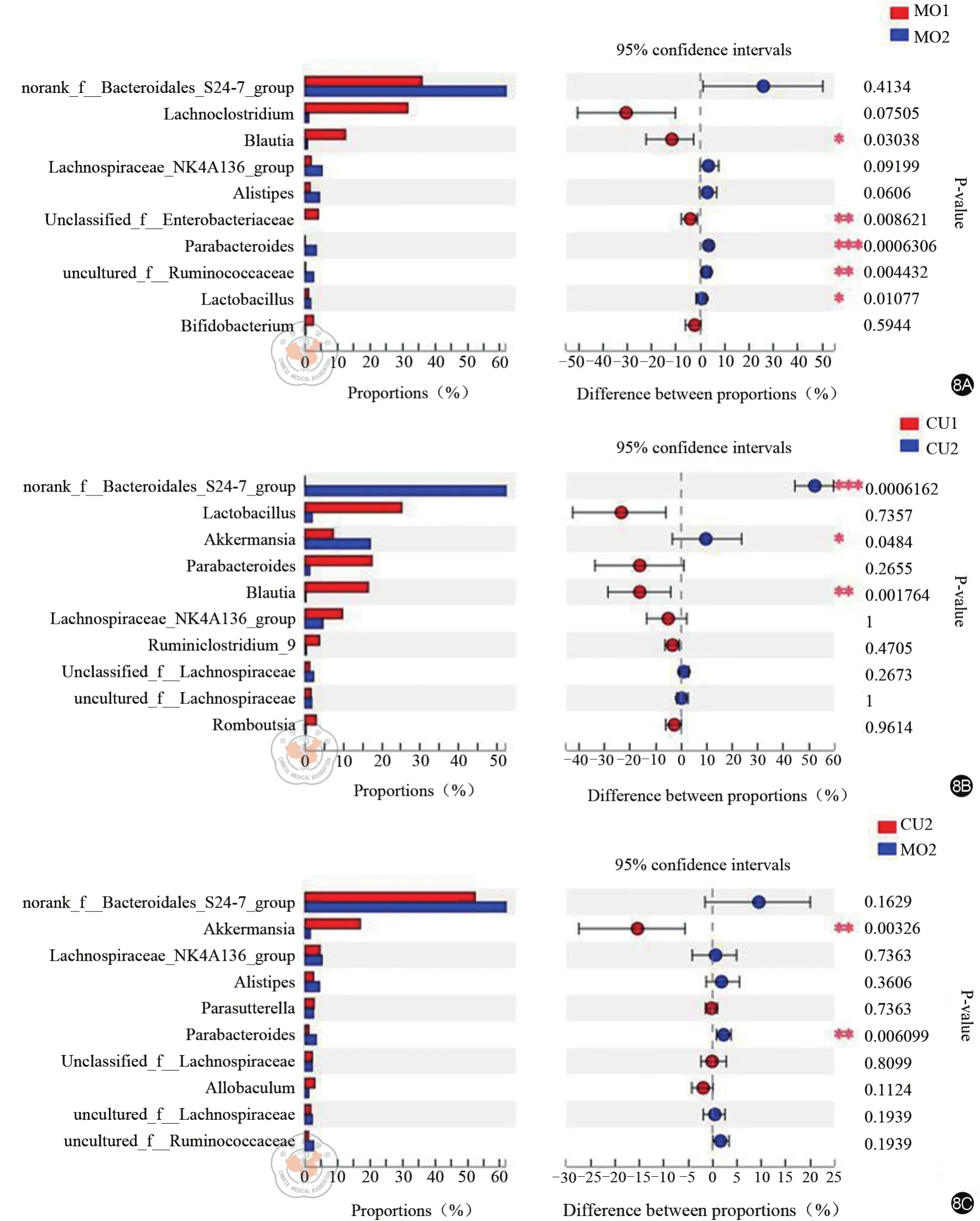
图8 各组属水平小鼠肠道菌群差异图。8A:MO组干预前后属水平菌群差异;8B:CU组干预前后属水平菌群差异;8C:CU组与MO组干预后属水平菌群差异
综上,本研究通过小鼠结直肠癌模型,初步探究了姜黄素可能的抑癌机制,为结直肠癌与肠道菌群相关性的研究提供了新思路。

