IL-17A通过上调ABCA1的表达减少RAW264.7巨噬细胞脂质的积聚*
马望歌, 周 栋, 王丽君, 刘 艳, 陈小莉, 郭 宁, 周 娟△
(1西安交通大学第一附属医院心血管内科, 陕西 西安710061; 2汉中市中心医院心血管内科, 陕西 汉中 723000)
动脉粥样硬化(atherosclerosis,AS)是心血管疾病的重要致病因素之一,且已被认定为一种慢性炎症性疾病[1],AS的进展与动脉壁的炎症及免疫反应息息相关。在AS进程中,巨噬细胞可以通过摄取氧化修饰的低密度脂蛋白引起胞内脂质堆积,并转变为泡沫细胞,从而最终在AS的形成过程中发挥着重要的推动作用[2]。巨噬细胞膜上的三磷酸腺苷结合盒转运体 A1(adenosine triphosphate binding cassette transporter A1,ABCA1)[3]可以介导细胞内脂质的流出,维持细胞脂质稳态,因而是体内重要的抗AS的蛋白之一。
已证实在AS斑块中存在水平较高的白细胞介素家族新型细胞因子白细胞介素17A(interleukin-17A, IL-17A)[4],但其在AS发展进程中的作用尚存争议。有文献报道IL-17A具有一定的抗AS作用[5],但机制不清。本研究旨在探索细胞因子IL-17A对RAW264.7巨噬细胞ABCA1表达的影响,进而明确IL-17A在AS进程中的作用及其发生机制。
材 料 和 方 法
1 试剂
RAW264.7细胞购自中国科学院上海细胞库。DMEM 培养基购自HyClone;胎牛血清购自Gibco;TRIzol购自Invitrogen;逆转录试剂盒购自Fermentas;SYBR Green实时定量PCR试剂盒购自TaKaRa;RIPA 裂解液购自碧云天生物有限公司;抗ABCA1抗体购自Novus;抗β-actin抗体购自Cell Signaling Technology;引物由上海生工公司合成;其它试剂均为国产分析纯。
2 主要方法
2.1细胞培养 RAW264.7细胞常规培养于含10%胎牛血清的DMEM基本培养基中,5% CO2、37 ℃孵箱培养。2~3 d换液 1 次,待细胞长满后进行胰酶消化、传代。取生长状态良好的细胞种植于6孔板中。细胞干预处理前,使用无血清培养基饥饿细胞18~24 h。
2.2细胞干预方法 本实验中,我们根据具体情况分别给予终浓度为0、10、20和50 μg/L的IL-17A进行干预6和24 h,再检测ABCA1的mRNA和蛋白表达水平;在时间梯度实验中,我们给予终浓度为20 μg/L的IL-17A分别干预细胞1、3、6、12及24 h,并检测ABCA1的mRNA和蛋白表达水平。
2.3Western blot实验 吸尽培养基,预冷PBS漂洗2次,加入蛋白裂解混合液(RIPA)裂解细胞,并提取蛋白进行蛋白定量。采用SDS-PAGE分离等量蛋白,将其转移到PVDF膜上,5%脱脂牛奶封闭后加入I抗孵育、4 ℃过夜,孵育 II 抗后化学发光法显色。β-actin作为内参照。
2.4RT-qPCR实验 提取细胞总RNA,逆转录为 cDNA,RT-qPCR进行扩增。ABCA1的正向引物序列为5’-GCGGCAACAAACGAAAGCTC-3’,反向引物序列为5’-GGCACCTGAACCTTCCATTG-3’;β-actin的正向引物序列为5’-GTGACGTTGACATCCGTAAA-3’,反向引物序列为5’-TAAAACGCAGCTCAGTAACA-3’。PCR扩增条件为: 95 ℃预变性10 s; 95 ℃变性5 s、56 ℃退火20 s、72 ℃延伸10 s,共40个循环。读取样本中 ABCA1 和 β-actin的Ct值。β-actin作为内参照,目的基因相对表达量采用2-ΔΔCt法进行计算。
2.5NBD-胆固醇流出测定 取对数生长期的RAW264.7细胞,在含0.5% FBS的DMEM 中分别加入20 μg/L IL-17A或等体积ddH2O培养18 h,而后加入NBD-胆固醇(1 mg/L)孵育6 h,PBS 漂洗2次后,2组分别加入含 0.2% BSA的DMEM及载脂蛋白A1(apolipoprotein A1,ApoA-1; 15 mg/L)+0.2% BSA,收集细胞上清并裂解细胞,在Victor X多标记酶标仪上读取荧光强度值并进行分析。
2.6油红O染色细胞内脂质含量的测定 将RAW264.7细胞培养在放置有消毒盖玻片的6孔培养板内, 细胞经IL-17A干预处理后, 再加入ox-LDL 30 mg/L继续孵育8 h, PBS洗3次,4%多聚甲醛室温下固定30 min,油红O工作液染色15 min,苏木素染色30 s,甘油明胶封片后,光学显微镜下观察细胞内的脂滴含量。
3 统计学处理
统计软件采用SPSS 18.0,数据以均数±标准误(mean±SEM)表示,数据统计以单因素方差分析检验方法进行多组间比较,组间差异比较用LSD-t检验,以P<0.05为差异有统计学意义。图表绘制采用GraphPad Prism 5.0软件。
结 果
2.1 RAW264.7巨噬细胞的一般情况观察
RAW264.7细胞呈扎堆生长,正常的状态是成片地生长,并会叠加成层。生长状态良好的细胞RAW264.7细胞刚贴壁时呈圆形,折光度很好,镜下观察明亮如小珍珠状一个个地散落于瓶底面。生长一段时间后,部分细胞会变为类似四角形或多边形,同时伸出伪足,见图1。
2.2 IL-17A可以增加RAW264.7巨噬细胞ABCA1蛋白的表达
与未经IL-17A干预的细胞相比,给予20 μg/L的IL-17A干预1 h、3 h、6 h、12 h和24 h,RAW264.7巨噬细胞的ABCA1蛋白表达显著增加,在6 h时达到峰值,24 h时仍然保持较高水平(P<0.05),见图2。
Figure 1.Observation of RAW264.7 macrophage growth under microscope (×40).
我们进一步给予浓度为10、20和50 μg/L的IL-17A分别干预RAW264.7细胞6 h及24 h,结果显示,细胞ABCA1蛋白的表达水平均随干预浓度的增加而升高(P<0.05),见图3。
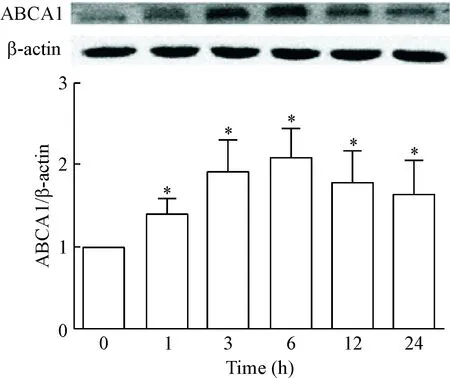
Figure 2.The protein expression of ABCA1 in the RAW264.7 macrophages treated with IL-17A at 20 μg/L for different time. Mean±SEM. n=5. * P<0.05 vs 0 h.

Figure 3.The protein expression of ABCA1 in the RAW264.7 macrophages treated with IL-17A at different doses for 6 h (A) and 24 h (B). Mean±SEM. n=3~4. *P<0.05 vs 0 μg/L.
3 IL-17A可以增加RAW264.7巨噬细胞ABCA1蛋白的含量,但不影响其mRNA的表达
为了探究IL-17A增加巨噬细胞ABCA1蛋白表达的分子机制,我们进一步检测IL-17A干预条件下细胞ABCA1的mRNA表达水平。RT-qPCR结果示,与对照组相比,给予浓度为10、20和50 μg/L的IL-17A干预RAW264.7细胞1 h、3 h和6 h,ABCA1的mRNA表达水平均无显著变化,见图4。
4 IL-17A可以增加RAW264.7巨噬细胞ApoA-1介导的胆固醇流出
我们进一步测定了由IL-17A介导的ABCA1蛋白表达增加对巨噬细胞胆固醇流出的影响,正常对照组细胞在加入NBD-胆固醇后,其流出率约为20%,而当20 μg/L的IL-17A与细胞共孵育18 h,细胞NBD-胆固醇的流出率大幅增加(P<0.05),见图5。
5 IL-17A可以减少巨噬细胞ox-LDL的积聚
为了观察IL-17A增加巨噬细胞ABCA1蛋白的表达是否会影响细胞脂质的积聚,我们将RAW264.7细胞与ox-LDL共同孵育,同时采用油红O染色法检测细胞脂质含量。结果显示,与对照组相比,ox-LDL与细胞共孵育可以明显增加细胞内的脂质含量,但IL-17A预处理却可以显著降低细胞脂质含量,见图6。
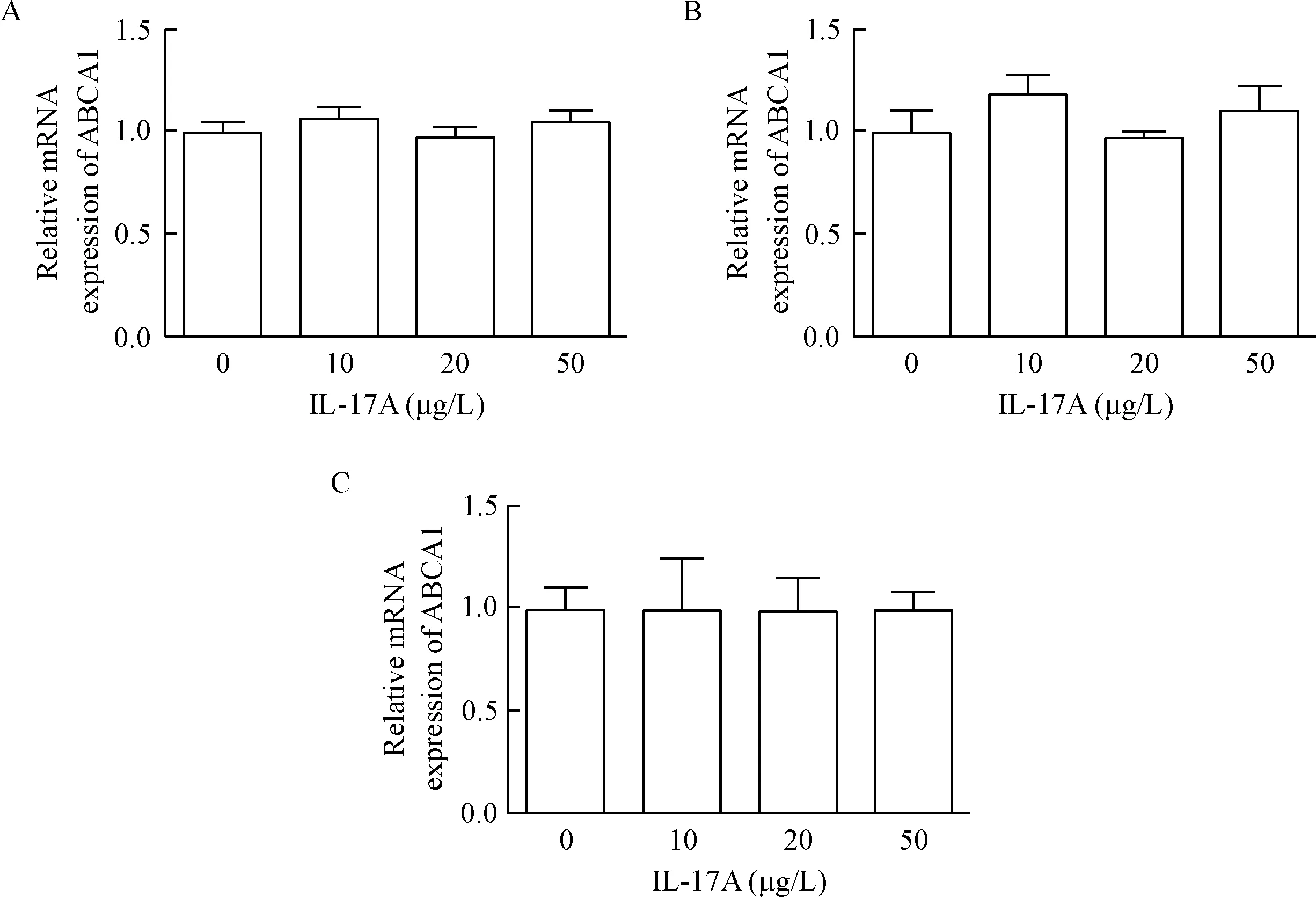
Figure 4.The mRNA expression of ABCA1 in the RAW264.7 macrophages treated with IL-17A at different dose for 1 h (A), 3 h (B) and 6 h (C). Mean±SEM. n=3.
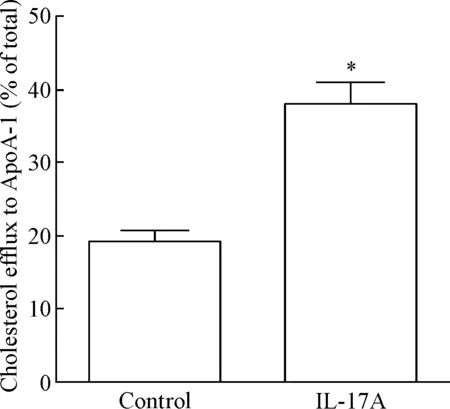
Figure 5.The cholesterol efflux to ApoA-1 of RAW264.7 macrophages treated with or without IL-17A. Mean±SEM. n=3. *P<0.05 vs control group.
讨 论
AS是心血管疾病的重要致病因素之一,是冠心病的主要病因,而巨噬细胞所形成的泡沫细胞[6]又是AS的主要病因。在AS中,巨噬细胞脂质代谢的紊乱,吞噬超负荷脂质,引起泡沫化是AS进程中至关重要的一步,促使泡沫细胞内脂质外流即胆固醇逆向转运(reverse cholesterol transport,RCT)[7]对防治AS具有重要意义。研究证实,外周组织细胞与胞外胆固醇受体之间至少有3种胆固醇流动途径[8]:(1)细胞内外胆固醇水相扩散;(2)SR-BI介导的双向被动转运;(3)ABCA1与ABCG1介导的单向主动转运,其中ABCA1和ABCG1介导的单向胆固醇流出是外周组织胆固醇流出的主要途径。ABCA1主要介导细胞内胆固醇流出至ApoA-1,它可有效减少外周组织脂质的蓄积。
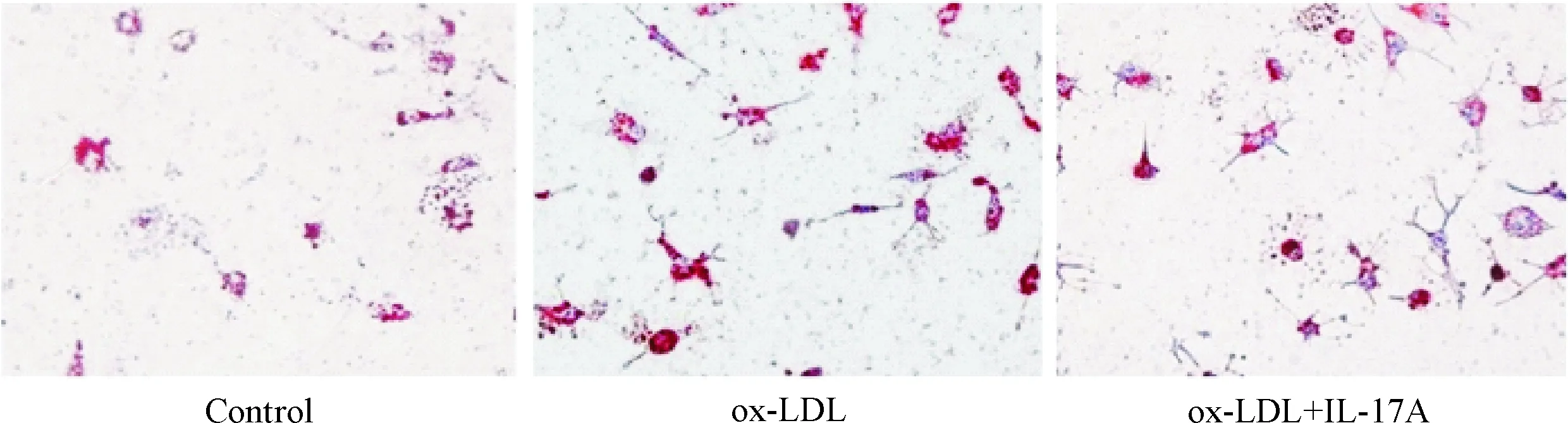
Figure 6.Lipid accumulation in the RAW264.7 macrophages treated with or without IL-17A (×40).
现今,IL-17A在动脉粥样硬化中的作用还具有较大争议[5]。有研究证实,IL-17A的表达在人群及小鼠的AS斑块病损区显著增多[9],在给予小鼠IL-17A中和抗体后,AS的严重程度得到了明显的改善,提示IL-17A在AS斑块的形成中具有促进作用;但另一方面,有资料显示高脂饮食所诱导的载脂蛋白E基因敲除的AS小鼠模型,结果发现蜂胶乙醇提取物可使该小鼠模型IL-17A表达水平增高进而表现出AS病变明显被抑制。本研究从IL-17A入手,重点探讨其对巨噬细胞ABCA1表达的影响。我们的研究证实,IL-17A可以增加RAW264.7巨噬细胞胆固醇代谢关键性因子ABCA1蛋白的表达。胆固醇逆向转运是机体内排出过多胆固醇的唯一途径,对维持生物体胆固醇代谢的稳态具有重要意义。胆固醇的逆向转运也被认为是机体抗动脉粥样硬化的关键步骤之一。ABCA1可以促进胞内胆固醇和磷脂的流出,随后与细胞表面apoA-I相结合,最终形成新的HDL[10]。我们的研究表明IL-17A可以增加RAW264.7巨噬细胞ABCA1的表达,说明IL-17A可能具有一定的抗AS作用,这一作用可能与其促进巨噬细胞脂质的逆向运输,从而抑制巨噬细胞的泡沫化,阻碍泡沫细胞的形成有关(这一作用在我们的油红O染色实验中也得到了初步的证实)。有关IL-17A促进ABCA1表达的具体机制,我们的实验也进行了初步的探讨。结果表明,IL-17A不影响ABCA1的mRNA表达水平,说明IL-17A并不是通过增加ABCA1基因的转录而促进其表达的。那么,IL-17A是否会通过减少ABCA1蛋白质的降解从而促使其表达升高?我们也将在后续的实验中进一步证实。
本实验结果表明,IL-17A可以增加RAW264.7巨噬细胞ABCA1蛋白的含量,但却不影响其mRNA的表达水平。IL-17A可以减少RAW264.7巨噬细胞内脂质的积聚从而抑制泡沫细胞的形成,这一作用可能与其具有一定的抗AS效能有关。

