肺癌抗原COX-2长肽疫苗的设计及免疫活性检测*
范双莉, 任亚丽, 赵志华
(1济源职业技术学院, 河南 济源 459000; 2郑州大学, 河南 郑州 450000)
肺癌是常见的肿瘤死亡原因之一,尽管最近有系统性的改善治疗方案,晚期肺癌患者的预后仍然效果不佳,更有效的治疗方式是急需的,免疫治疗就是未来治疗肺癌的一种途径[1-2]。已知环加氧酶2(cyclo-oxygenase 2,COX-2)在肺腺癌和非小细胞肺癌中表达明显上调[3],COX-2的过度表达在肺癌的发展中起重要作用[4],COX-2的高水平表达与免疫调节活性有关。COX-2抑制剂可以增加肺癌对放疗的敏感性,提高对肺癌的疗效[5]。也有实验通过激动血管紧张素II 1型受体降低COX-2的表达起到治疗肺癌的作用。以降低COX-2表达为作用位点的的抗肿瘤药物可能开辟肺癌治疗的新领域。使用软件预测抗原区域[6],筛选包含优势区域的长肽,长肽能被专职抗原提呈细胞树突状细胞(dendritic cells, DC)有效加工和提呈,在流通的淋巴结里表位能被持续的提呈[7],另外长肽在体内降解较慢。为此我们选择COX-2进行预测并设计长肽,进行免疫学活性实验,希望能为肿瘤多肽疫苗候选效果更好的长肽。
材 料 和 方 法
1 材料
人肺腺A549细胞由实验室常规保存,采用37 ℃、 5% CO2、饱和湿度培养条件下,用含10%胎牛血清的DMEM培养基常规培养。T2A2细胞为转染HLA-A*0201分子的TAP缺陷T2细胞系,用含10%胎牛血清的IMDM培养基在37 ℃、5% CO2细胞培养箱中培养。外周血单个核细胞(peripheral blood mononuclear cells,PBMCs)从医院血站提供的HLA-A2+健康供者血液分离所得。
2 方法
2.1设计长肽疫苗 首先对肺癌抗原COX-2进行HLA-A2限制性细胞毒性T淋巴细胞(cytotoxic T-lymphocytes,CTL)表位肽的预测,使用生物信息学预测软件NetCTL 1.2 Server(http://www.cbs.dtu.dk/services/NetCTL/)[8]、SYFPEITHI(http://www.syfpeithi.de/bin/MHCServer.dll/EpitopePrediction.htm)[9]和IEDB(http://tools.iedb.org/main/tcell/)[10]软件对COX-2氨基酸序列预测打分。CTL表位限制性MHC类型为HLA-A*02。预测抗原肽长度为9个氨基酸。目的抗原COX-2的氨基酸序列参照GenBank: AAA58433.1所提供的序列。根据集中的HLA-A2限制性CTL表位设计COX-2抗原来源的长肽,共获得3条长肽,分别为COX-2 P315-338、P355-377和P375-401。
2.2HLA-A2限制性CTL表位肽的合成 候选表位肽由上海生工生物工程有限公司合成,经反相高效液相色谱法分析纯化后,其纯度大于95%,经电喷雾质谱法鉴定相对分子质量符合理论值。
2.3外周血单个核细胞的分离 准备50 mL离心管,预先加肝素钠,预防血凝。抽取外周血20 mL或40 mL,加入等体积的PBS混匀;将淋巴细胞分离液4 mL加入到15 mL 离心管中,缓慢注入PBS与血液的混合液8 mL;常规聚蔗糖-泛影葡胺分层液梯度离心,2 000 r/min,离心20 min后,用弯管将上层血清抽掉,再轻轻抽取白膜层;按PBS∶白膜层细胞>5∶1的比例,洗涤白膜层,2 000 r/min离心15 min,得白膜层细胞;用含10%胎牛血清的IMDM培养基重悬,计数。
2.4DC的体外诱导 按上述方法分离得到PBMCs,10%胎牛血清IMDM培养基重悬,计数2×109/L,按每孔2 mL分至6孔板中,37 ℃、5%CO2培养箱中培养6 h;将未黏附的细胞洗脱,抽取液体及未贴壁的细胞,1 000 r/min离心10 min,收集细胞,在6孔板里加入温热的IMDM培养基2 mL,加入IMDM培养基2 mL,并补加粒-巨噬细胞集落刺激因子(granulocyte-macrophage colony-stimulating factor,GM-CSF; 100 μg/L)和白细胞介素 4(interleukin-4,IL-4; 50 μg/L);于37 ℃、5%CO2培养箱中继续培养; 每2 d半量换液1次,并补加GM-CSF(100 μg/L)和IL-4(50 μg/L);培养至第5天加入脂多糖(lipopolysaccharide,LPS; 100 μg/L),诱导DC成熟;48 h 后收集细胞[11]。
2.5DC荷肽实验 收集成熟的DC,用无血清IMDM培养基充分洗涤,重悬计数(0.5~1)×109/L;加入长肽20 mg/L,培养4 h;收集细胞,用无血清IMDM培养基洗涤1次;重悬计数,加入50~100 μg的丝裂霉素C,加入20 mg/L的长肽,培养1 h;用含10%已灭活胎牛血清的IMDM培养基重悬,计数2×108/L;取PBMCs,重悬计数2×109/L,荷肽的DC作为刺激细胞,两者各取0.5 mL加入24孔板;隔日添加重组白细胞介素2(recombinant interleukin-2, rIL-2; 5×104U/L),每3 d半量换液,并补加rIL-2; 1 周后收集细胞,以10∶1的比例与新鲜制备的荷肽DC共培养,进行第2轮刺激;第3次刺激后的第3天收集细胞,用于后续活性实验[12]。
2.6IFN-γ分泌水平的检测 取出酶联免疫斑点实验(enzyme-linked immunospot assay,ELISPOT)板条(购自达科为生物技术有限公司),加200 μL无血清的IMDM培养基进行封闭,静置10 min;将前期诱导的CTL作为效应细胞,调整细胞浓度为2×109/L,每孔加50 μL;荷肽的DC作为刺激细胞,补加40 μL的无血清IMDM培养基,设立对照孔和实验孔;37 ℃、5% CO2孵育18 h;倾尽孔中培养基,每孔加入200 μL无菌的去离子水,4 ℃裂解细胞10 min;倾尽孔内液体,加入200 μL 1×Washing Buffer洗涤6次,每次停留60 s;加入 100 μL生物素标记的抗体,37 ℃孵育1 h;倾尽孔内液体,加入200 μL 1×Washing Buf-fer进行洗涤,方法同上,在吸水纸上拍干;加入100 μL酶联亲和素,37 ℃孵育1 h;每孔加入200 μL 1×Washing Buffer进行洗涤,方法同上;加入100 μL现配的AEC显色液,25 ℃避光静置30 min;结束后置于通风处,室温静置干燥;结果用 ELISPOT 图像分析仪计数 96 孔板中每孔的斑点数[13]。
2.7羧基荧光素琥珀酰亚胺酯(carboxyfluoresceinsuccinimidyl ester,CFSE)荧光染色检测细胞毒性实验 通过离心收集靶细胞,并将细胞重悬于含有1%FCS的PBS中,并将细胞浓度调节至1×109/L。致敏靶细胞:每1 mL细胞悬浮液加入0.5 μL 5 mmol/L CFSE(购自Sigma),室温、光照孵育4 min。对照靶细胞:每1 mL细胞悬液中加入0.5 μL 100 μmol/L CFSE,室温、光照孵育4 min。将细胞用5% FCS-PBS洗涤1次,离心并除去上清液,将细胞重悬于无血清IMDM培养基中。将效应细胞(前期诱导的CTL作为效应细胞)在无血清IMDM培养基中洗涤1次,并以(1.25~5)×109/L的浓度重悬于无血清IMDM培养基中。将效应细胞(分别为12.5∶1、25∶1和50∶1)与致敏的靶细胞在离心管中混合,靶细胞数为2×104,最终体积并在37℃温育4 h孵育后,用含有1%FCS和0.1%叠氮化钠的PBS(FACS)处理相同的E∶T致敏的靶细胞组和对照靶细胞组,并用FACS洗涤。离心,重悬在含4%多聚甲醛的PBS溶液中,流式细胞术检测杀伤率。杀伤率(%)=(对照样品中致敏靶细胞的数量-测试样品中致敏靶细胞的数量)/对照样品中致敏靶细胞的数量×100%。
2.8乳酸脱氢酶(lactate dehydrogenase,LDH)实验检测细胞毒性 调整效应细胞浓度 2×109/L;调整靶细胞A549细胞浓度为1×108/L,每孔加50 μL,即为每孔5 000个;按设置的效靶比加入效应细胞及各种对照组,每孔终体积为100 μL; 37 ℃、 5% CO2孵育箱中孵育4 h,孵育结束前45 min,在靶细胞最大释放组和体积校正组中各加入10 μL裂解液;离心孔板,1 000 r/min离心10 min,转移上清50 μL至96孔板中;每孔加入50 μL乳酸脱氢酶底物混合液,室温避光孵育30 min;每孔加入50 μL终止液;在酶标仪上设置490 nm波长测定吸光度(A)值。靶细胞杀伤率(%)=(实验组A值-效应细胞自发释放组A值-靶细胞自发释放组A值)/(靶细胞最大释放组A值-靶细胞自发释放组A值)×100%[14]。
2.9胞内因子染色法检测T细胞释放IFN-γ水平 诱导的CTL作为效应细胞,荷肽的DC作为刺激细胞;阴性对照孔每孔加入1×109/L的效应细胞,终体积为1 mL;阳性对照孔每孔加入1×109/L的效应细胞和100 μL 植物凝集素(phytohemagglutinin, PHA)再补加900 μL无血清的IMDM培养基培养。加入阻断剂布雷菲德菌素A(brefeldin A, BFA; 5 mg/L)到培养体系中,充分混匀。于培养箱中37 ℃、5% CO2孵育4 h;孵育结束后, 1 500 r/min 离心5 min,收集细胞,用含2% FBS溶液的PBS将细胞重悬。避光加入细胞表面抗体,4 ℃避光孵育20 min, 1 500 r/min 离心5 min。用细胞染色溶液洗涤2次,收集细胞,每孔加入100 μL破膜剂,4 ℃孵育20 min。收集细胞,加入抗IFN-γ抗体,4 ℃避光孵育30 min;每管加入500 μL细胞染色溶液,重悬,转移到Falcon 圆底试管中上机检测。
3 统计学处理
采用SPSS 16.0标准版统计软件进行数据分析,用GraphPad Prism软件绘图。实验数据用均数±标准差(mean±SD)表示,采用单因素方差分析检验多组均数之间的差异,以P<0.05为差异有统计学意义。
结 果
1 COX-2 HLA-A2限制性CTL表位的预测以及长肽的设计结果
预测COX-2蛋白开放阅读框中潜在的HLA-A2超型限制性CTL表位,依据NetCTL 1.2、SYFPEITHI和IEDB软件的结果,选取在各个预测软件中分值排名靠前的表位肽,当某一肽段SYFPEITHI的打分不太好,而IEDB和NetCTL 1.2打分较好时,我们也将其列入考虑范围。设计长肽的长度我们尽量选择包含已经预测的较好的9个氨基酸肽段。所设计的长肽长度大概25个氨基酸左右。具体打分情况以及设计长肽结果见表1。
2 ELISPOT实验检测IFN-γ分泌水平结果
志愿者的PBMCs经过GM-CSF和IL-4的诱导及LPS的刺激,成为成熟的DC。荷载长肽的DC刺激PBMCs 3轮后,ELISPOT实验检测诱导能分泌IFN-γ的T细胞数量。与PBS组相比,3条长肽在志愿者中均诱导了很多可以分泌IFN-γ的T淋巴细胞(P<0.05),见图1。
3 LDH实验检测细胞毒性实验结果
为了进一步验证3条长肽特异性的CTL对靶细胞是否有杀伤,我们选择A549细胞作为靶细胞(A549细胞是属于COX-2+,HLA-0201+),进行LDH实验检测细胞毒性,结果显示,当效靶比是50∶1时,P315-338、P355-377和P375-401在志愿者中所诱导的CTL对靶细胞A549的杀伤率分别为31.3%、26.6%和36.6%,较PBS组显著升高(P<0.05),见图2。

表1 COX-2抗原HLA-A2限制性CTL表位的预测结果
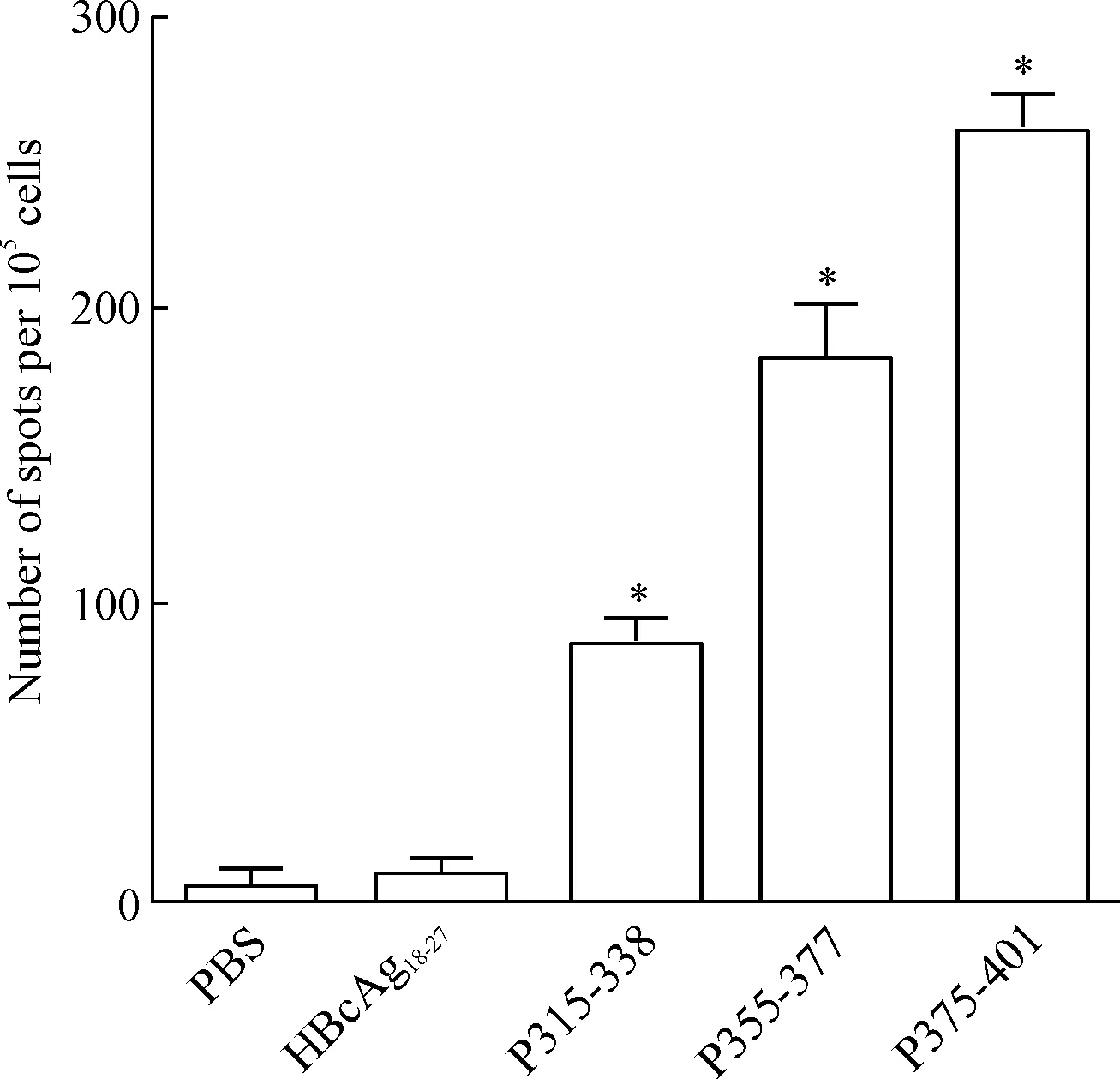
Figure 1.ELISPOT assay was used to measure IFN-γ release by CTLs induced by DC from PBMCs of healthy donors. Mean±SD. n=3. *P<0.05 vs PBS group.
4 CFSE荧光染色检测细胞毒性的实验结果
候选肽所诱导产生的CTL,随着效靶比的提高杀伤效果相应提高。根据LDH实验检测细胞毒性实验结果,我们将效果较好的P315-338和P375-401进一步用于CFSE荧光染色检测细胞毒性实验。这2条候选肽诱导得到的CTL在效靶比为50∶1时对靶细胞的杀伤率较阴性对照组(PBS组)和无关肽(HBcAg18-27)组HBC显著升高(P<0.05),见图3。
5 胞内因子染色法检测长肽体外免疫刺激后IFN-γ的分泌水平
从HLA-A2+健康供者得到的PBMCs,经诱导刺激而成为成熟的DC,荷载长肽的DC刺激PBMCs 3轮后,并且体外培养18 d后获得特异性的CTL,用胞内因子染色法检测长肽体外免疫刺激后IFN-γ分泌水平。P315-338和P375-401长肽疫苗诱导的CTL可以分泌较多的IFN-γ (P<0.05),见图4。
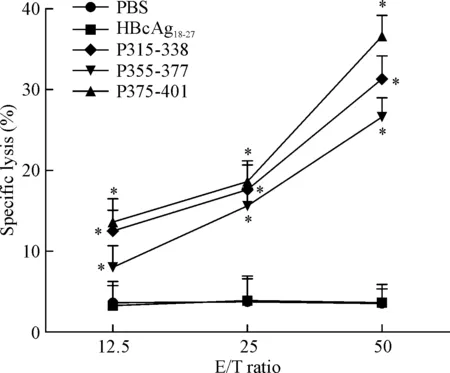
Figure 2.Specific lysis of A549 cells by the synthetic long peptide-induced CTLs. The effector/target (E/T) ratios were 12.5∶1, 25∶1 and 50∶1. The levels of LDH release were detected. CTLs induced by PBS and irrelevant peptide HBcAg18-27 were used as negative control. Mean±SD. n=3. *P<0.05 vs PBS group.
讨 论
肺癌是严重威胁人类健康和生命的疾病。因吸烟和环境因素的影响,肺癌的发病率和病死率呈上升趋势。肺癌发病率逐年上升,全世界每年新确诊肺癌患者约160万,其病死率在恶性肿瘤引起的死亡中居首位。肺癌是发达国家男性癌症死亡的最常见原因,也是女性的主要原因之一[15]。肿瘤免疫治疗是通过增强患者机体抵抗力和对肿瘤的免疫反应以达到遏制肿瘤的治疗方法[16],其中以anti-PD1抗体和嵌合抗原受体T细胞(chimeric antigen receptorT-cell,CAR-T)疗法较常见。目前,美国FDA已批准PD-1可用于恶性黑色素瘤和肺鳞癌的临床治疗。免疫治疗在恶性肿瘤治疗领域有广阔前景。目前,免疫治疗已广泛应用于肺癌治疗[17]。
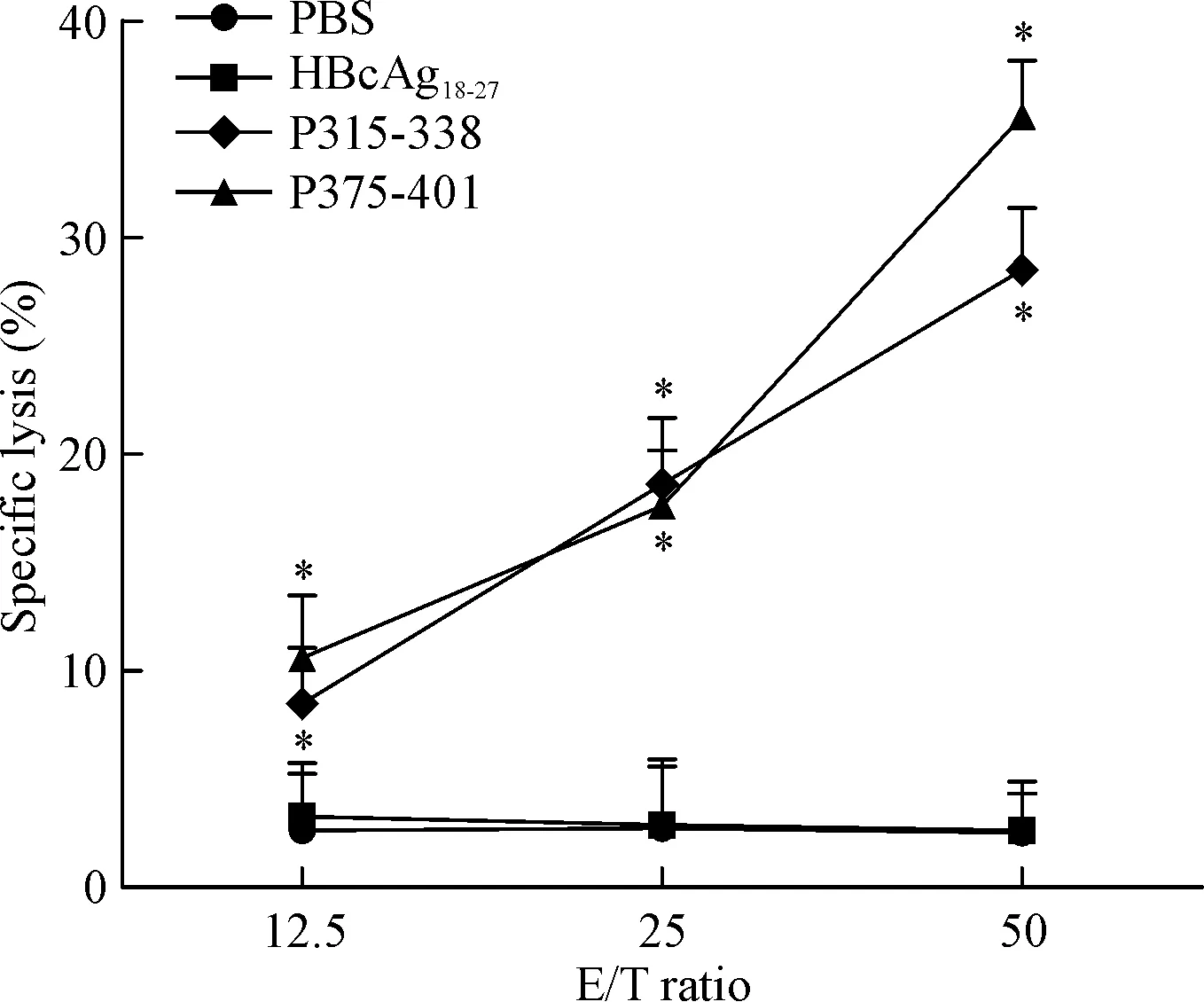
Figure 3.Specific lysis of target cells by the CTLs generated from the PBMCs of healthy donor. Detection of antigen-specific cytotoxicity by CFSE assay was perdormed. The effector/target (E/T) ratios were 12.5∶1, 25∶1 and 50∶1. CTLs induced by PBS and irrelevant peptide HBcAg18-27 were used as negative control. Mean±SD. n=3. *P<0.05 vs PBS group.

Figure 4.In long peptide-pulsed DC assay, IFN-γ release was measured by intracellular cytokine staining assay.The long peptide-pulsed DC was used to induce CTLs from the peripheral blood mononuclear cells of HLA-A*02 healthy volunteers. The CTLs were then stained with IFN-γ and CD8 antibodies. The number in the figure represented the percentage of IFN-γ positive cells among CD8+ T cells. Mean±SD. n=3. *P<0.05 vs PBS group.
随着多肽疫苗的应用[18-19],多肽疫苗在原有诱导CTL能力的基础上也有新的进展。这些进展多表现在增强多肽疫苗抗肿瘤效应的策略方面,如提高CTL表位的免疫原性,与T辅助表位的联用,增加多肽的长度,克服HLA分子限制性等[20-21]。杜宇琛等[22]研究发现,使用含CpG序列的寡脱氧核糖核苷酸(CpG oligodeoxynucleotide,CpG-ODN)刺激成熟的 DC 与 Lewis 肺癌细胞系(LLC-1)融合的 DC 疫苗,在体内能产生高效、持久的抗肺癌免疫反应,而肺癌细胞系与成熟的 DC共培养却不能产生有效的免疫应答。有学者用树突状细胞与IL-18基因修饰的 NCI-H460肺癌细胞融合体进行抗肿瘤研究,发现融合细胞能有效激活宿主抗肿瘤的免疫反应;小鼠体内实验表明,融合细胞能有效减慢荷瘤小鼠的肿瘤生长速度。由此表明,DC 融合疫苗接种有望成为疫苗免疫治疗的新策略。
本实验结果可见P315-338和P375-401有很好的分泌IFN-γ的能力及杀伤靶细胞的能力。DC荷肽组实验,将诱导成熟的DC荷载上长肽可刺激PBMCs。长肽在经过专职抗原提呈细胞加工处理后,其诱导的T细胞分泌IFN-γ的能力会提高[23]。长肽由于它的长度不能直接结合在抗原结合槽上,必须被抗原提呈细胞吞噬、加工。专职抗原提呈细胞对抗原加工处理的效果比较明显[24]。目前也有一些负载多肽的DC作为疫苗进行研究的,而DC激动剂等方面的试剂作为肿瘤的辅助治疗也有应用[25]。依据软件预测设计的长肽,虽然不是每一条都可以引起较好的免疫反应,但我们仍然筛选出了效果较好的肽,所以长肽可以作为一种很好的多肽疫苗[26],我们虽然证明长肽最终诱导了很好的特异性的T细胞,但并没有指出长肽被加工成了哪些肽段,有没有加工成与MHCⅡ分子结合的CD4+Th表位。这些问题应该是下一步需要我们去研究解决的。

