白羽肉鸡胸腿肉的氧化对食用品质和钙蛋白酶活性的影响
邓凯波,黄雅萍,许正金,傅灵韵,郑宝东,*
(1.福建农林大学食品科学学院,福建 福州 350002;2.中国爱尔兰国际合作食品物质学与结构设计研究中心,福建 福州 350002;3.福建省特种淀粉品质科学与加工技术重点实验室,福建 福州 350002;4.福建正大食品有限公司,福建 龙岩 364000)
白羽肉鸡是我国肉鸡产品的重要组成部分,也是肉鸡屠宰加工企业的主要原料。因其具有高蛋白、低胆固醇、低脂肪和低热量等特点,已成为世界各地消费者普遍接受的优质动物蛋白质来源。但在规模化屠宰加工过程中,白羽肉鸡的保水性和质构特性(弹性、咀嚼性、凝聚性等)相比其他肉类还有待提高[1],这制约着我国白羽肉鸡产业的发展[2]。目前已有研究表明,猪、牛等大型动物的肌肉汁液损失与氧化应激有关[3],但氧化应激在禽肉中研究较少。
在肉类加工和贮存过程中,温度、光、射线、氧等外界环境均会导致肌肉发生氧化,主要引起水、蛋白质和脂质等宏量营养素的水平变化[4-5]。研究表明,持水性与宰后肌肉蛋白质的降解有关[6],而蛋白质氧化是发生在脂类氧化之后的第二阶段反应[7],主要为活性氧物质(如羟自由基、肌红蛋白自由基或脂类次级氧化产物等)引起的如肽键断裂、侧链修饰、蛋白质分子间共价交联(如二硫键)以及组氨酸(His)残基转变等一系列蛋白质结构变化[8],从而导致包括骨架蛋白、抗萎缩蛋白和整合蛋白等的肌肉蛋白质降解,造成蛋白纤维网络结构破坏,形成水分转移通道,导致汁液流失、肌肉嫩度变差[9-10],并进一步影响肌肉中脂类及相关活性酶的水平。而肌肉中的不易流动水则会在肌肉僵直和成熟过程中,随着肌肉结构和pH值的变化而变化,这也是汁液损失的主要原因[11]。
由于肌肉持水性能与嫩度密切相关[12]。作为参与肉质嫩化的主要酶系,钙蛋白酶I(μ-calpain)和钙蛋白酶II(m-calpain)表达量的上调会使肌肉蛋白发生水解导致肉质嫩度增加,表明钙蛋白酶的水解作用是导致肉质嫩化的主要因素。因此钙蛋白酶在肌肉中的浓度是肉类嫩度的一个重要预测指标[13]。而在氧化应激条件下,肌肉纤维蛋白及活性酶均发生不同程度的氧化变性和活性下降。现有蛋白质氧化应激方面的研究主要集中在猪和牛等大型哺乳类动物[14-15],家禽方面报道较少。因此,研究白羽肉鸡的持水性影响因素对于研究禽类肌肉汁液损失的控制手段和提高我国白羽肉鸡企业市场竞争力具有重要意义。
本研究从高、低两个氧化水平出发,探讨氧化对白羽肉鸡不同部位肌肉持水性能的影响,及其对肌肉蛋白质和脂类营养素氧化程度的作用;并研究氧化条件下肌肉钙蛋白酶水平变化及与持水能力的相关性,以期为解决白羽肉鸡产业中氧化控制问题提供理论支持,并为企业降低经济损失和提高产品价值提供参考。
1 材料与方法
1.1 材料与试剂
饲养管理相同的6 周龄或体质量2.0~2.5 kg的AA白羽肉鸡6 只 福建正大食品有限公司;三羟甲基氨基甲烷盐-酸盐(tris(hydroxymethyl)aminomethane-HCl,Tris-HCl)、乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)、乙酸、β-巯基乙醇、KCl、CaCl2和酪蛋白等试剂均为国产分析纯。
1.2 仪器与设备
5804R高速冷冻离心机 德国Eppendorf公司;BT125D电子分析天平、pH计 德国Sartorius公司;DHG-9075A数显电热恒温鼓风干燥器、HWS-26水浴锅上海一恒科技有限公司;HG04-TP101型食品中心温度计北京北信未来电子仪器有限公司;JY92-II型超声细胞破碎仪 宁波新芝生物工程有限公司;UV-2601型紫外-可见分光光度计 北京瑞利分析仪器公司;DS-1型组织捣碎机 上海标本模型厂。
1.3 方法
1.3.1 原料预处理
以白羽肉鸡胸肉和腿肉为研究对象,在宰后24 h内分离、单独冷冻并分装,于-20 ℃冷库中存放。使用时,随机选取分装样品并置于4 ℃中至自然解冻后,分别割取中心部位质量约为100 g肉块进行后续实验。
1.3.2 样品氧化处理
参考刘泽龙[16]关于肉氧化处理的方法,并做适当改动。取上述肌肉样品12 块,用纸巾吸干表面水分后,每4 块为一组,分别置于3 组不同水平的Fenton氧化体系(FeCl3/抗坏血酸/H2O2)中,模拟肌肉氧化,溶液成分如下:
低氧化水平体系:15 mmol/L哌嗪-1,4-二乙磺酸(piperazine-1,4-bisethanesulfonic acid,PIPES)缓冲液,1、5、10、20 mmol/L H2O2,0.1 mmol/L抗坏血酸,0.01 mmol/L FeCl3,0.1 mol/L NaCl,pH 6.2,氧化时间为1 h。
高氧化水平体系:15 mmol/L PIPES缓冲液,20、30、40、50 mmol/L H2O2,0.1 mmol/L抗坏血酸,0.01 mmol/L FeCl3,0.1 mol/L NaCl,pH 6.2,氧化时间为5 min。
空白对照:15 mmol/L PIPES缓冲液,0.1 mol/L NaCl,pH 6.2,氧化时间为1 h和5 min。
氧化反应的终止:在体系中加入终浓度为1 mmol/L的EDTA终止氧化,反应时间5 min。氧化反应终止后立即将样品取出,静置沥水5 min后,立即进行后续指标测定。
1.3.3 肌肉持水力的测定
随机取样(精确记质量m0/g)置于底部垫有纱布的50 mL离心管中,在2 000×g、4 ℃下离心20 min后记质量(m1/g),之后将离心后的样品置于烘箱中,在105 ℃下干燥至质量恒定,测定除去水分后的肌肉质量(m2/g)。持水力由公式(1)计算。
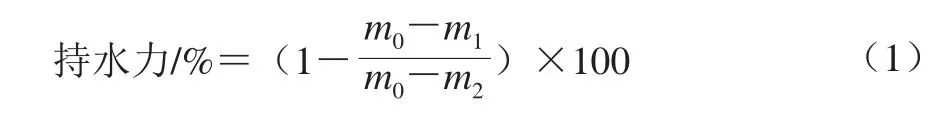
1.3.4 蒸煮损失率的测定
随机取一定质量(m1/g)肌肉样品置于80 ℃恒温水浴中加热,当样品中心温度达60 ℃立即取出,流水冷却至室温,吸干样品表面汁液后称质量(m2/g)。每次测定3 个重复。蒸煮损失率计算见公式(2)。

1.3.5 产品得率的测定
方法同1.3.4节测定蒸煮损失率,产品得率计算见公式(3)。
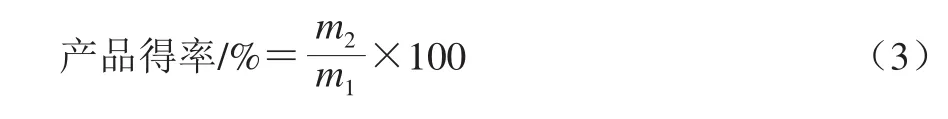
1.3.6 蛋白质氧化水平的测定
因氧化后的肌肉蛋白会因氧化型自由基的攻击而发生羰基化现象,故蛋白质羰基化可作为衡量氧化程度的指标之一,因此采用2,4-二硝基苯肼(2,4-dinitrophenyl hydrazine,DNPH)法测定[17]。样品蛋白质含量采用Bradford法测定[18]。
1.3.7 脂质过氧化水平的测定
参照孟少华等[19]所述方法:将10 g氧化后待测样品和对照样分别研细,加50 mL含0.1 g/100 mL EDTA的体积分数7.5%三氯乙酸溶液,振摇30 min后双层滤纸过滤2 次。取5 mL滤液,加入5 mL 0.02 mol/L的1,2-硫代巴比妥酸(thiobarbituric acid,TBA)溶液,沸水浴中保温40 min,取出冷却1 h后,以1 600 r/min离心5 min,取上清液加5 mL氯仿摇匀,静置分层后吸取上清液,分别在532 nm和600 nm波长处测定吸光度,用公式(4)计算硫代巴比妥酸反应产物(thiobarbituric acid reactive substances,TBARS)值,单位以每千克肉中丙二醛(malondialdehyde,MDA)的质量来表示。
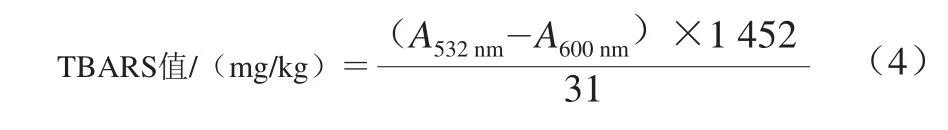
1.3.8 钙蛋白酶活力的测定
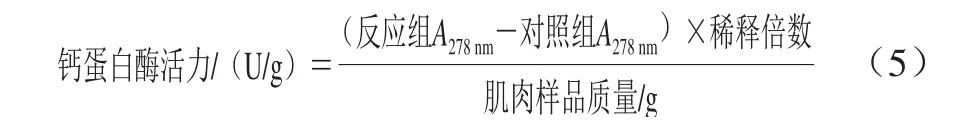
白羽肉鸡胸肉的钙蛋白酶粗酶液的提取和活力测定参照谢婷[20]所述方法进行,其中钙蛋白酶的活力以每克肌肉样品中的酶活力来表示,即在25 ℃下水解酪蛋白1 h可使278 nm波长处吸光度增加1.0所需的酶量,用公式(5)计算钙蛋白酶活力。
1.4 数据统计分析
每项指标均进行3 次重复测定,并设置相应的对照组。采用Microsoft Office Excel 2007和Origin 9.2软件进行数据处理和单因素方差分析,以P<0.05表示差异显著。
2 结果与分析
2.1 氧化对鸡肉持水力水平的影响
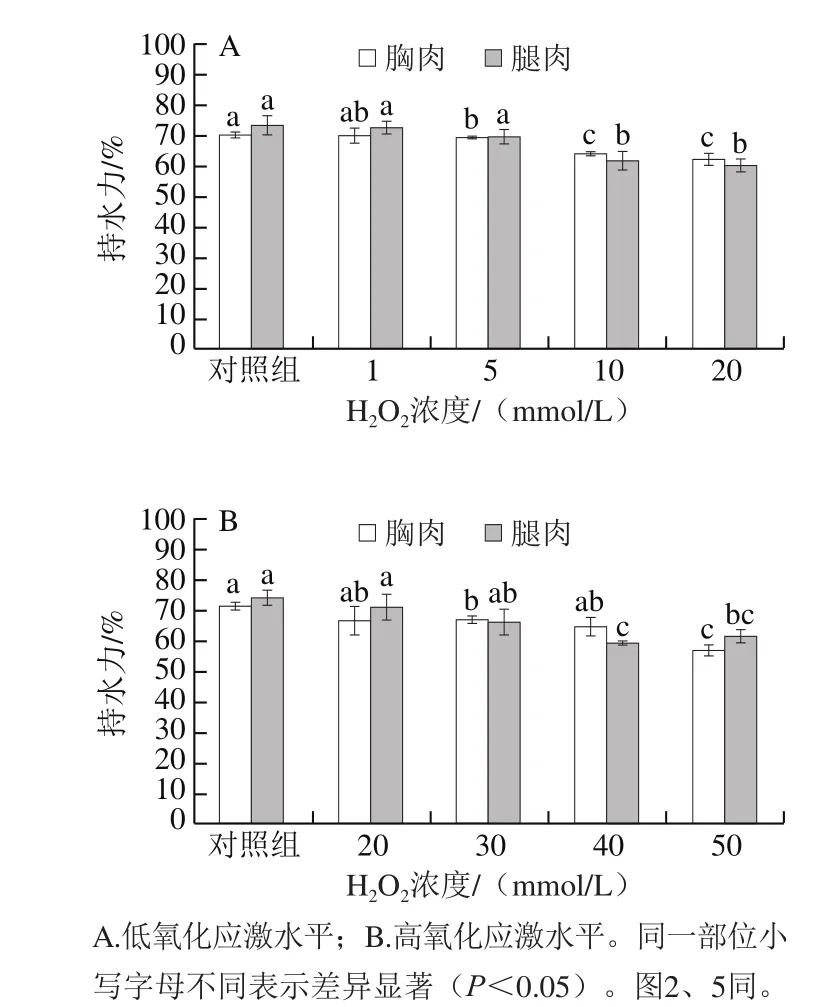
图1 氧化应激对鸡胸肉和腿肉持水力水平的影响Fig.1 Effect of oxidation treatment on water-holding capacity of broiler breast and drumstick meat
由图1可知,与对照组相比,胸肉和腿肉的处理组持水力均有不同程度降低。10 mmol/L和20 mmol/L H2O2处理1 h,以及50 mmol/L H2O2处理5 min后,持水力均显著下降(P<0.05),且两组氧化浓度处理的持水力变化趋势相似。说明氧化使肌肉组织内部原本稳定其水分的能力遭到破坏,这可能与肌原纤维蛋白质结构发生变化有关。
肌肉中大部分水分存在于肌原纤维及肌球蛋白粗纤丝和肌动蛋白/原肌球蛋白细纤丝之间的间隙中,肌原纤维间隙中的水分构成了汁液流失的主要组成部分[21]。氧化可造成肌原纤维蛋白质表面的疏水性残基暴露,使蛋白质结构发生变化、蛋白交联程度发生改变,从而导致肌纤维之间间距的改变,造成肌原纤维间的空间内原有水分的流失[22-23]。
2.2 氧化对鸡肉蒸煮损失率和产品得率的影响

图2 氧化应激条件对鸡胸肉和腿肉蒸煮损失和产品得率的影响Fig.2 Effect of oxidation treatment on cooking loss and yield of broiler breast and drumstick meat
由图2可知,随着H2O2浓度的升高,各处理组蒸煮损失率逐渐增大,产品得率逐渐降低,这同样与氧化造成的肌原纤维蛋白质变化有关[23]。
此外,与腿肉结果相比,胸肉蒸煮损失率较小,说明水浴加热后胸部肌肉组织的内部水分含量更高,这可使其嫩度更高、口感更好,各处理组的胸肉得率也远高于相同条件下的腿肉得率。这是由于两个部位肌肉在来源、肌纤维类型和蛋白组成等方面存在差异[24],其中胸部肌肉蛋白质凝胶能力更强,受热前较长的肌纤维形成的网络结构使其聚集能力更强[25];因此具有更好的受热保水能力,嫩度更高。这也与消费者对于胸肉相对较嫩、腿肉相对较柴的习惯感官经验相一致。
2.3 氧化对肌肉蛋白羰基水平的影响
蛋白羰基水平是蛋白氧化的标志之一。由图3可知,H2O2浓度与蛋白羰基浓度呈显著正相关关系,即随着氧化程度的加深,肌肉蛋白质羰基化程度越高。但与低浓度H2O2长时氧化处理相比,高浓度H2O2短时氧化处理对肌肉蛋白羰基浓度的影响更为显著(P<0.05)。说明在此条件下,H2O2浓度对蛋白羰基生成速率的影响更加显著。同时,将鸡胸肉用20 mmol/L H2O2分别氧化处理5 min和60 min,蛋白羰基浓度分别为0.85 nmol/g和1.24 nmol/g。说明在此H2O2浓度下,延长氧化时间会提高样品中蛋白羰基含量。而在同一氧化水平下,鸡胸肉和腿肉的蛋白羰基水平基本相同,无显著差异(P>0.05)。
肉鸡在屠宰、加工和贮存期间,肌原纤维蛋白易受氧化,特别是蛋白质氧化和脂类氧化,从而引起氨基酸被破坏、肽键断裂、蛋白交联等,并会生成蛋白-脂类氧化产物等复合物[26],这会直接影响到肌肉持水性能,影响肉鸡食用品质和经济效益[16]。已有研究证明,总蛋白羰基水平与牛肉的剪切力显著相关[27]。本研究也发现,白羽肉鸡胸腿肉的蒸煮损失率与蛋白羰基水平均随H2O2浓度升高而增加。蛋白氧化可降低牛肉的嫩度,但蛋白羰基水平与白羽鸡肉嫩度之间的确切机制尚不明确[26]。
2.4 氧化对脂质过氧化水平的影响
不同氧化处理对白羽肉鸡胸肉和腿肉的脂类氧化情况如图4所示。在相同氧化条件下,白羽肉鸡的胸肉和腿肉脂质过氧化水平无显著差异(P>0.05),而TBARS值随H2O2浓度升高而增加,各处理组的TBARS值与对照组相比均有显著升高(P<0.05)。这是由于肉类在氧化过程中产生的活性氧簇可以与肌细胞中的多不饱和脂肪酸和核酸等大分子物质发生脂质过氧化反应,形成如MDA的脂质过氧化产物,故本研究中不同的H2O2浓度使肌肉的脂质过氧化程度产生差异。
但在不同氧化时间的处理组(1 h和5 min)中,与高浓度H2O2短时氧化处理相比,低浓度H2O2长时氧化处理对肌肉的影响更为显著(P<0.05)。前者的TBARS值明显随H2O2浓度的增加而上升(P<0.05);而后者生成的TBARS值较前者有所下降但仍与H2O2的浓度呈正相关。由于醛类等脂质过氧化产物是蛋白羰基化反应的底物之一[28],所以高浓度氧化处理可能导致其因底物消耗而导致MDA的正向合成速度加快;同时也与高H2O2浓度条件下蛋白羰基水平较高的结果相一致(图3B)。此外,鸡胸肉经20 mmol/L H2O2氧化处理5 min后的TBARS值为0.53 mg/kg,而氧化处理1 h后的TBARS值升至1.14 mg/kg,可见在该时间范围内,氧化时间越长,脂质过氧化程度越深。
2.5 氧化对肌肉钙蛋白酶活力的影响
钙蛋白酶是影响白羽肉鸡肌肉品质的特征性酶系,直接关系到持水性能和嫩度等指标。有研究表明,宰后鸡胸、腿肉的总钙蛋白酶水平无显著差异[29],且胸肉因其更稳定的凝胶特性[25],为研究食用品质的特征性部位之一,故采用胸肉进行钙蛋白酶的氧化研究。
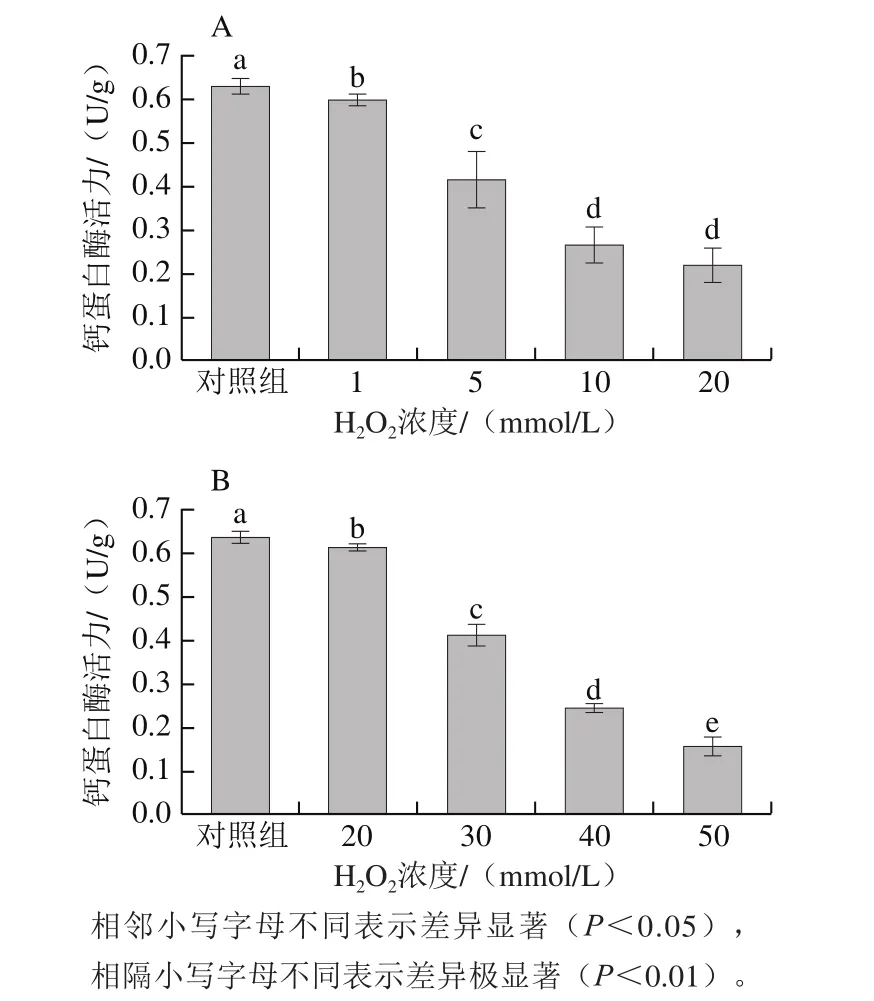
图5 不同氧化处理对肌肉钙蛋白酶活力的影响Fig.5 Effect of oxidation treatment on calpain activity of broiler breast and drumstick meat
不同氧化条件对鸡胸肉钙蛋白酶活性影响如图5所示。经过两种不同浓度的氧化处理,发现在氧化体系中钙蛋白酶活力均随H2O2浓度升高而逐渐降低。所有氧化浓度的钙蛋白酶活力均与对照组具有显著差异(P<0.05),且相隔处理组的酶活力均具有极显著差异(P<0.01),说明活性氧对钙蛋白酶活力具有非常大的影响。且相同H2O2浓度(20 mmol/L)下,钙蛋白酶活力也随氧化时间延长而显著降低。
肉类屠宰后成熟阶段,钙蛋白酶被激活,降解细胞骨架蛋白,肌纤维收缩时产生的交联及肌原纤维之间的交联断裂,使胞内重新获得水分贮存的弹性空间,持水力提高。Huff-Lonergan等[30]指出,猪肉的氧化会抑制钙蛋白酶的活力。这与鸡胸肉处理组较对照组的钙蛋白酶活力显著降低的结果相一致(P<0.05)。其原因可能是因为钙蛋白酶的活性位点含有His和Cys残基,易因自由基的供给而活性降低甚至失活[9]。研究发现,钙蛋白酶可造成肌原纤维蛋白质发生降解,将导致组织完整性丧失,嫩度提高[20,31]。而在氧化环境中,肌原纤维的皱缩作用直接导致外层连接的细胞膜同时收缩,从而使间隙中的水分因无法贮存而流失,这与本研究中氧化对持水性能研究结果相对应,推测白羽肉鸡中钙蛋白酶的酶活力水平与白羽肉鸡肉质改变的关系密切。
3 结 论
本实验通过对不同氧化应激水平下白羽肉鸡胸腿肉的持水性能、蛋白质和脂质氧化程度等食用品质及钙蛋白酶活力变化进行了研究与分析,得到以下结论:氧化可造成肉鸡胸肉和腿肉持水力下降,蒸煮损失率增加,产品得率降低,且随着H2O2浓度升高,胸腿肉的持水性能显著下降(P<0.05)。其中,与胸肉相比,腿肉的蒸煮损失率和产品得率受氧化应激的影响更大,主要可能是由胸肉和腿肉的蛋白凝胶结构差异所致。同时,氧化还导致肌肉蛋白质和脂质等营养素发生明显过氧化现象,H2O2高浓度短时处理比低浓度长时处理对肌肉蛋白羰基水平的影响更为显著,而对TBARS值影响恰好相反。但相同条件下,胸肉与腿肉之间结果差异并不显著(P>0.05)。氧化对肌肉钙蛋白酶活力具有非常大的影响,其酶活力水平随H2O2浓度升高而逐渐降低,从而推测钙蛋白酶活力水平与白羽鸡肉肉质改变的关系密切。这说明在白羽肉鸡的加工、贮藏中要避免其受到氧化影响,加强氧化抑制机制的研究。目前,在对氧化与肌肉持水能力的研究中,主要集中在肌原纤维蛋白功能变化和蛋白水解酶活力(如钙蛋白酶等)等方面,其他影响因素还有待深入研究。

