免疫补体调节蛋白C1抑制物对巨噬细胞极化的作用①
吴世舜 余文博 刘梦元 张海谋 熊 君 刘东旭
(湖北大学生命科学学院,武汉 430062)
在体内,炎症引起组织损伤可迅速导致损伤区巨噬细胞数量增加,在很大程度上,主要依赖于单核-巨噬细胞系的极化,这种变化主要是由于血中单核细胞浸润,成为静息巨噬细胞。这些静息巨噬细胞在细胞因子的作用下,转变为不同型的极化巨噬细胞[1]。在体外,巨噬细胞集落刺激因子(CSF)或粒细胞-巨噬细胞集落刺激因子(GM-CSF)均可促使单核细胞分化为静息巨噬细胞,而干扰素-γ(IFN-γ)和白细胞介素4(IL-4)+IL-13可诱导静息巨噬细胞分别转化为经典活化的巨噬细胞(M1)和替代激活的巨噬细胞(M2)[2,3]。巨噬细胞呈现明显的差异性极化能力,可随具有不同功能表型之间动态变化而相互转换[4]。人巨噬细胞表型的表达CD14、CD163、CD206是区分M1和M2的重要标记物[5],也是巨噬细胞呈现明显极化能力的标志。M1产生大量的具有促炎性特性的细胞因子如肿瘤坏死因子-α(TNF-α)、IL-6和趋化因子(C-C motif)配体17(CCL17)及相关的酶如诱导型一氧化氮合酶(iNOS)。而M2则产生大量的具有抗炎作用物质如15脂氧合酶(ALOX15)、IL-10和CCL18和精氨酸酶1(Arg1)[4,6,7]。
补体调节蛋白C1抑制剂(C1INH)是补体系统中经典途径唯一蛋白酶抑制剂,C1INH 存在于人体血浆中。巨噬细胞也是参与执行补体系统中途径效应功能的关键因素。补体系统的成分对巨噬细胞极化起调节作用。已有研究表明,补体蛋白C1q可以直接巨噬细胞极化[8]。补体成分C1q、C3b和C5a与巨噬细胞上的受体相互作用,导致炎症反应和细胞因子的产生。C3a、C5a和C5b-9调节巨噬细胞趋向炎性M1表型,促炎细胞因子的释放,而C3b、C1q调节巨噬细胞趋向抗炎性M2表型,抗炎细胞因子的产生,这些变化可能与细胞信号传导作用有关[9]。既往研究已经证实:C1INH具有抗炎的新功能,抑制巨噬细胞激活和炎性细胞因子释放[10-12]。
本研究将分析C1INH对极化的巨噬细胞表型标志物CD14、CD163和CD206作用,研究C1INH对极化巨噬细胞产生促炎因子和抗炎因子的作用,同时,探索C1INH对极化巨噬细胞杀菌活性和吞噬功能的作用。进一步分析C1INH对CD14结合Toll样受体4(TLR4)的影响。从而阐明C1INH对巨噬细胞极化的调节作用。
1 材料与方法
1.1实验材料、试剂 Ficoll PaqueTMPLUS单核细胞分离液购自immunbioTM;M-CSF、GM-CSF、IFN-γ,IL-4,IL-13购自R&D;C1INH购自Berinert,ZLB Behring;Anti-CD14、anti-CD163,anti-CD206抗体,R&D;磷酸化的RAF-1、MEK-1和p42/p44ERK抗体购自NEB;RNA Mini Kit和PCR Kit购自Qiagen;96孔平底板购自BD Biosciences;免疫反应-增强化学发光检测系统检测购自Pierce Biotechnology;pHrodoTMGreen E.coli BioParticlesTMConjugate和LPS购自ThermoFisher。
1.2实验方法
1.2.1细胞分离和诱导 健康成人外周血液样本的研究得到湖北大学生命科学学院审查委员会的批准,所有捐助者都知情同意。应用17-1140-02 Ficoll PaqueTMPLUS 单核细胞分离液分离人外周血单个核细胞,分离所得的细胞中95%±5%为单核细胞,分离所得的细胞存活细胞率>90%。细胞培养浓度在1×106个细胞/ml,细胞在完全培养基含10%胎牛血清,100 U/ml青霉素/链霉素,加入50 ng/ml M-CSF或50 ng/ml GM-CSF,培养3 d后,再添加到含有生长因子的新鲜培养基中。培养7 d后,细胞用1×PBS含Ca2+和Mg2+和新鲜的完全RPMI洗2次,再加入完全培养基含有100 ng/ml IFN-γ(M2)或10 ng/ml IL-4+10 ng/ml IL-13(M2),培养48 h。在预实验中,设立C1INH浓度为0、50、100、150、200 μg/ml,同时也设立C1INH作用时间0、12 h、24 h、48 h。因此,最后选定C1INH终浓度和作用时间为150 μg/ml和48 h。在上述实验组中,加入150 μg/ml C1INH、24 h作用时间,设立阴性对照组。通过检测和鉴定,M-CSF或GM-CSF诱导的巨噬细胞的纯度分别为95%和96%。
1.2.2流式细胞仪检测 在培养的细胞加入抗体(CD14、CD163,CD206)进行孵育,洗涤后再进入二抗。细胞用PBS含Ca2+和Mg2+和新鲜的完全培养基洗2次,细胞固定后,进行流式细胞仪检测(BD),应用CellQuest软件分析结果。
1.2.3RT-PCR 从细胞中提取总RNA,并通过测量其在260 nm处的吸光度来定量测定总RNA的浓度,PCR Kit进行qPCR分析,GAPDH作为内部对照引物,具体操作过程按试剂说明书要求。反应体系在95℃预变性30 s,40循环扩增反应(95℃ 5 s,60℃ 34 s),熔解曲线分析,结果与内参作对比。
1.2.4细胞杀菌试验 按以前方法操作[11]。简而言之,3×104细胞/孔接种于纤连蛋白涂覆的96孔平底板培养2 d。大肠杆菌生长对数中期(OD600=0.5)的RPMI1640培养基含有10 nmol/L HEPES,细胞数与等量的大肠杆菌数目在37℃下共培养,并加入150 μg/ml C1INH,设立对照组。用冰冷的水和涡旋裂解细胞。在37℃下,将裂解物连续稀释并涂于含5% FBS的琼脂基片上,培养后计数活菌数,测定存活细菌的百分比。
1.2.5细胞对菌的吞噬试验 按说明书(生命技术)方法操作,用FITC标记大肠杆菌,进行细胞吞噬试验。FITC标记的细菌生长到对数中期(OD600=0.5)的RPMI1640培养基含有10 nmol/L HEPES。随后,细胞与等量的大肠杆菌数目在37℃下共培养,并加入150 μg/ml C1INH。细胞用PBS洗两次去除非吞噬物质,刮掉细胞,然后通过流式细胞仪检测细胞吞噬FITC标记物的情况。
1.2.6Western blot 离心分离细胞裂解液,在4℃下过夜,1 mg蛋白质用合适的抗体和蛋白A/G加琼脂糖孵育。蛋白用10%聚丙烯酰胺分离凝胶电泳分离,然后转移到硝酸纤维素膜上。膜上蛋白质与相应抗体(磷酸化的RAF-1、MEK-1和p42/p44ERK抗体)结合,洗涤后,加入辣根过氧化物酶抗体。免疫复合物通过增强化学发光检测系统检测。

2 结果
2.1C1INH对M1和M2极化表型的作用 CD14是M1的表面标记物,CD163是M-CSF源性巨噬细胞分化表面标记物,CD206是IL-4诱导的M2表面标记物[5,13,14]。在静态状态下,C1INH抑制M-CSF源性巨噬细胞的CD14、CD163和GM-CSF源性巨噬细胞的CD206表面标记物的表达(图1)。在极化状态下,C1INH抑制M1的CD14、CD163和M2的CD206表面标记物的表达(图2)。结果提示:C1INH对巨噬细胞极化表面标志物具有调节作用。
2.2C1INH对M1和M2的标记基因表达的影响 IFN-γ或IL-13诱导巨噬细胞极化不同的基因表达趋化因子和细胞因子是有差异的[5]。我们发现C1INH抑制M1的TNF-α和IL-6表达,而增加M2的15-脂氧合酶和IL-10表达(图3A~D)。C1INH抑制M1 iNOSmRNA和提高M2 Arg1 mRNA表达(图3E、F)。 结果提示:C1INH具有调节M1和M2的标记基因趋化因子和细胞因子分泌及相关酶表达。
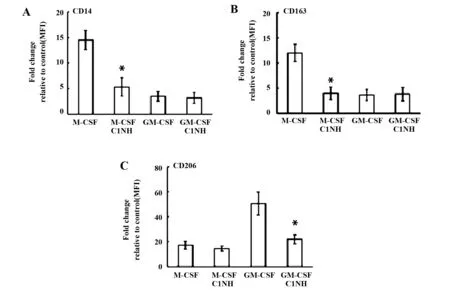
图1 C1INH对静息巨噬细胞(CD14、CD163和CD206)表型的影响Fig.1 Effect of C1INH on phenotype(CD14,CD163 and CD206)of resting macrophagesNote: FITC-conjugated antibodies for CD14 (A),CD163 (B),and CD206 (C) were used.Flow cytometric measurement of surface marker expression depicted as fold change of mean fluorescence intensity (MFI) relative to the control in box plots for macrophages (n=6).*.P<0.05.
2.3C1INH提高极化巨噬细胞杀菌活性和对菌的吞噬功能 M1具有很高的杀菌活性[4,6,7],而M2显示吞噬功能比M1更大[15,16]。在实验中重点研究C1INH对M1的杀菌活性和M2的吞噬功能的作用。实验中发现:在巨噬细胞对菌杀灭功能中,C1INH明显的增强M1的杀菌活性功能(图4A)。在分析巨噬细胞对菌的吞噬功能中,C1INH明显的增加M2对菌吞噬功能(图4B)。
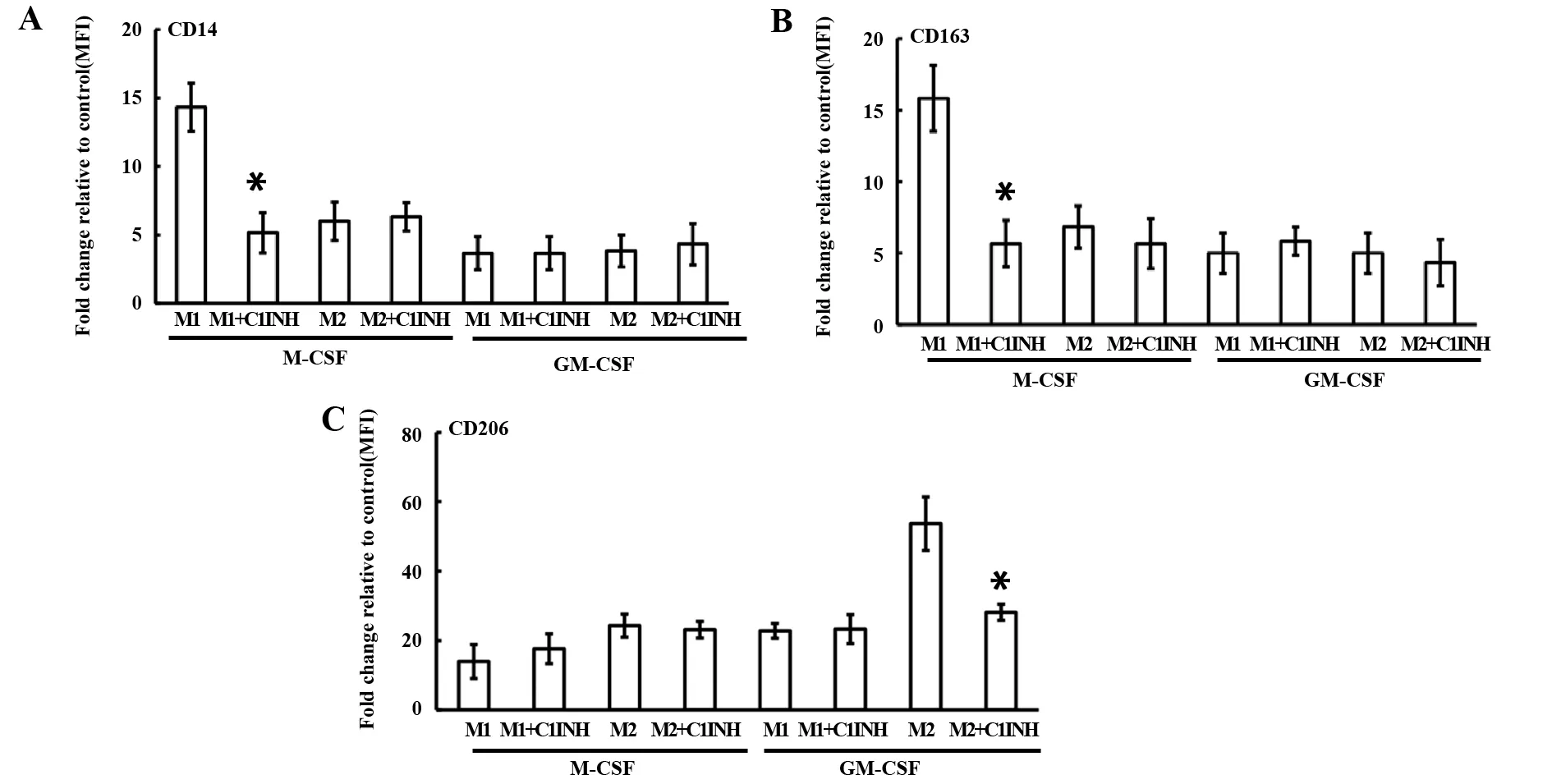
图2 C1INH对极化的M1和M2(CD14、CD163和CD206)表型的影响Fig.2 C1INH regulates phenotype(CD14,CD163 and CD206)of M1 and M2 polarizationNote: FITC-conjugated antibodies for CD14 (A),CD163 (B),and CD206 (C) were used.Flow cytometric measurement of surface marker expression depicted as fold change of mean fluorescence intensity (MFI) relative to the control in box plots for M1 (n=6) and M2 (n=6).*.P<0.05.

图3 C1INH对M1和M2标记基因表达的影响Fig.3 Effect of C1INH on expression of marker genes in M1 and M2Note: TNF-α(A),IL-6(B),ALOX15(C),IL-10(D),iNOS(E),and ARG1(F) were shown.Data are expressed as fold differences of polarized M1 (n=6) and M2 (n=6) with C1INH(n=6).*.P<0.05.

图4 C1INH提高极化巨噬细胞的杀菌活性功能和对菌的吞噬功能Fig.4 C1INH improves bactericidal activity and phagocytosis of polarized macrophagesNote: A.Viable bacteria from M1 and M2 were detected and counted,and the percentage of surviving bacteria was determined;B.Phagocytosis tests were performed in M1 and M2 using FITC-labeled beads and then analyzed for the uptake of FITC-coupled beads by FACS.Data are expressed as fold differences of polarized M1 (n=6) and M2 (n=6) with C1INH (n=6),*.P<0.05.

图5 C1INH抑制极化巨噬细胞的CD14-TLR4信号转导Fig.5 C1INH inhibits CD14-TLR4 signal transduction in polarized macrophagesNote: Phosphorylation of RAF-1,MEK,p42/p44 ERK were assessed immunoblotting and an internal control.Representative immuno-blotting is shown for three experiments.
2.4C1INH抑制极化巨噬细胞CD14-TLR4介导的信号转导 CD14参与LPS诱导的TLR4信号通路,导致胞内Raf-1/MEK/ERK激活[17,18]。实验中发现:通过Western blot证实C1INH抑制LPS诱导M1和M2的Raf-1/MEK/ERK (p44/42)的磷酸化的作用(图5)。结果提示:C1INH具有抑制LPS诱导CD14-TLR4介导细胞信号通路激活的作用。
3 讨论
C1INH是一个急性时相蛋白,是一种蛋白酶的抑制物,在患者致命感染性休克时,C1INH水平趋于正常的,但灭活的C1INH则增加,尤其感染性炎症区C1INH水平可增加2.5倍。在C1INH缺乏,补体系统和相应的激肽系统功能状态就受影响[19-22]。已有研究证明,C1INH可减少细胞因子对补体系统激活的作用[23]。我们以前已证实:C1INH抑制LPS诱导的巨噬细胞系RAW264.7的TNF-α mRNA表达[10],C1INH抑制血液中或腹膜液中活细菌的生长,可通过增加中性粒细胞和巨噬细胞对细菌吞噬功能和杀细菌作用[11]。
单核细胞和巨噬细胞可表达补体受体CR1(CD35)、CR3(CD11b/CD18)和CR4(CD11c/CD18)。 补体成分可与巨噬细胞多种补体受体相互作用,导致细胞因子的产生和释放,从而导致炎症反应[9]。IFN-γ诱导表型CD14的表达是M1的标记物,IL-4+IL-13诱导表型CD163的表达是M2的标记物[5]。在GM-CSF源性M2,CD206表型是增高的。CD206也可高表达在人单核细胞来源的树突状细胞上[24]。 在一些类似M2的细胞中,也可有表型CD206和CD163表达,呈现是一种抗炎表型的表达,但也能分泌一些促炎介质[25]。但在某些疾病中,如哮喘患者,其M2的表型CD163的表达就比非哮喘正常巨噬细胞的表达较少[26]。
4 结论
在本研究中,C1INH对极化巨噬细胞的调节作用表现如下:①调节极化巨噬细胞表型标志物CD14、CD163、CD206再分布;②调节极化巨噬细胞趋化因子、细胞因子分泌和相关酶表达的改变;③增强极化巨噬细胞杀菌活性和对菌吞噬功能;④抑制CD14-TLR4介导信号通路途径。因此,C1INH调节巨噬细胞极化,可能成为一种潜在的治疗炎症反应新药物。

