活性氧抑制剂NAC对人乳腺癌细胞化疗的增敏作用观察及机制初探
王 静
(湖北医药学院附属襄阳市第一人民医院肿瘤科,襄阳 441000)
乳腺癌是世界女性恶性肿瘤中最常见的疾病之一,据WHO国际癌症研究中心调查显示,2010年世界女性乳腺癌新发病例约占全部女性恶性肿瘤的23%,且每年死亡人数达50万,占所有女性死亡人数的1.8%[1]。近年来,随着女性生活压力的增加、生活节奏不断加快,乳腺癌的发病率及死亡率逐年升高,严重威胁女性的生命健康。当前,化疗法已成为乳腺癌患者的主要治疗手段之一,但是患者对化疗药物尤其是蒽环类药物的耐药性已严重影响疗效,如何增强肿瘤细胞对化疗药物的敏感性是当前亟待解决的问题[2]。研究发现[3],机体处于应激状态时可释放大量活性氧(Reactive oxygen species,ROS),可通过激活癌基因方式诱发正常细胞癌变。已有研究显示[4],ROS抑制剂N-乙酰半胱氨酸(N-acetylcysteine,NAC)可对多柔比星(Doxorubicin,Dox)治疗人胰腺癌起到增敏作用,但关于NAC对Dox治疗人乳腺癌的增敏作用鲜有研究,因此,本研究观察NAC在Dox对MCF-7细胞株化疗过程中的增敏作用,并初步探讨其调控机制。
1 材料与方法
1.1材料
1.1.1细胞系 人乳腺癌细胞株MCF-7,购于上海生科院细胞库。
1.1.2药物 活性氧抑制剂NAC,Sigma公司,CAS号:616-91-1;盐酸多柔比星注射液,辉瑞制药(无锡)有限公司,批准文号:国药准字H20013334;规格:10 mg。
1.1.3主要试剂 异硫氰酸荧光素标记的连接素(Annexin-Fluorescein isothiocyanate,Annexin-FITC)细胞凋亡检测试剂盒、二甲基噻唑试剂盒(Dimethyl-2-thiazolyl,MTT),广州碧云天有限公司;Hoechst33342 PI荧光染料,Solarbio公司;无血清细胞冻存基础培养基(RPMI1640培养基)、胎牛血清,Gibco公司;2′,7′-二氯荧光素双乙酸盐(2′,7′-Dichlorodihydrofluorescin diacetate,DCFH-DA)、二甲基亚砜(Dimethyl sulfoxide,DMSO)、Trizol,Sigma公司;ROS检测试剂盒,南京建成生物工程研究所;含半胱氨酸的天冬氨酸蛋白水解酶(Cysteinyl aspartate specific proteinase-3,Caspase-3)、B淋巴细胞瘤-2基因(B-cell lymphoma-2,Bcl-2)、Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)兔抗人多克隆抗体(一抗)、Caspase-3、Bcl-2、Bax 辣根过氧化物酶标记羊抗兔免疫球蛋白(二抗),Abcam公司。
1.1.4主要仪器 DMi8型倒置荧光显微镜、TCS-SP8型激光共聚焦显微镜,德国徕卡公司;Multiskan GO型酶标仪,Thermo公司;Cyto FLEX型流式细胞仪,Beckman Coulter公司。
1.2方法
1.2.1实验前准备 NAC用磷酸盐缓冲液(Phosphate buffered saline,PBS)配置成300 mmol/L母液,-20℃保存,实验前用PBS配置为10、30、60 mmol/L低、中、高3种浓度。
1.2.2细胞培养及分组 MCF-7人乳腺癌细胞,购于上海生科院细胞库,以RPMI1640培养基(含10%胎牛血清),37℃、5%CO2恒定条件下常规培养。倒置显微镜观察细胞生长状况,待细胞生长至对数期时,将细胞分装于6孔板中,随机分为5组,每组5个复孔,待细胞贴壁后,Dox组、低剂量组、中剂量组、高剂量组和对照组分别用0.4 μg/ml Dox、0.4 μg/ml Dox+(10、30、60 mmol/L)NAC、PBS进行处理,常规培养。
1.2.3细胞凋亡率测定 收集培养至12、24、48 h的MCF-7人乳腺癌细胞,Hoechst33342 PI染料缓冲液重悬,严格根据细胞凋亡试剂盒说明书步骤进行操作,采用流式细胞仪分析细胞凋亡率。
1.2.4细胞内ROS水平测定 收集培养至48 h的MCF-7人乳腺癌细胞,用无血清培养基调整细胞浓度为2×104/孔,严格按照ROS检测试剂盒说明书步骤操作,采用荧光探针标记法检测。加入无血清细胞培养液配置的浓度为3 μmol/L的DCFH-DA,37℃恒温孵育30 min,PBS缓冲液洗涤3次后,加入无血清细胞培养液,应用激光共聚焦显微镜扫描摄像(激发波长488 nm,发射波长520 nm),荧光强度用Zeiss LSM Image Examiner软件进行分析。
1.2.5Caspase-3、Bcl-2、Bax mRNA表达水平测定 收集培养至48 h的MCF-7人乳腺癌细胞,采用Trizol法提取总RNA。按照试剂盒说明书将mRNA逆转录cDNA。实时荧光定量PCR仪进行检测,反应条件为:95℃预变性10 min;95℃变性15 s,59℃退火20 s,72℃延伸60 s,重复40个循环,然后72℃延伸5~10 min,以β-actin作为内参。采用凝胶成像系统测定Caspase-3、Bcl-2、Bax mRNA相对表达量,以2-ΔΔCT为目的基因的相对表达强度。Caspase-3:上游引物:5′-CATAGCTCTACTCTAGGCTATCGCT-3′,下游引物:5′-CATCCGGTCTGGTAGCCATCT-GCAG-3′;Bcl-2:上游引物:5′-ACTACCTAGTCAGAGCGTAGCTATG-3′,下游引物:5′-GCTGCTCGGAGAACTGTCGACCTTG-3′;Bax:上游引物:5′-GCACGGACTATCACTGTGAACAGCC-3′,下游引物:5′-ATCTATCGCTGCAGTTCGACACTATG-3′;β-actin:上游引物:5′-GTGTACGGTGCATGCCTACGTGAGA-3′,下游引物:5′-ACGGACTAGCGCTCTGTCTAGCGCA-3′。
1.2.6Caspase-3、Bcl-2、Bax蛋白表达水平测定 收集培养至48 h的MCF-7人乳腺癌细胞,根据蛋白提取试剂盒步骤提取总蛋白,二喹啉甲酸(Bicinchoninic acid,BCA)法测定蛋白总量。十二烷基硫酸钠聚丙烯酰氨凝胶电泳(Sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)电泳法分离,并转移至硝酸纤维素膜上。用脱脂奶粉摇床封闭1 h,加入一抗(1∶500),4 ℃摇床孵育过夜,加入二抗(1∶5 000),常温孵育1 h,暗室中曝光、显色。应用凝胶成像软件扫描拍照,使用BandScan灰度值分析软件分析,以Caspase-3、Bcl-2、Bax蛋白灰度值与内参β-actin灰度值比表示其相对表达量。
1.2.7观察指标 ①乳腺癌细胞凋亡率对比;②乳腺癌细胞内ROS水平对比;③Caspase-3、Bcl-2、Bax mRNA相对表达量对比;④Caspase-3、Bcl-2、Bax蛋白相对表达量对比。

2 结果
2.1乳腺癌细胞凋亡率对比 乳腺癌细胞凋亡率,组间、时间及交互比较,差异均有统计学意义(P<0.05)。乳腺癌细胞凋亡率组间比较,对照组最低、Dox组其次,低,高剂量组稍高,中剂量组最高,除低剂量组与高剂量组比较差异无统计学意义(P>0.05),其他每两组间比较差异均有统计学意义(P<0.05);组内比较,除对照组随时间变化差异无统计学意义(P>0.05),其他各组均随时间延长显著增加(P<0.05)。结果见图1、表1。
2.2乳腺癌细胞内ROS水平对比 乳腺癌细胞内ROS荧光强度组间比较,差异均有统计学意义(P<0.05)。ROS荧光强度组间比较,对照组最低、中剂量组其次,低、高剂量组稍高,Dox组最高,除低剂量组与高剂量组比较差异无统计学意义(P>0.05),其他每两组间比较差异均有统计学意义(P<0.05)。结果见表2,图2、3。
2.3Caspase-3、Bcl-2、Bax mRNA相对表达量对比 Caspase-3、Bcl-2、Bax mRNA相对表达量组间比较,差异均有统计学意义(P<0.05)。Bcl-2 mRNA相对表达量组间比较,对照组最高,Dox组其次,低、高剂量组稍低,中剂量组最低,除低剂量组与高剂量组比较差异无统计学意义(P>0.05),其他每两组间比较差异均有统计学意义(P<0.05);Caspase-3、Bax mRNA相对表达量组间比较,对照组最低,Dox组其次,低、高剂量组稍高,中剂量组最高,除低剂量组与高剂量组比较差异无统计学意义(P>0.05),其他每两组间比较差异均有统计学意义(P<0.05)。结果见表3、图4。

图1 凋亡率对比(%)Fig.1 Comparison of rate of apoptosis(%)
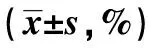


Groupsn12 h24 h48 hControl group58.60±1.319.37±1.0210.16±1.10Dox group521.10±3.501)36.75±3.711)5)48.91±5.011)5)6)Low dose group 535.46±4.161)2)48.08±4.901)2)5)66.07±4.231)2)5)6)Middle dose group551.37±5.251)2)3)65.79±6.121)2)3)5)84.04±5.791)2)3)5)6)High dose group537.80±4.601)2)4)50.11±5.211)2)4)5)68.53±4.611)2)4)5)6)FF inter group=21.209,F moments=41.067,F interactive=30.139PP inter group=0.000,P moments=0.000,P interactive=0.000
Note:Compared with the control group,1)P<0.05;compared with the Dox group,2)P<0.05;compared with the low dose group,3)P<0.05;compared with the middle dose group,4)P<0.05;compared with 12 h,5)P<0.05;compared with 24 h,6)P<0.05.



Groupsn48 hControl group551.08±6.41Dox group5105.71±8.441)Low dose group 587.42±7.491)2)Middle dose group565.30±5.371)2)3)High dose group585.36±7.531)2)4)F88.202P0.000
Note:Compared with the control group,1)P<0.05;compared with the Dox group,2)P<0.05;compared with the low dose group,3)P<0.05;compared with the middle dose group,4)P<0.05.

图2 各组ROS荧光强度(×400)Fig.2 Ros fluorescence intensity of each group(×400)Note: A.Control group;B.Dox group;C.Low dose group;D.Middle dose group;E.High dose group.

图3 细胞内ROS荧光强度对比Fig.3 Contrast of intracellular ROS fluorescence intensity



GroupsnCaspase-3Bcl-2BaxControl group50.42±0.071.45±0.08e0.37±0.04efDox group50.73±0.081)1.28±0.121)5)0.50±0.051)5)6)Low dose group 50.91±0.101)2)1.06±0.101)2)5)0.69±0.071)2)5)6)Middle dose group51.32±0.161)2)3)0.72±0.081)2)3)5)0.88±0.081)2)3)4)5)High dose group50.95±0.061)2)4)0.96±0.091)2)4)5)0.71±0.061)2)4)5)6)F53.53044.19451.645P0.0000.0000.000
Note:Compared with the control group,1)P<0.05;compared with the Dox group,2)P<0.05;compared with the low dose group,3)P<0.05;compared with the middle dose group,4)P<0.05.

图4 Caspase-3、Bcl-2、Bax mRNA相对表达量Fig.4 Relative expressions of Caspase-3, Bcl-2 and Bax mRNA



GroupsnCaspase-3Bcl-2BaxControl group50.97±0.091.53±0.105)0.51±0.065)6)Dox group51.19±0.091)1.35±0.121)5)0.62±0.071)5)6)Low dose group 51.32±0.101)2)1.13±0.101)2)5)0.80±0.051)2)5)6)Middle dose group51.59±0.131)2)3)0.86±0.081)2)3)5)1.22±0.101)2)3)5)6)High dose group51.35±0.101)2)4)1.18±0.091)2)4)5)0.83±0.081)2)4)5)6)F24.33132.18366.998P0.0000.0000.000
Note:Compared with the control group,1)P<0.05;compared with the Dox group,2)P<0.05;compared with the low dose group,3)P<0.05;compared with the middle dose group,4)P<0.05.
2.4Caspase-3、Bcl-2、Bax蛋白相对表达量对比 Caspase-3、Bcl-2、Bax蛋白相对表达量组间比较,差异均有统计学意义(P<0.05)。Bcl-2蛋白相对表达量组间比较,对照组最高,Dox组其次,低、高剂量组稍低,中剂量组最低,除低剂量组与高剂量组比较差异无统计学意义(P>0.05),其他每两组间比较差异均有统计学意义(P<0.05);Caspase-3、Bax蛋白相对表达量组间比较,对照组最低,Dox组其次,低、高剂量组稍高,中剂量组最高,除低剂量组与高剂量组比较差异无统计学意义(P>0.05),其他每两组间比较差异均有统计学意义(P<0.05)。结果见表3,图5、6。

图5 Caspase-3、Bcl-2、Bax蛋白免疫印迹图Fig.5 Immunoblotting of Caspase-3,Bcl-2 and Bax protein

图6 Caspase-3、Bcl-2、Bax 蛋白相对表达量对比Fig.6 Relative expressions of Caspase-3, Bcl-2 and Bax protein
3 讨论
乳腺癌发病病因与发病机制尚未完全阐明,可能与细胞周期调控相关因子、女性雌激素分泌紊乱、家族遗传等因素有关[5-7]。研究发现[8],乳腺癌患者出现化疗药物耐药性是导致化疗失败的重要原因,产生多药耐药的机制主要有p-糖蛋白药泵或细胞内解毒相关蛋白酶异常高表达、抗肿瘤药物作用靶点性质改变等。原发性耐药、化疗后复治产生耐药是影响化疗药物疗效的重要原因,因此提高乳腺癌细胞对化疗药物的敏感性对提高治疗效果十分重要[9]。研究发现[10],ROS大量产生后可通过氧化细胞内特异性化学簇,导致DNA突变或者激活炎症因子释放途径,最终可导致癌基因激活或抑制细胞正常凋亡程序的启动,控制肿瘤细胞内ROS含量可有效促进细胞凋亡、抑制细胞分化等过程。
本研究发现,细胞凋亡率组间比较,Dox组最低,低、高剂量组其次,中剂量组最高(P<0.05);ROS荧光强度组间比较,对照组最低,中剂量组其次,低、高剂量组稍高,Dox组最高(P<0.05);组内比较各组乳腺癌细胞凋亡率均随时间延长显著增加(P<0.05),说明30 mmol/L的NAC与Dox联用促进人乳腺癌细胞凋亡、调节细胞内ROS含量效果最佳,提示NAC可增强MCF-7细胞对Dox化疗敏感性。本研究中应用NAC与化疗药物Dox联用调节细胞内ROS水平与宋瑶等[11]研究结果相符,在其研究中单用化疗药物组ROS阳性表达率为(67.32±3.75)%,联用组为(45.32±7.23)%,对照组为(25.32±3.20)%,证实NAC确实可调节细胞内ROS水平。研究发现,机体中正常细胞可同多个信号途径修复DNA损伤,抑制遗传粗变发生,在具有癌变倾向的细胞中DNA修复功能失衡,DNA突变累积至一定水平时诱发癌变[12,13]。ROS是指产生于呼吸链中的一类单电子高活性基团[14],可直接或间接启动过氧化作用,ROS在正常机体中含量稳定,具有双向调节作用,较低浓度ROS水平具有一定修复细胞损伤的功能,肿瘤细胞内ROS水平较低,利于其存活。本研究中应用Dox化疗时肿瘤细胞内ROS显著升高,应用活性氧抑制剂NAC后,肿瘤细胞内ROS水平降低至一定水平,肿瘤细胞凋亡率较单用Dox升高。由此可知,NAC在一定浓度范围内具有辅助Dox促进细胞凋亡的作用。
此外,本研究中,Bcl-2 mRNA及蛋白相对表达量组间比较,对照组最高,Dox组其次,低、高剂量组稍低,中剂量组最低(P<0.05);Caspase-3、Bax mRNA及蛋白相对表达量组间比较,对照组最低、Dox组其次,低、高剂量组稍高,中剂量组最高(P<0.05),提示NAC可增强MCF-7细胞对Dox化疗敏感性的调控机制可能是通过降低Bcl-2 mRNA及蛋白表达,增强Caspase-3、Bax mRNA及蛋白表达而实现。Caspase-3是Caspase蛋白酶家族的重要成员[15],该蛋白酶在调控细胞凋亡过程中发挥关键酶作用,该蛋白酶一旦被激活,其下游一系列蛋白酶被激活,可通过激活细胞表面死亡受体途径或线粒体途径引起细胞结构或功能异常,最终引起细胞死亡。Bcl-2家族广泛存在于线粒体内,可使线粒体膜电位增强,阻止线粒体内Ca+释放和核酸内切酶激活,进而发挥抗凋亡作用[16]。Bax是与Bcl-2相关的一类蛋白,且与Bcl-2高度同源,该蛋白可直接激活Caspase-3,进而激活死亡效应级联反应过程,同时抑制Bcl-2蛋白活性,发挥促凋亡作用[17,18]。由此,NAC在一定浓度范围内与Dox联用可能通过降低细胞内ROS水平,进而激活Bcl-2/Bax信号转导通路,发挥促凋亡作用。
综上所述,在一定范围内,NAC与Dox联用可显著促进人乳腺癌细胞凋亡、调节细胞内ROS含量,可显著增强人乳腺癌细胞对Dox化疗敏感性,其中30 mmol/L的NAC效果最佳,推测其增敏调控机制是通过降低Bcl-2 mRNA及蛋白表达,增强Caspase-3、Bax mRNA及蛋白表达,进而发挥促进细胞凋亡的作用,且与Bcl-2 /Bax信号通路有关,为临床中应用NAC增强乳腺癌患者对化疗药物的敏感性提供理论基础。

