免疫法ITP小鼠模型的建立与鉴定①
肖建红 李君君 张阳春
(南华大学附属第一医院血液科,衡阳 421001)
免疫性血小板减少性紫癜(Immune thrombocytopenia,ITP)是一种自身免疫性出血性疾病,其主要特征是黏膜及皮肤出血和外周血小板水平低下,但是发病机理尚未完全阐明。大多学者认为ITP的发病与机体免疫失调密切相关,由于体内产生自身抗体同血小板表面抗原相结合,即体内产生的对抗自身血小板抗体导致网状内皮系统,尤其是脾脏的巨核细胞增殖分化、巨噬细胞增多、吞噬能力增强,继而导致血小板生命周期缩短,血小板较少[1],从而导致皮肤黏膜及重要脏器出血。
随着分子免疫学和细胞免疫学研究的飞速发展,血小板减少性紫癜的研究也不断深化;但针对ITP的治疗方案却无显著性提升,依然还是依赖于传统的激素、免疫抑制剂及脾切除等主要治疗方式,一旦终止治疗后容易再发,而过多使用又带来副作用多和远期效果差等问题,因此一直困扰着临床医生。目前针对ITP的研究大多数建立在已经应用药物的基础上,并非亚临床试验。这样有可能因发生其他并发症而不得不停止[2,3]。为此,构建一个合适的ITP模型可进一步阐明该病的发病机理及药物的治疗机制,并深入探索新的诊治方法。由于ITP自身有关的病理特点,动物模型的应该建立在和ITP疾病本质相似的基础上。当前国内、外对动物模型的构建多使用外源性免疫法造模[4-6]或免疫法合并其他方法[7,8]。
本项目应用注射豚鼠抗BALB/c小鼠血小板血清(Guinea pig anti-mouse platelct serum,GP-APS)免疫法造模,构建和ITP患者发病特征相类似的小鼠ITP模型,为深入探讨其病理机制及治疗药物机理和新药研发奠定良好的研究理论基础及科学依据。
1 材料与方法
1.1材料
1.1.1动物 20只SPF级健康BALB/c小鼠,雌性,鼠龄6~8周,重量为18~22 g,购自中山大学北校区实验动物中心[动物合格证号:0084606];小鼠饲养及实验均在中山大学北校区实验动物中心清洁级动物实验室内进行。
1.1.2主要试剂与仪器 弗氏完全佐剂(FCA)、弗氏不完全佐剂(FICA)和小牛血清白蛋白购于美国Sigma公司;辣根过氧化物酶标记重组蛋白A(Protein A/HRP)购于北京博奥森生物;EDTA-Na2购于广州鼎国生物公司;全自动血液分析仪、ELITE流式细胞仪、低温离心机、细胞离心机购自英国Shandon公司。
1.2方法
1.2.1豚鼠抗BALB/c小鼠GP-APS制备
1.2.1.1制备BALB/c小鼠血小板 取BALB/c小鼠,5%戊巴比妥钠麻醉后以EDTA-Na2抗凝,从眼球取全血,1 000 r/min离心10 min,取上层血小板血浆(Platelet rich plasma,PRP),离心10 min沉淀血小板,用pH7.4 0.01 mol/L PBS洗涤血小板,离心10 min后弃上清,连续3次,然后用pH7.4 0.01 mol/L PBS悬浮血小板,再计数血小板,最后调整血小板数至1×109ml-1。
1.2.1.2血小板抗原乳化和乳化剂鉴定 取制备好的血小板分别加入等量FICA和FCA,经超声混合成油包水状乳剂,即FICA抗原和FCA抗原;抽吸少量准备好的佐剂抗原滴入冷水中,保持好完整性,当变成油滴样,说明乳化良好,是较好的油包水型乳剂。
1.2.1.3免疫方法 根据参考文献[4,5,9],取含FCA抗原1 ml注射于豚鼠背部、足掌、腹部等处的皮下,不少于4点/次;取含FICA抗原1 ml分别于1、2及4周注射于豚鼠背部、足掌和腹部等处的皮下,不少于4点/次,操作完后局部消毒。第5周时再次麻醉小鼠,颈动脉取血,静置30~60 min后,离心10 min后取上清,即为GP-APS,分装并保存于冰箱温度为-20℃以备用。
1.2.2ELISA检测GP-APS效价
1.2.2.1依照上述方法分离血小板,用pH7.4 0.01 mol/L PBS悬浮血小板并将其调至1×109ml-1浓度。
1.2.2.2将准备好的血小板悬液加入96孔培养板中,50 μl每孔,设置阴性对照孔,离心15 min。BSA封闭并4℃静置过夜。
1.2.2.3取出培养板,用pH7.4 0.1 mol/L PBS漂洗3次,每次3 min,洗涤后分别按以下浓度(1/1、1/2、1/4、1/8、1/16、1/32、1/64和1/128浓度)加入50 μl GP-APS,在37℃水浴2 h。
1.2.2.4按照上述方法pH7.4 0.1 mol/L PBS洗涤3次,每孔加100 μl (1/3 000)Protein/HRP,37℃水浴反应1 h。
1.2.2.50.1 mol/L pH7.4 PBS洗涤3次,方法同前,每孔加入底物柠檬酸邻苯二胺基质(OPD-H2O2液)100 μl,37℃避光反应30 min。
1.2.2.6注入2 mol/L H2SO450 μl终止反应;在波长490 nm下用酶标仪检测,读取每孔OD值,≥阴性对照孔两倍OD值则是阳性。
1.2.3GP-APS的预处理
1.2.3.1制备BALB/c小鼠红细胞 BALB/c小鼠麻醉后,常规抗凝取血,将抗凝血置于离心管中,2 000 r/min 离心10 min以沉淀红细胞,弃上清。加入8倍容量的生理盐水,轻轻悬浮红细胞,2 000 r/min 离心10 min,弃上清液,连续3次,然后悬浮红细胞,配置5%终浓度的悬液。
1.2.3.2红细胞吸附 将GP-APS从冰箱中取出,放在56℃水浴中孵育30 min进行补体灭活,然后用相同容积5%的BALB/c小鼠红细胞悬液加入GP-APS中,37℃水浴1 h,再3 500 r/min离心10 min,留上清。上清液按相同的方法吸附2次,用盐水稀释成浓度1/4 GP-APS备用。
1.2.4ITP小鼠模型的建立
1.2.4.1动物分组 20只BALB/c小鼠,分为随机两组,即模型组、正常组,10只每组。模型组:根据文献注射APS方法建立动物模型,于1、3、5、7、9、11及13 d,依照5 μl/g浓度将1/4稀释的GP-APS注射小鼠腹腔,隔天一次。操作完后局部消毒。正常组:正常饲养,未进行任何处理;两组小鼠均在第14天处死,取材进行各项数据检测。
1.2.4.2观察指标 血小板检测:在注射前、间隔期和结束时,即注射APS第0、1、3、5、7、9、11及13天,取100 μl小鼠尾静脉血,滴入制备好抗凝剂1%EDTA-Na2 100 μl的EP管中,混匀后进行血常规检测。
ELISA法检测:血清PAIgG实验结束时,在小鼠眼球取血,分离血清于-20℃冰箱储存,ELISA检测模型组和正常组小鼠血清PAIgG。96孔酶标板分设空白孔、标准孔和样品孔,检验步骤按操作说明进行。
观察骨髓巨核细胞:结束后将小鼠处死,取其一侧股骨。采用针头抽取含1%胎牛血清白蛋白的PBS 2 ml 冲洗小鼠骨髓腔4次,取骨髓液0.5 ml注入2 ml PBS中,再取100 μl,300 r/min离心3 min。然后骨髓涂片和细胞染色,用光学显微镜计数巨核细胞100个,同时观察巨核细胞分类(原始巨、颗粒巨、幼稚巨、裸巨和产板巨核细胞)和形态。基准以直径 6 mm/片的圆内细胞数目,计算显微镜下巨核细胞数量。
脾脏指数及组织形态:实验结束处死动物,取脾脏测重后并统计脏器指数(5 min内取材),脏器指数=脏器重量/体重(mg/g)。同时观察脏器大体改变,如形态、外观和有无瘀血等。再进行切片和HE染色,观察组织病理。

2 结果
2.1GP-APS效价检测 ELISA测定GP-APS效价,分别加入1/1、1/2、1/4、1/8、1/16、1/32、1/64和1/128不同浓度的GP-APS 50 μl,37℃水浴2 h,阴性对照孔不加GP-APS,可看出在稀释为1/128时仍为阳性,表明小鼠已产生特异性抗体(见表1)。
2.2ITP小鼠模型检测
2.2.1一般情况比较 注射过程中,模型组小鼠APS注射后第2天开始出现注射部位瘀斑,皮下小出血点,分布在四肢、腹部、尾部和耳部,且在注射点周围最多。小鼠注射后出现短暂痉挛和抖动,精神差,进食和活动都减少。约1周后出血缓慢减轻,出血点变浅。注射1周后ITP模型组比正常组小鼠下降,差异有统计学意义(P<0.05);注射2周模型组体重比正常组和造模前小鼠均有降低,差异有统计学意义(P<0.01,P<0.05)。注射前、注射1周和注射2周小鼠体重改变见表2。
2.2.2小鼠外周血小板水平比较 在试验APS注射前、间隔期和结束时,即APS注射第0、1、3、5、7、9、11和13天,分别抽取100 μl尾静脉血,通过不同时间段外周血小板水平比较可看出,在GP-APS注射后,ITP模型组小鼠各时间点血小板水平明显减少,与正常小鼠和注射前比较,差异有明显的统计学意义(P<0.001,P<0.05)。在整个注射过程中,APS注射后24 h ITP小鼠外周血水平最低,然后随APS注射天数延长模型组外周血小板水平轻微反弹,大概在注射第5天时血小板计数上升幅度最大。在造模的第7天到结束时都保持较低的水平。由此可以看出,GP-APS注射免疫法造模可以使得血小板水平降低。(见表3及图1)。
表1ELISA法测定GP-APS效价
Tab.1PotencyofGP-APStestedbyELISA

ItemExperimental group(different concentration of GP-APS 50 μl)CONDilution1∶11∶21∶41∶81∶161∶321∶641∶128NegativeOD0.1980.1880.1760.1620.1310.1520.1420.1270.049
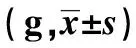


GroupsCase(n)Pretherapy1 week2 weeksNormal1020.10±0.9321.25±1.1822.33±1.42Model1020.08±1.0519.67±1.271)18.80±1.711)2)
Note:1)P<0.01;2)P<0.05.

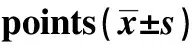

GroupsCase(n)PLT(×109 L-1)0 d1 d3 d5 d7 d9 d11 d13 dNormal101 042±146990±1461 068±184951±1391 102±12410 008±124980±99997±83Model101 111±252 301±1001) 460±1103)518±1373) 349±1011) 331±1281) 379±1892) 421±1193)
Note:1)P<0.001;2)P<0.01;3)P<0.05.



GroupsCase(n)MegakaryocytePronucleus of MegGranule of Meg Plate of MegBare of MegNormal1060.50±9.8930.0±3.8056.4±3.177.6±1.716.0±0.82Model1083.4±6.991)31.3±4.4060.2±4.964.7±1.641)3.9±1.522)
Note:1)P<0.01;2)P<0.05.

图1 各组小鼠不同时间点血小板水平比较Fig.1 Comparison for PLT level of mice at different time points



GroupsCase(n)PAIgG(pg/ml)Normal1017.02±0.86Model1021.22±0.721)
Note:1)P<0.01.
2.2.3巨核细胞检测 模型组和正常对照组小鼠比较,骨髓巨核细胞计数显著增多,然而裸巨和产板巨核细胞计数下降,有统计学意义差异(P<0.01,P<0.05)。且和正常组小鼠相比,模型组的骨髓象表现出产板巨核细胞下降,巨核细胞成熟受阻。结果提示,GP-APS注射免疫法造模的骨髓和其巨核细胞分类与患者的ITP骨髓象巨核细胞特点相同,结合血小板改变,能断定出免疫法可以建立ITP模型。各组巨核细胞和骨髓象比较见表4和图2。
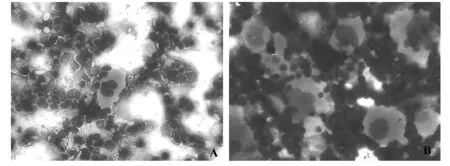
图2 各组小鼠骨髓象比较(瑞氏染色,×200)Fig.2 Comparison for myelogram of mice in different groups(Wright stain,×200)Note: A.The myelogram in the normal;B.Megakaryocytes increased,and the plate and bare of megakaryocyte decreased in the model.



GroupsCase(n)Spleen indexNormal107.02±0.98Model1010.59±1.211)
Note:1)P<0.001.
2.2.4血小板相关抗体(PAIgG)水平 ELISA法检测模型组和正常组小鼠血清PAIgG发现,ITP模型组PAIgG表达水平明显高于正常组小鼠外周血PAIgG水平,差异有显著的统计学意义(P<0.01)。各组PAIgG水平的比较见表5。
2.2.5脾脏指数比较 实验结束后处死动物,取出脾脏,与正常组比较,模型组小鼠脾脏指数明显较大,差异有明显的统计学意义(P<0.001)。见表6。
2.2.6脾脏组织形态及骨髓象观察 模型组和正常组小鼠的脾脏形态及外观无明显差别,但模型组稍大。镜下HE染色显示,正常组被膜、白髓、红髓界限明显,偶见有散在的巨核细胞(图3A);与正常组比较,模型组小鼠脾脏白髓稍大,红髓较小,淋巴细胞显著增多,红髓中可发现髓窦和髓索中较多的巨核细胞;高倍镜下巨核细胞核体积较大,胞浆丰富(图3B)。

图3 各组小鼠脾脏组织结构比较(HE,×200)Fig.3 Comparison for spleen microstructure of mice in different groups(HE,×200)Note: A.The spleen microstructure in the normal;B.The spleen microstructure in the model.
3 讨论
ITP是临床中较为常见的自身免疫性出血性疾病,虽然确切的病因和发病机制至今尚不清楚,但大多数研究人员认为ITP的发病和机体免疫功能失调关系密切,但导致其免疫功能异常的相关因素仍未明朗。大量文献报道ITP患者因其机体产生抗体抗自身血小板,使得血小板寿命缩短,并被巨噬细胞破坏,临床表现为外周血小板水平降低、骨髓巨核细胞计数明显上升并发育成熟受阻,全身广泛的皮肤黏膜,甚至重要脏器出血。针对ITP的病理特点,建立一个与临床发病一致的ITP模型是近年来国内、外研究的焦点。建立一个理想的、稳定的、可操作性好的、能最大程度模拟人体状态的动物模型,有利于研究其发病机制与探索安全有效的治疗方法[10]。多年来,已有不少建立ITP的造模方法应用于该研究,为研究ITP的发病机理和药物治疗机制提供了可行性。
当前国内外应用于ITP动物模型的造模方式主要分为以下3种:化学药物法,免疫介导法及60Co照射法[11-13]。化学药物造模ITP是连续多次应用环磷酞胺(Cytoxan)、白消安即马利兰(Busulfan)等化学类药物腹腔注射或灌服小鼠,其原理是通过抑制小鼠骨髓造血干细胞的增殖和分化,导致外周血小板水平降低。化学药物法虽然操作简单,但是由于复制的小鼠模型不能准确表现出ITP的临床特征,现基本淘汰。至于60Co照射法,其造模法只表现较为短暂的骨髓抑制反应,且有可能会自我恢复正常状态,因而导致误差,研究结果受到影响,目前已较少应用。免疫介导法造模ITP小鼠,是应用外源性抗体注射小鼠腹腔,造成外周血小板水平降低,同时导致骨髓巨核细胞增殖分化,是较为理想的造模方法,其操作简单,成本低廉且干扰因素小,目前己在国内外大量采用。
首次建立ITP动物模型报道于20世纪70年代, Bentfeld等[14]科研组采用反复给大鼠注射APS成功构建了慢性ITP大鼠模型,重复APS注射5~6次/d,同时接连10 d注射APS,能够使大鼠外周血小板维持在较低的水平。随后, Stenberg等[15]在1990年在Bentfeld造模的基础上又进行了进一步的深入探索,发现从应用APS注射开始到停止后5 d内血小板可降低以及巨核细胞增殖分化和形态等发生改变,研究时间也延长至12 d。国内ITP模型研究稍晚,1994年,我国杨宇飞等[5]率先在国内构建BALB/c 小鼠模型,1周内采用共6次反复APS注射,观察骨髓象、外周血象和脾脏等组织脏器病理改变。杨宇飞的实验结果阐明,此免疫法能够将ITP小鼠血小板水平维持1周内小鼠正常值的11%~25%。此造模法是外源性免疫介导法造模,应用这种方法造模ITP主要表现是外周血小板水平降低,PAIgG上升,同时造成骨髓巨噬细胞增殖改变及产血小板巨核细胞水平降低,完全与ITP发病机制相符合,是目前用于防治ITP研究中较为常用的动物模型造模法。
本研究应用免疫介导方法构建ITP小鼠模型,参照文献同时予以改进,隔日注射1/4稀释的GP-APS予BALB/c小鼠腹腔,共7次,以能够使小鼠外周血小板维持在较低的水平。我们通过观察得出,在整个研究过程中,APS注射后24 h模型小鼠外周血小板水平最低,然后随着APS注射天数的延长ITP小鼠血小板水平稍有提高,大概在第5天时血小板上升的幅度最大,这一结果与相关文献报道是相符合的[16]。虽然产生这种情况的具体机制还未阐明,可能和骨髓造血能力的代偿和反馈作用相关[17]。在注射后第7天出现血小板计数保持在较低的水平,是正常值的15%~30%,此结论和国内的文献报道也相符[5]。另外,我们还观察到,在注射APS后第13天,停注APS后血小板低水平维持时间最长(72 h),也证实了以往的报道[18]。造模2周可作为预防或治疗给药的最佳观测时间。
研究结果表明,采用外源性注射GP-APS的免疫造模方法,能使小鼠外周血小板保持在低水平,PAIgG增多,骨髓巨核细胞计数增多伴成熟受阻,ITP模型的血象和骨髓象以及临床表现均和ITP患者相似,这种建模法能够基本模拟ITP患者的发病特点,且技术简捷,操作可行,重复性和稳定性好。

