五味子甲素通过抑制NLRP3炎症小体活化减轻失血性休克大鼠的肾脏损伤①
甘永雄 俞 凤
(安徽医科大学第一附属医院,合肥 230022)
短时间大量失血引起的全身多器官功能衰竭是导致失血性休克患者死亡的主要原因[1]。其中,肾脏是最易受累的器官之一[2,3]。研究表明,炎症反应和线粒体功能障碍参与了失血性休克诱导肾脏损伤的过程[4-6]。NLRP3炎症小体激活是介导肾脏炎症反应的主要因素[7]。抑制NLRP3炎症小体的活化可减轻慢性肾病小鼠的肾纤维化和线粒体功能紊乱,还可促进失血性休克大鼠的肾功能的恢复[7,8]。因此,寻找新的药物及方法抑制NLRP3炎症小体的活化将有利于失血性休克后肾脏功能的修复。五味子甲素是从五味子中提取的一类木质素类成分,具有抗凋亡及免疫调节等作用,同时还具有较强的抗炎活性[9-11]。研究表明,五味子甲素可通过抑制NLRP3炎症小体激活抑制IL-1β的分泌和线粒体ROS的释放[12]。但五味子甲素是否能通过调控NLRP3炎症小体的激活减轻失血性休克诱导的肾损伤还未见报道。因此,本文将通过复制失血性休克模型探究五味子甲素对失血性休克大鼠肾脏损伤的作用。
1 材料与方法
1.1试剂与仪器 五味子甲素购自上海纯优生物科技有限公司。血肌酐(Serum creatinine,Scr)、血尿素氮(Blood urea nitrogen,BUN)、琥珀酸脱氢酶(Succinate dehydrogenase,SDH)、超氧化物歧化酶(Superoxide dismutase,SOD)和谷胱甘肽过氧化物酶(Glutathione peroxidase,GSH-Px)试剂盒购自南京建成生物工程研究所。Caspase-1一抗购自美国CST公司,HRP标记的IgG山羊抗小鼠二抗购自美国Santa Cruz公司。IL-1β、TNF-α和GAPDH引物由上海生工设计合成。
1.2方法
1.2.1动物分组及模型的建立 实验所用SD大鼠由浙江大学实验动物中心提供,体重220~280 g。适应性喂养3 d后,将大鼠随机分为对照组、模型组、五味子甲素20 mg/kg组、五味子甲素40 mg/kg组和五味子甲素80 mg/kg组,实验前12 h禁食不禁水。根据文献[13]报道方法复制大鼠失血性休克模型。除对照组外,其他组大鼠用水合氯醛麻醉后,分离左侧股动脉和股静脉并插入导管,股静脉导管连接灌注泵以随时补充液体,股动脉导管用于失血处理,放血量约为全身的60%左右。同时分离左侧股动脉,用导管连接RM6240BD生物信号采集系统以连续监测平均动脉压力,血压控制在35~40 mmHg,维持1.5 h后进行复苏。对照组大鼠除不做失血处理外,其他处理同上。完成模型复制后,五味子甲素20 mg/kg组、五味子甲素40 mg/kg组和五味子甲素80 mg/kg组大鼠即刻腹腔注射给予相应浓度的五味子甲素,对照组和模型组给予等量溶媒,24 h后取静脉血及肾脏组织进行后续实验。
1.2.2试剂配制 精密称取8 g五味子甲素溶于10 ml生理盐水中配制成0.8 g/ml的五味子甲素母液,用前稀释,并用羧甲基纤维素钠助溶,使其终浓度不超过0.5%。
1.2.3试剂盒检测 给予五味子甲素24 h后,静脉取血,并以3 500 r/min转速4℃离心15 min,取上层血清根据试剂盒说明书检测血清中Scr、BUN的含量。
1.2.4线粒体提取及检测 用水合氯醛麻醉大鼠后,取肾脏并快速分离去除结缔组织和脂肪组织,将分离后的组织放入预冷的线粒体分离缓冲液中,并剪碎至1 mm。随后用含5%BSA的线粒体分离缓冲液进行匀浆,过滤除去组织残渣后梯度离心提取线粒体,再用缓冲液重悬沉淀,并根据试剂盒说明书加入显色剂,检测吸光度,计算蛋白含量。最后用试剂盒检测线粒体中SDH、SOD和GSH-Px的活性。
1.2.5qRT-PCR 用试剂盒提取组织总RNA。根据反转录试剂盒说明书合成cDNA,用PCR仪进行扩增,凝胶电泳法对扩增产物进行定量分析。实验所用到引物均由上海生工设计合成。其引物序列如下:IL-1β上游引物:5′-GCAACTGTTCCTGAA-CTCAACT-3′,下游引物:5′-ATCTTTTGGGGTCCGT-CAACT-3′;TNF-α上游引物:5′-TTCGGAACTCACTGGATCCC-3′,下游引物:5′-GGAACAGTCTGGGAA-GCTCT-3′;GAPDH 上游引物:5′-TGACCACAGTCCATGCCATC-3′,下游引物:5′-GACGGACACATTGGGGGTAG-3′。
1.2.6Western blot 提取肾皮质总蛋白,用BCA试剂盒检测各组大鼠肾皮质总蛋白浓度并调平。10% SDS-PAGE分离各组蛋白并转移至PVDF膜,用5%脱脂牛奶室温封闭PVDF膜2 h,随后滴加Caspase-1 (1∶1 000)一抗,于4℃封闭过夜。第二天弃去一抗,加入HRP标记的山羊抗小鼠二抗室温封闭1 h后滴加ECL显色液进行曝光显影。

2 结果
2.1五味子甲素对大鼠肾脏功能的影响 为了探究五味子甲素对失血性休克大鼠肾脏功能的影响,我们检测了各组大鼠血清中Scr和BUN的含量。实验结果表明,与对照组比较,模型组大鼠血清BUN和Scr的含量明显升高(P<0.01,P<0.001,图1);五味子甲素40 mg/kg组和五味子甲素80 mg/kg组大鼠血清BUN和Scr的含量较模型组比较明显降低(P<0.05,P<0.01,图1),表明五味子甲素可促进失血性休克大鼠肾脏功能的恢复。
2.2五味子甲素对肾脏线粒体功能的影响 实验结果表明,失血性休克能显著降低大鼠肾脏线粒体SDH、SOD和GSH-Px的活性(P<0.05,图2);五味子甲素(80 mg/kg)可明显升高失血性休克大鼠SDH、SOD和GSH-Px活性(P<0.05,图2),表明其可促进失血性休克大鼠线粒体功能的恢复。
2.3五味子甲素对肾脏炎症反应的影响 qRT-PCR实验结果表明,与正常组比较,模型组大鼠肾脏皮质IL-1β和TNF-α的mRNA水平明显升高,差异具有统计学意义(P<0.05,图3);五味子甲素80 mg/kg组大鼠IL-1β和TNF-α的mRNA水平较模型组比较明显降低,差异具有统计学意义(P<0.05,图3),同时,五味子甲素还能显著降低模型大鼠肾脏IL-1β和TNF-α的蛋白表达水平(P<0.05,P<0.01,图4),表明其可抑制失血性休克大鼠肾脏炎症反应。

图1 五味子甲素对大鼠肾脏功能的影响Fig.1 Effect of Sch A on renal function of model ratsNote: n=8,**.P<0.01,***.P<0.001 vs control group;#.P<0.05,##.P<0.01 vs model group.

图2 五味子甲素对肾脏线粒体功能的影响Fig.2 Effect of Sch A on mitochondrial function of kidneyNote: n=8,*.P<0.05 vs control group;#.P<0.05 vs model group.Each experiment was repeated at least three times.

图3 五味子甲素对IL-1β和TNF-α的mRNA表达水平的影响Fig.3 Effects of Sch A on mRNA levels of IL-1β and TNF-αNote: n=8,*.P<0.05 vs control group;#.P<0.05 vs model group.
2.4五味子甲素对NLRP3炎症小体活化的影响 为了探究五味子甲素对NLRP3炎症小体活化的作用,我们采用Western blot法检测了NLRP3炎症小体活化标记因子Caspase-1的蛋白表达水平。模型组大鼠Caspase-1的表达水平较正常组比较显著升高(P<0.05,图5);五味子甲素 40 mg/kg组和五味子甲素 80 mg/kg组Caspase-1的蛋白表达水平与模型组比较明显降低,差异具有统计学意义(P<0.05,P<0.01,图5)。结果表明,五味子可抑制失血性休克大鼠NLRP3炎症小体的活化。

图4 五味子甲素对IL-1β和TNF-α蛋白表达水平的影响Fig.4 Effect of Sch A on protein levels of IL-1β and TNF-αNote: The protein levels were determined by Western blot.GAPDH was used as losding control.n=8,*.P<0.05 vs control group;#.P<0.05,##.P<0.01 vs model group.
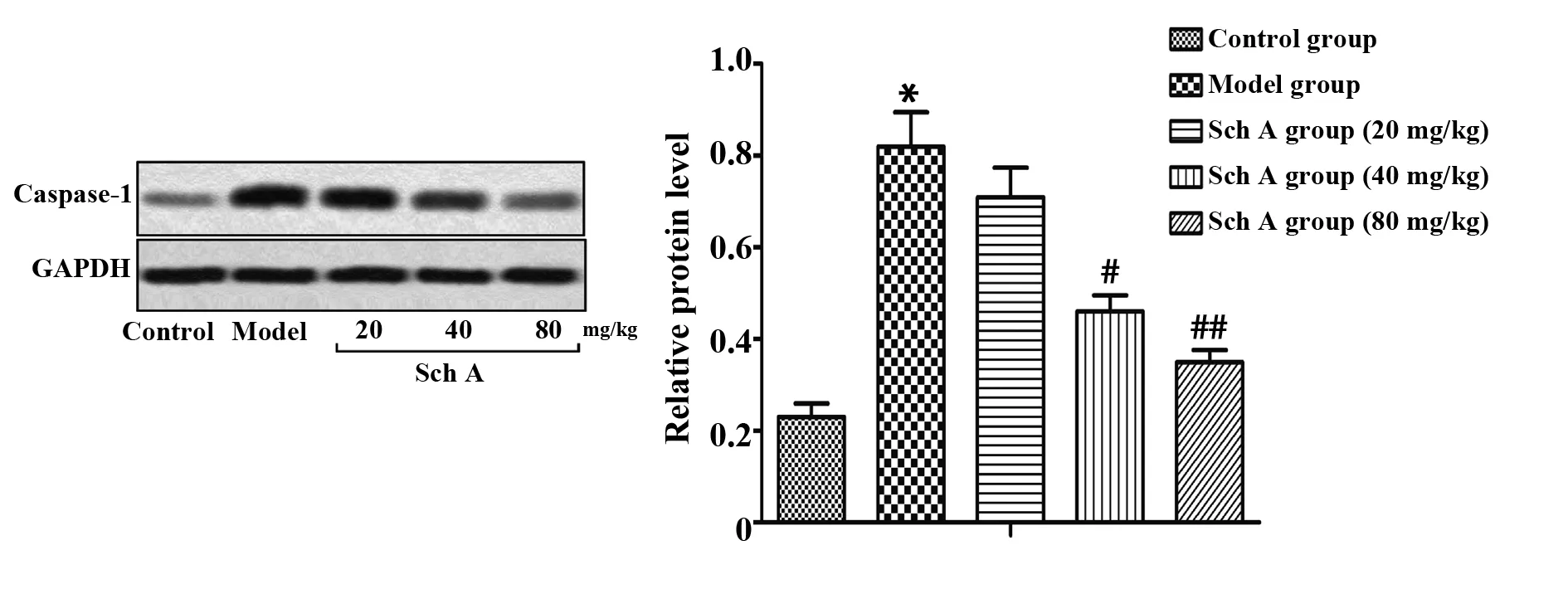
图5 五味子甲素对NLRP3炎症小体活化的影响Fig.5 Effect of Sch A on activation of NLRP3 inflammasomeNote: n=8,*.P<0.05 vs control group;#.P<0.05,##.P<0.01 vs model group.
3 讨论
肾损伤是失血性休克的常见并发症[2,3]。肾损伤早期主要是短暂的肾脏功能改变,若不能及时恢复血流供应将会导致肾脏出现缺血性坏死,最终导致肾脏器质性病变[14],但肾血流灌注急剧增加也会进一步加重肾损伤[15]。因此,寻找新的药物促进肾功能的恢复能有效挽救失血性休克患者的生命。本研究通过复制失血性休克大鼠模型探究五味子甲素对失血休克后大鼠血清中BUN和Scr含量的影响。结果显示,失血性休克模型组大鼠血清BUN和Scr的含量明显升高,表明失血性休克造成了大鼠肾脏功能损伤。五味子甲素可明显降低失血性休克大鼠血清BUN和Scr的含量,提示其能缓解失血性休克后肾损伤,发挥肾保护作用。
线粒体功能障碍是导致失血性休克肾损伤的重要机制之一[4]。线粒体功能紊乱可导致活性氧大量产生、能量供应障碍及促细胞凋亡因子的大量分泌[16]。调控线粒体功能紊乱能有效减轻失血性休克诱导的肾损伤[17]。研究表明,白蛋白诱导的线粒体功能障碍可促进人肾小管上皮细胞凋亡[18,19]。中药提取物白藜芦醇可通过调控失血性休克引起的线粒体功能紊乱抑制ROS的表达,减轻肾损伤[20,21]。同时,五味子可减轻顺铂引起的肾损伤[22]。五味子甲素可通过调控线粒体功能促进HL-60细胞凋亡[23]。本研究发现,五味子甲素可显著促进失血性休克大鼠线粒体SDH、SOD和GSH-Px的活性,其中SDH是呼吸链的关键酶,SOD和GSH-Px可清除过氧化物,抑制氧化应激的发生,促进细胞存活,提示五味子甲素可通过调控线粒体功能障碍减轻失血性休克引起的肾损伤。
炎症反应是导致是失血性休克肾损伤的另一重要机制,NLRP3炎症小体是一种重要的炎症反应启动因子[24,25]。研究表明,线粒体功能紊乱可促进NLRP3炎症小体激活[18]。NLRP3炎症小体的激活还可进一步的促进线粒体功能紊乱,抑制NLRP3炎症小体的活化可减轻Ang II诱导的线粒体功能障碍[26]。此外,NLRP3炎症小体可促进Caspase-1活化,从而促进炎症因子IL-1β、TNF-α等的活化,促进炎症反应的发生[27,28]。下调NLRP3炎症小体活化能降低Caspase-1表达水平,因此,Caspase-1常被作为NLRP3炎症小体活化的标志[29]。研究表明,NLRP3炎症小体在各类肾病导致肾损伤过程中发挥着重要作用[7,26]。同时,NLRP3也可通过诱导炎症反应促进失血性休克后多器官功能损伤[30,31]。Xiang等[32]的研究表明,在失血性休克肺损伤中,NLRP3炎症小体可诱导通过诱导炎症因子IL-β和ROS的释放加重肺损伤。抑制NLRP3炎症小体活化可抑制肾脏炎症反应,减轻失血性休克大鼠肾损伤[8]。在本研究中我们发现,五味子甲素可显著下调失血性休克大鼠肾脏IL-1β、TNF-α的mRNA水平,同时能明显减弱失血性休克对Caspase-1蛋白表达的促进作用,提示五味子甲素可抑制失血性休克诱导的NLRP3炎症小体的活化,从而抑制炎症因子的表达,减轻失血性休克大鼠肾脏炎症反应。
本研究实验结果表明,失血性休克诱导的肾损伤可导致线粒体功能紊乱、诱导NLRP3炎症小体活化。五味子甲素可通过抑制NLRP3炎症小体的活化抑制失血性休克大鼠肾脏炎症反应、调控线粒体功能障碍,从而减轻失血性休克诱导的肾脏损伤。本研究仅初步探讨了五味子甲素对失血性休克诱导的肾损伤的作用,对于其作用机制还需进行进一步研究,从而为失血性休克早期肾损伤的治疗提供新的潜力药物。

