模拟运输对异育银鲫血液生理生化指标、体色和肉质的影响
张玉平 刘昊昆 金俊琰 朱晓鸣 韩 冬 杨云霞 解绶启
(1. 中国科学院水生生物研究所淡水生态与生物技术国家重点实验室, 武汉 430072; 2. 中国科学院大学, 北京 100049;3. 湖北省淡水水产养殖联合创新中心, 武汉 430070)
运输是水产品从渔场到餐桌的一个重要环节。在运输过程中鱼体拥挤、水体振荡、溶解氧下降、氨氮升高等影响会引起鱼体的应激, 对商品鱼的生理状态造成影响, 甚至引起死亡, 从而导致经济损失[1]。当水生动物经过运输, 产生应激时, 影响机体的生产性能, 如抑制摄食降低生长速度[2]、死亡率升高[3]等。而且, 运输还会对动物内分泌造成影响, 皮质醇、血糖、乳酸等反应动物机体应激状态的指标发生变化[4]。运输对动物抗氧化酶系统也造成影响, 应激因子会诱导机体产生氧自由基,过多氧自由基对机体会造成氧化损伤, 需要抗氧化系统来抵抗自由基对机体的氧化损伤[5]。
异育银鲫“中科3号”(Carassis auratus gibeliovar. CAS III)是从高体形异育银鲫(♀)和平背型异育银鲫(♂)繁育出的有性后代中挑选出有明显优势性状的个体, 用兴国红鲤(Cyprinus carpio singguoensis)精子激活的雌核生殖方式培育出来的优良品种[6]。目前对其营养需求[7—9]、投喂策略[10]、品质调控[11]等的研究比较深入, 但针对其运输应激方面未见研究报道。本实验旨在探讨模拟运输对异育银鲫血液生理生化、体色和肉质的影响, 为进一步了解运输应激机制和缓解运输应激提供一定的理论基础。
1 材料与方法
1.1 实验饲料
采用鱼粉、豆粕、菜粕、棉粕和DDGS为主要蛋白源, 鱼油和豆油1∶1作为脂肪源配制实验饲料。实验所用原料经粉碎机粉碎, 过40目筛, 按照设计配方充分混匀后, 采用单螺杆膨化颗粒饲料机(中国水产科学研究院上海渔业机械研究所, SLP-45)制成直径为3 mm的沉性颗粒饲料, 于65℃烘干后置于4℃冰箱中备用, 实验饲料配方组成及化学组成见表 1。

表 1 实验饲料配方及化学组成(%干物质)Tab. 1 Formulation and proximate composition of the experimental diet (% dry matter)
1.2 实验鱼及暂养管理
异育银鲫“中科3号”来自中国科学院水生生物研究所官桥渔场, 实验地点为中国科学院水生生物研究所圆形玻璃纤维缸(直径: 80 cm, 水容积: 300 L)组成的可控温循环水养殖系统。驯化期挑选表观健康、规格均匀平均体重为(103.72±0.21) g的实验鱼, 称重后放入玻璃纤维缸中, 每缸25尾, 共3个平行。每天在09:00和16:00投喂实验饲料至表观饱食, 每天投喂前排污, 并用虹吸法清除缸底粪便, 换水量为鱼缸容积的1/3。养殖期间水温为(26.3±1.0)℃, 光照时间为08:00至20:00。驯养期间水体溶氧>5 mg/L, 氨氮<0.5 mg/L, 水体流速为1000 mL/min,水面光强为2.78—2.87 μmol/(m2.s), 水体pH为6.5—7.0, 养殖4周待鱼完全稳定后进行模拟运输实验。
1.3 模拟运输实验条件
实验鱼饥饿24h后, 从每个玻璃纤维缸中随机捞取5尾鱼抹干称重[平均体重为(116.46±2.09) g]后放入运鱼袋中(20 cm×20 cm×80 cm, 容积0.032 m3),共3个重复, 鱼水质量比为1∶5, 向运鱼袋中充入99.9%的纯氧, 充入氧气量以运鱼袋膨胀无凹瘪为度, 扎紧运鱼袋口在模拟汽车运输振动台(东莞市利鑫仪器设备有限公司, 型号: LX-5024B)上进行4h的模拟运输, 振动频率为160 r/min。
1.4 实验取样
模拟运输前从每缸随机捞取5尾鱼迅速放入MS-222麻醉剂中(浓度为80 mg/L)麻醉, 其中3尾鱼进行体色和肌肉pH测定, 之后用0.2%的肝素钠抗凝的注射器自尾静脉抽血制备血浆(3500 r/min,5min)后放入-80℃冰箱供相关理化指标测定。剩余2尾取背肌修取肌肉块(1.0 cm×1.0 cm×0.5 cm)进行质地测定。模拟运输结束后, 立即测定运鱼袋水体中溶解氧含量, 并采集水样用于测定pH和氨氮浓度, 此后, 迅速将实验鱼放入MS-222麻醉剂中(浓度为80 mg/L)麻醉, 以同样的方法对实验鱼进行体色、肌肉pH和质地测定, 并取血浆样品供相关理化指标测定。
1.5 样品分析
水样和肌肉pH采用pH计(瑞士, Mettler Toledo,FE20)进行测定, 水样氨氮浓度用纳氏比色法进行测定[12], 水体溶氧采用光学溶解氧测量仪(美国YSI,PRO ODO)测定。血浆中葡萄糖、乳酸、丙二醛、超氧化物歧化酶、过氧化氢酶、谷胱甘肽过氧化物酶采用南京建成生物工程研究所的试剂盒测定。血浆皮质醇采用试剂盒进行测定(Cusabio公司, Fish cortisol ELISA Kit)。体色采用便携色彩色差计(柯尼卡美能达公司, CR400)进行测定, 测定鱼体背部、侧线部和腹部3个部位体色。我们用国际照明委员会[13]的色彩空间概念描述鱼体体色, 根据这个方法, X、Y和Z值代表色彩, 色度仪测量得到的值被描述为亮度值[L*, 变动范围在0(黑色)—100(白色)], 一个色值从红色(a*)到绿色(-a*), 另一个色值从黄色(b*)到蓝色(-b*)[14]。鱼体肌肉品质在物性测试分析仪(TA.XT. Plus, Stable Micro Systems Ltd., Godalming, UK)上采用TPA(Texture Profile Analysis)模式进行分析, 选用P/36R型探头, 测试参数: 测试前中后探头速度保持一致(1 mm/s), 探头两次下压时间间隔为5s, 压缩比率为60%。
1.6 数据处理
实验数据采用SPSS18.0统计软件进行运输前后配对样本T检验, 显著性水平设为P<0.05。数据表示为平均值±标准误(Mean±Standard Error)。
2 结果
2.1 运鱼袋内水质指标
运鱼袋水质检测结果见表 2, 经过4h的模拟公路运输实验, 运鱼袋内水体氨氮浓度显著升高, 由0.18 mg/L上升到6.18 mg/L (P<0.01), pH显著降低,由7.41降低到6.74(P<0.05), 溶氧含量升高(P<0.05)。

表 2 模拟运输对运鱼袋内异育银鲫运输水体中氨氮、pH和溶氧的影响Tab. 2 Effects of simulative transportation on ammonia nitrogen,pH and dissolved oxygen of the water in packing bags of gibel carp
2.2 模拟运输对鱼体血液生理生化的影响
由表 3可知, 经过4h的模拟运输, 异育银鲫血浆中皮质醇、葡萄糖和丙二醛含量显著升高(P<0.01),乳酸浓度显著降低(P<0.01), 谷胱甘肽过氧化物酶活性显著降低(P<0.05), 超氧化物歧化酶活性和过氧化氢酶活性降低但差异不显著(P>0.05)。
2.3 模拟运输对鱼体体色的影响
便携色彩色差计CR400测定结果见表 4。在模拟运输4h后, 异育银鲫背部亮度值(L*)显著降低(P<0.01), 侧线部和腹部的亮度值(L*)呈下降趋势但无显著差异(P>0.05); 模拟运输后黄色值(b*)在背部和侧线部较模拟运输前极显著降低(P<0.01), 在腹部较模拟运输前显著降低(P<0.05); 模拟运输4h后背部、侧线部、腹部红色值(a*)在呈下降趋势但在各部位无显著差异(P>0.05)。
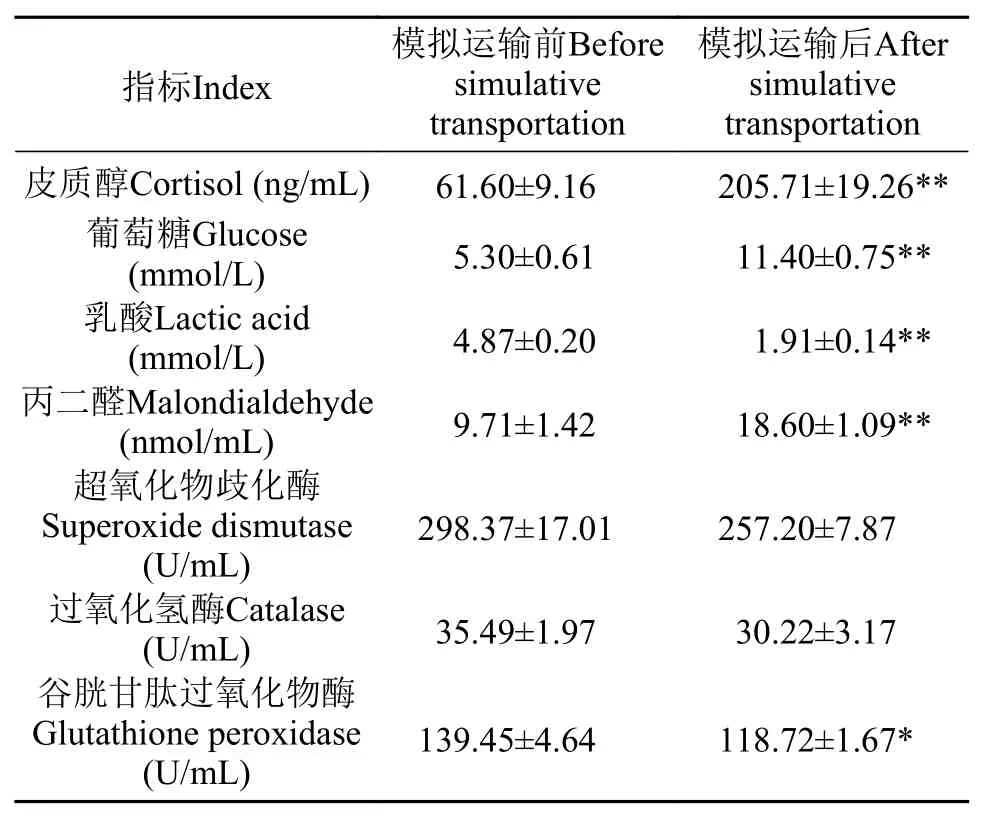
表 3 模拟运输对异育银鲫血浆生理生化指标的影响Tab. 3 Effects of simulative transportation on plasma biochemical indices of gibel carp
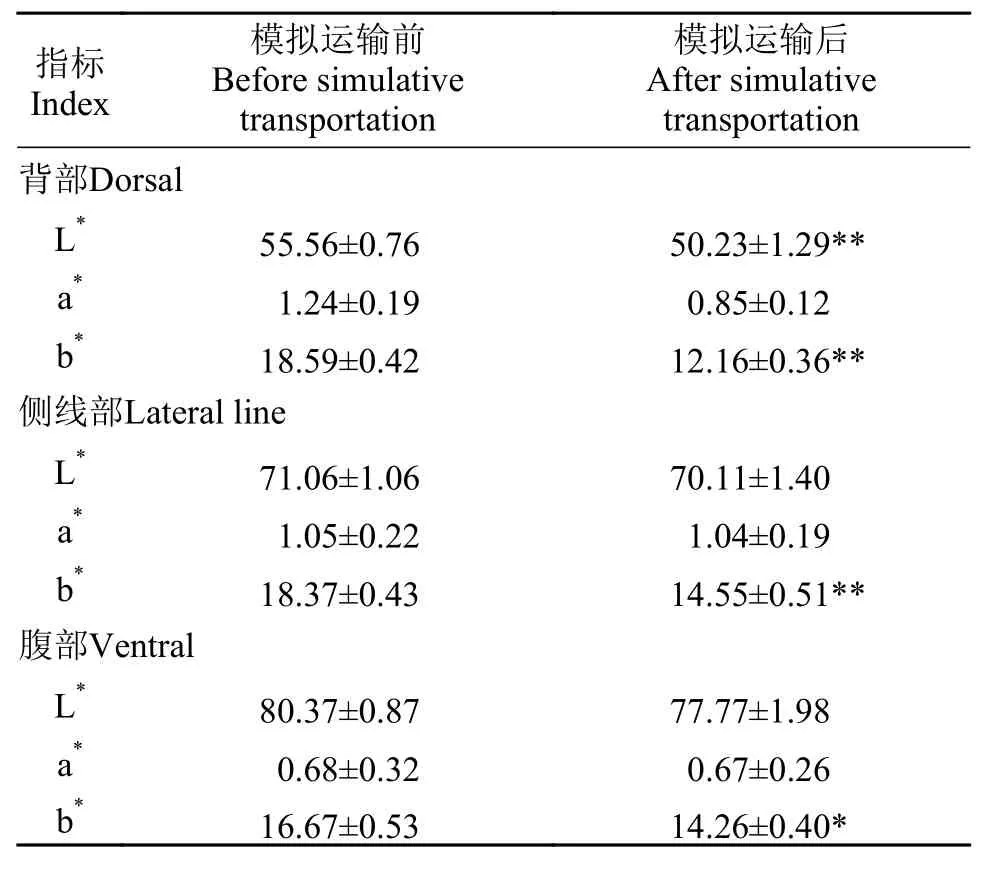
表 4 模拟运输对异育银鲫体色的影响Tab. 4 Effects of simulative transportation on body color of gibel carp
2.4 模拟运输对肉质的影响
表 5为质地实验结果, 异育银鲫模拟运输4h后,背部肌肉内聚性、咀嚼性、回复性均较模拟运输前显著降低(P<0.05), 胶黏性、弹性、黏性较模拟运输前有降低趋势但差异不显著(P>0.05), 而模拟运输后背肌硬度较模拟运输前升高但差异不显著(P>0.05), 模拟运输后肌肉pH较模拟运输前升高(P>0.05)。
3 讨论
3.1 模拟运输对水质的影响
水质是运输过程中影响鱼体健康和存活的重要因素之一, 包括氨氮、pH和溶氧等指标。本研究发现模拟运输4h后袋内的水质下降, 氨氮浓度急剧升高, 由0.18 mg/L上升到6.18 mg/L, pH下降, 由7.41降低到6.74。类似的结果在翘嘴鲌(Culter alburnus)中也有报道, 发现运输2h后水体氨氮急剧升高, 水体pH下降[15]。对黄尾 (Seriola lalandi)进行运输实验, 30min后, 水体游离CO2升到20 mg/L,pH从8.2降到7.2[16]。在模拟草鱼(Ctenopharyngodon idellus)汽车长途运输过程中, 发现水体中氨氮从0.1 mg/L上升到0.6 mg/L, pH从7.5降到6.5[17]。Golombieski等[18]对克林雷氏鲶(Rhamdia quelen)苗种进行运输实验, 运输后打包袋内水体氨氮浓度随运输时间和密度的增加显著上升, 水体溶解氧随运输时间的增加呈现波动变化。本实验中模拟运输后水体溶氧升高可能是摇床效应导致, 在模拟运输过程中水体振荡, 将模拟运输前充入打包袋中的氧气更多地溶解到运输水体中, 因而水体溶氧含量有所升高。青鱼(Mylopharyngodon piceus)[19]、草鱼[20]、鲤(Cyprinus carpio)[21]、鲫(Carassius auratus)[22]的研究表明随着水体氨氮浓度的升高, 会使鱼体产生氨中毒反应, 甚至造成死亡。在本研究中, 模拟运输4h后运输水体氨氮浓度急剧升高, 由0.18 mg/L上升到6.18 mg/L。因此, 在运输过程中要监测水质的变化, 可适时换水和补水降低运输时水质恶化对鱼体的影响。

表 5 模拟运输对异育银鲫肌肉品质的影响Tab. 5 Effects of simulative transportation on fillet quality of gibel carp
3.2 模拟运输对血浆生化指标的影响
模拟运输对血浆应激指标的影响 血浆中皮质醇浓度是反应鱼体应激的重要指标。本实验中, 经过4h模拟运输实验, 血浆中皮质醇的含量显著升高, 这与银鲳(Pampus argenteus)[4]、花狼鱼(Anarhichas minor)[23]、头石脂鲤(Brycon cephalu)[24]、军曹鱼(Rachycentron canadum)[25]和大鳞大麻哈鱼(Oncorhynchus tshawytscha)[26]的研究报道相一致,胁迫会导致皮质醇升高。在鱼体受到应激源刺激时, 下丘脑-垂体-肾间组织轴被激活, 通过一系列促激素和释放激素的级联释放最终使血浆中皮质醇含量显著升高[27]。
血糖也可以作为反应鱼体应激的指标[27]。在本研究中发现, 4h模拟运输实验结束, 血浆中葡萄糖含量显著升高, 这一实验结果与花狼鱼[23]、长江刀鲚(Coilia nasus)[28]、黄子蓝斑鱼(Siganus canaliculatus)[29]、大西洋鲑(Salmo salar)[30]和罗非鱼(Oreochromis niloticus)[31]等的研究结果相一致。研究认为血糖升高的主要原因有2种: 一是应激导致交感-嗜铬组织系统启动, 血液中儿茶酚胺浓度升高, 儿茶酚胺作用于肝脏导致肝糖元分解, 从而使血液中血糖浓度升高; 二是机体受到应激后, 血糖含量随着血浆中皮质醇含量升高而升高[32]。
血浆中的乳酸含量也是反映鱼体应激的重要指标之一。在本研究中, 异育银鲫模拟运输4h后血浆中的乳酸浓度降低, 这和银鲳[4]、大鳞大麻哈鱼[33]和大西洋鲑[30]的研究结果相反, 在他们研究中发现运输胁迫会导致血浆中乳酸含量升高, 这可能是由于鱼类急性应激时肌肉无氧代谢增强导致血浆中乳酸浓度升高。对鲻(Mugil cephalus)进行低氧胁迫, 发现低氧组(1.66±0.41) mg/L血浆乳酸浓度显著高于高氧组(7.03±0.36) mg/L, 这是由于在低氧环境下鱼类不能维持正常的有氧呼吸, 而是进行无氧呼吸, 导致血液中乳酸浓度增加[34]。在本研究中出现不一致的结果可能是与模拟运输后水体溶氧含量为8.73 mg/L高于一般水体溶氧, 鱼体主要进行有氧呼吸有关。
模拟运输对血浆抗氧化指标的影响在正常情况下, 鱼体的抗氧化系统处于动态平衡状态,当鱼体受到胁迫时, 会产生过多的超氧阴离子, 超过抗氧化酶系的处理能力就会对机体造成氧化损伤。丙二醛是脂质过氧化的产物, 它的含量可以反映机体受氧化损伤的程度; 超氧化物歧化酶可清除超氧自由基, 它和过氧化氢酶共同作用可将超氧自由基分解为对机体无害的水[35]; 谷胱甘肽过氧化物酶是机体内广泛存在的一种重要的过氧化物分解酶,有保护生物膜的作用[36]。因此, 测定鱼体内丙二醛含量和超氧化物歧化酶、谷胱甘肽过氧化物酶、过氧化氢酶活力可以反映机体氧化应激情况[37]。
在本实验中, 异育银鲫模拟运输4h后, 血浆中丙二醛含量显著升高, 超氧化物歧化酶、过氧化氢酶和谷胱甘肽过氧化物酶活力降低。在肉鸡中利用外源糖皮质激素导入(注射皮质酮)的方法模拟应激, 引起急性应激, 发现注射后3h肉鸡血浆中丙二醛的含量显著升高[38]。在诱导鲤氧化应激的研究中, 发现血浆中超氧化物歧化酶的活力较对照组极显著降低[39]。在刀鲚[40]和克林雷氏鲶[5]的研究中发现, 运输胁迫导致肝脏过氧化氢酶活力显著降低。谷胱甘肽过氧化物酶活力在黄颡鱼研究中有不一致的结果, 对黄颡鱼公路运输4h后血清谷胱甘肽过氧化物酶活力显著升高, 但随着运输后休息时间的延长, 其谷胱甘肽过氧化物酶活力又恢复到正常水平[41]; 在大鼠经过应激胁迫后肝脏谷胱甘肽过氧化物酶活力呈现上升趋势, 但随着应激时间的延长其活力呈下降趋势, 这可能是在应激状态下, 机体的抗氧化能力出现代偿性加强后又有所降低[42,43]。
3.3 模拟运输对鱼体色的影响
鱼类体色受到遗传因子、环境、水温、光照、背景色、营养因素等的影响[44—46]。在硬骨鱼类中, 色素形成受内分泌和神经调控[47]。本实验研究表明, 异育银鲫模拟运输4h后, 鱼体背部、侧线部和腹部亮度值、黄度值和红色值降低, 鱼体体色变暗。这和Alvander等[13]研究结果一致, 密度胁迫对真鲷(Pagrus pagrus)体色的影响实验结果发现:高密度组(25 kg/m3)体色比低密度组(10 kg/m3)暗,高密度组鱼亮度值L*、色彩浓度[C*=(a*2+b*2)0.5]和色调[(h*=arctan(b*/a*)]均低于低密度组。鱼体体色的变化和应激相关, 鱼体内存在两种主要色素控制激素, 分别是α-黑色素细胞刺激素(α-melanocytestimulating hormone, α-MSH)和黑色素细胞聚集激素(Melanin-concentrating hormone, MCH), 它们具有多效性, 不仅可以控制皮肤色素沉积, 而且还可以调节机体对应激源的响应[48,49]。当鱼体受到应激时, 下丘脑-垂体-肾间组织轴被激活, 诱导α-黑色素细胞刺激素释放增加, 通常, α-黑色素细胞刺激素被认为是影响黑色细胞中黑色素颗粒的分布的主要激素, 从而导致皮肤颜色变暗[49]。黑色素细胞聚集激素由下丘脑释放, 它具有相反作用并导致皮肤颜色苍白, 已证实它的释放受到α-黑色素细胞刺激素的抑制[50]。因此, 模拟运输后鱼体体色变暗有可能是由于黑色素细胞刺激素释放增加导致。
3.4 模拟运输对肉质的影响
本研究发现经过4h的模拟运输后, 代表肌肉品质相关的指标如弹性、内聚性、咀嚼性、回复性、胶黏性、黏性均下降, 这与田兴等[41]的研究结果类似, 在他们的研究中, 黄颡鱼运输4h后其肌肉硬度、弹性、胶黏性、回复性等物性指标显著降低。而在本研究中异育银鲫肌肉硬度在模拟运输后升高, pH升高, 有研究认为肌肉较低pH会引起肌肉质地软化[51], 因此本研究模拟运输后肌肉硬度升高可能是和模拟运输后肌肉pH升高有关, pH升高导致肌肉硬度升高。在肉鸡皮下注射皮质酮引起急性应激, 发现胸肌pH显著降低, 滴水损失有升高的趋势, 造成肌肉品质下降[38]。在猪饲喂高皮质醇饲料(120 mg/kg)7d后, 发现高皮质醇饲料组血浆皮质醇显著升高, 背肌滴水损失增加, 肉色苍白, 导致猪肉品质下降[52]。因此模拟运输后异育银鲫肌肉品质下降可能和血浆皮质醇升高有关。
4 结论
本研究对异育银鲫进行了4h的模拟运输实验,模拟运输后水体氨氮浓度升高, pH下降; 异育银鲫血浆皮质醇和葡萄糖浓度升高, 血浆抗氧化相关酶活性降低; 鱼体亮度值和黄色值降低; 背肌内聚性、咀嚼性和回复性等品质下降。总之, 模拟运输导致运输水体水质下降, 鱼体产生应激反应, 改变了鱼体体色并降低了鱼肉品质。
致谢:
感谢聂光汉老师在实验系统上的帮助。

