端粒生物学异常性疾病的肝脏表现
陈宇星 刘梦 杨玄子 于乐成
1例特殊临床案例,51岁白人男性接受食管胃底静脉曲张出血评估,主要的实验室检查异常是血小板轻度减少和碱性磷酸酶中度升高,而肝脏合成能力完好。腹部计算机断层扫描显示脾脏中度肿大,胃底静脉曲张,而肝脏外形正常。经颈静脉肝活检显示肝脏结节性再生性增生(NRH),无明显肝纤维化或坏死性炎症活动。肝静脉压力梯度(HVPG)高达31 mmHg,与临床显著的门静脉高压一致。并发难治性胃静脉曲张破裂出血,需要外科门体分流手术。首次发病约7年后,患者出现进行性呼吸困难,诊断为特发性肺纤维化(IPF)。对比增强超声心动图不支持肝肺综合征(HPS)或门脉性肺动脉高压。鉴于新诊断,怀疑是端粒生物学异常性疾病(TBD)。应用流式-荧光原位杂交(Flow-FISH)评估端粒长度,发现淋巴细胞和粒细胞的端粒长度均低于第1个百分位数。二代测序分析发现了涉及hTERT基因(组氨酸H 983苏氨酸T)的杂合突变。肺病在其后2年里不断进展,导致患者在首次出现门静脉高压9年后死亡。两兄弟也在这9年内患上了IPF。
一、TBD
端粒是位于线性染色体末端的DNA重复序列,与被称为端粒蛋白复合体(shelterin complex)的特殊蛋白结合,有助于维持染色体的完整性和稳定性(图1)。端粒酶可合成DNA的多个串联重复序列(端粒DNA)。端粒酶由两个核心部分组成,即端粒酶逆转录酶(TERT)和端粒酶RNA(telomerase RNA)。端粒缩短是随着年龄增长而普遍存在的现象,与年龄相关的病理学有关。“端粒维持”对于减缓伴随每次细胞分裂和随后的细胞过早老化而发生的“端粒缩短”至关重要[1]。
TBD是一种加速老化综合征,由缩短的端粒遗传基因突变所致。因此,骨髓、皮肤、肺和胃肠道等细胞周转(turnover)相对活跃的器官系统较易受到影响,其病变可单独或联合出现。由于潜在的临床表征范围广泛,因此TBD常难以识别和诊断。骨髓衰竭、过早发生的肺气肿、IPF、NRH和隐源性肝硬化是较常见的临床表现。角化不良蛋白(dyskerin,DKC1)、TERT和端粒酶RNA组分(TERC)的突变是常见的导致畸变的因素[1]。
端粒由线性染色体末端的多个TTAGGG重复序列组成,被端粒蛋白质复合体(shelterin)包被,有助于维持其完整性。端粒蛋白复合体还有助于募集和调节端粒酶复合物,后者是负责端粒延长的酶。端粒酶有4个蛋白支架,即角化不良蛋白、NOP10、NHP2和GAR,此外还有RNA模板(TERC)和逆转录酶(TERT)。经惠许改编自Townsley等[2]。
二、TBD的肝脏表现
TBD的肝脏表现包括隐源性肝硬化和NRH导致的非硬化性门静脉高压症。对于隐源性肝硬化或特发性门静脉高压症患者应疑及TBD,特别是有原因不明血细胞减少的个人史或家族史、头发早白(<30岁)或IPF/肺气肿,以及40岁以下的患者。由于端粒缩短导致染色体不稳,TBD也可能在肝癌的发生机制中起某种作用。但相反的是,在半数肝细胞癌(HCC)病例中观察到端粒延长和端粒酶高活性,这与低分化肿瘤相关。这些发现提示端粒功能障碍在肿瘤发生和进展中具有双重作用,TBD对肝硬化相关HCC的影响有待进一步研究阐明[1]。
(一)隐源性肝硬化
尽管肝硬化的病因诊断在过去的几十年有了显著进展,但仍有约5%~30%的肝硬化病例难以明确病因。据报道,约7%的先天性角化不良合并隐源性肝硬化。此外,对于肺和肝等慢周转(slow-turnover)的组织器官而言,TBD通常表现为在成人期发病的纤维化疾病。与先天性角化不良相反,TBD相关隐源性肝硬化的平均年龄为37岁(20~57岁)。除了潜在的直接作用,继发于端粒酶基因突变的端粒缩短也能增加患有不同病因的慢性肝病患者进展为肝硬化的风险。两项大型独立研究发现,与非硬化组相比,病因明确的散发性肝硬化患者的端粒相关突变发生率更高[3-4]。此外,采用定量聚合酶链式反应(qPCR)检测显示,肝硬化患者白细胞端粒平均长度显著短于年龄匹配的对照组(0.114对0.001)。80%以上的肝硬化患者的端粒长度低于同龄人群端粒长度的平均数。这些发现表明,即使是潜在性慢性肝病患者,端粒缩短也可能在肝硬化的发生和/或发展中扮演某种作用。

图1 端粒维持的组成
TBD相关性肝硬化的发病机制尚不清楚。通过定量荧光原位杂交(Q-FISH)分析,发现端粒缩短仅限于肝细胞,并且与细胞衰老标记物相关。这些发现提示肝脏再生受损,进而导致纤维化的发生和发展。这种假设在端粒酶缺陷型小鼠模型中得到进一步证实,该模型缺乏必需的端粒酶RNA(mTR)基因,观察到其肝脏再生缺陷和慢性损伤引起的纤维化加速进展。更有趣的是,通过腺病毒载体递送mTR基因以恢复端粒功能,可使肝纤维化减清和肝功能改善。这些结果表明端粒靶向性治疗在预防和逆转TBD相关性肝硬化中可以起到某种作用。
(二)结节再生性增生(NRH)
NRH的特征是弥漫性再生性肝小结节,其周围无纤维化。尽管已知涉及肝脏血流改变,但NRH的发病机制仍不清楚。多种全身性病症和药物治疗与NRH相关(表1),而门静脉闭塞被认为是导致结节性肝实质增生的共同潜在机制。然而,该理论受到一种动物模型的挑战,该模型通过破坏Notch1信号诱导NRH。对成年小鼠诱导Notch1破坏,可致其肝细胞持续增殖和随后的NRH形态学改变,但肝脏中无血管改变。已发现血管内皮Notch1信号传导对于肝脏血管的形成和功能是必需的[5]。有人对14例NRH患者的肝活检组织检查发现Notch1表达显著下降[6]。另外,已报道门静脉硬化和NRH与亚当斯-奥利弗综合征(Adams-Oliver syndrome,AOS)相关,AOS是由Notch1单倍型不足引起的罕见遗传疾病。
一项大型尸检研究显示,NRH的流行随年龄增长而增加,这提示NRH的发病具有年龄依赖性机制。端粒缩短被认为能促进与年龄相关的疾病,并且已报道多例NRH与导致端粒严重缩短的端粒相关突变有关[7]。有趣的是,最近报道了一种Notch1单倍型不足的鼠模型,仅在端粒缩短时出现感兴趣的疾病,并且Notch1突变体疾病的严重程度与端粒长度呈反相关[1]。
此外,先前与再生障碍性贫血和IPF相关的NRH系列病例可能代表了未被识别的TBD病例。在散发性和孤立性NRH病例中,端粒缩短的流行情况尚不清楚。
1. NRH的临床表现和诊断
虽然报道的NRH流行率很低,但由于频繁误诊,其可能被低估了。在早期阶段,NRH患者通常无症状,直到临床上出现明显门静脉高压症。常出现脾脏肿大和胃食管静脉曲张破裂出血。HPS是非硬化性门静脉高压症的另一种可能并发症,在这类人群中发病率为10%。尽管肺纤维化和肺气肿是TBD最常见的肺部表现,但在最近的大型系列病例报道中,与NRH相关的HPS占20%[7]。
NRH在放射影像检查方面很难与肝硬化区分,可能的表现包括肝脏表面结节和肝实质非均质性改变。因此,NRH的明确诊断只能依赖肝组织学检查。但病理学家经验不一,也可能错过NRH诊断。即使在经验丰富的肝脏病理学家,对NRH的组织病理学诊断也存在很大的观察者之间的差异[8]。经常需要对肝组织进行网状蛋白染色以使这些差异得到更明确的显示。

表1 短端粒相关基因和表型[1]
注:AD,常染色体显性遗传;AR,常染色体隐性遗传;NRH,结节再生性增生
2. NRH的自然史和治疗
临床确诊的NRH病例偏向于有严重症状,更多病例被频繁误诊,这使得NRH的长期预后尚难确定。肝移植后病肝病理学研究表明,肝移植前有高达80%的NRH病例在临床和(或)放射影像学上被误诊为肝硬化[1]。肝功能衰竭在这一人群中很少见,与门静脉高压相关的并发症如静脉曲张破裂出血和利尿剂难治性腹水是最常见的肝移植指征。在非硬化性门静脉高压症患者,不进行肝移植的预期存活率很高,10年后约为80%[9]。但另一研究显示,与普通人群相比,这类患者的长期总病死率增加,主要死因是相关的医疗条件而非肝脏相关的并发症。约翰霍普金斯医院报道显示,在确诊TBD的背景下出现NRH和HPS的6例患者,从确诊至死亡的时间平均为6年(4~10年[7])。这组患者较为年轻(平均25岁),伴进行性呼吸道症状和门静脉高压症,后来发展为肺纤维化和难治性腹水。因此,TBD相关性NRH可能比其他病因引起的NRH长期结果差。
目前没有可用于预防或治疗NRH或非肝硬化性门静脉高压的药物,主要针对潜在的病症和门静脉高压相关的并发症进行治疗。临床前模型的缺乏和对本病病理生理学认识的不足阻碍了非硬化性门静脉高压症新药的研发。已提出NRH是肝脏微血管血流改变的结果,因此血管调节疗法可能具有潜在益处。重组人源化单克隆血管内皮生长因子抗体贝伐单抗(Bevacizumab)已被证明可预防转移性结肠癌患者出现继发于奥沙利铂的NRH,贝伐单抗治疗组和非治疗组NRH的发生率分别为11.4%和28.9%。贝伐单抗还可阻止遗传性出血性毛细血管扩张症的肝血管畸形和门静脉高压症的进展[1]。
除NRH外,TBD患者还存在多种其他血管并发症的风险,包括胃窦血管扩张症、胃肠道和肺部动静脉畸形,以及渗出性玻璃体视网膜病变。后者的特征是伴有微动脉瘤样改变、毛细血管扩张和末梢区域无灌注的视网膜脉管系统改变[10]。玻璃体内应用贝伐单抗已常规用于视网膜和脉络膜血管性疾病,包括渗出性玻璃体视网膜病变的治疗。贝伐单抗能否用于预防或治疗TBD患者的NRH和其他血管并发症仍有待探索。
少部分继发于NRH的严重门静脉高压症患者需要肝移植。对17项研究的系统评价显示,NRH潜在肝移植指征包括严重的胃食管出血、腹水、肝性脑病和肝衰竭。肝移植患者和移植肝的5年存活率达到78.3%,令人满意。但TBD患者的肝移植结果尚不清楚。目前仅报道1例TBD成年患者接受肝移植[11]。该患者在隐源性肝硬化的基础上出现进展性HPS,此外还被诊断为间质性肺病(ILD)和骨髓移植后骨髓衰竭。活体肝移植后12个月,患者症状显著改善。随访22个月未发现ILD进展或恶性肿瘤。但尚需更多研究和更长时间的随访来证实这些发现。
三、TBD的诊断
有几种方法可用于测量端粒长度,包括:流式-荧光原位杂交(Flow-FISH)、定量-荧光原位杂交(Q-FISH)、实时定量聚合酶链式反应(qPCR)或基于qPCR的技术(包括单细胞端粒长度测定)、光学技术(表面增强拉曼散射)、杂交保护分析法和端粒限制性片段(TRF)长度分析[1]。尽管尚无一种技术可适用于所有的临床和研究场景,但TRF长度分析被认为是“黄金标准”,这主要是因为其简单性和准确性。然而,由于TRF长度分析需要大量的DNA,因此难以广泛应用。基于qPCR的方法虽然成本低廉,但因实验室之间的检测差异较大而应用受限。
Flow-FISH分析非常准确,使其成为临床实践中评估端粒长度的首选技术。Flow-FISH以荧光探针标记端粒,从而允许应用基于流式细胞术的方法对不同细胞群(例如粒细胞和淋巴细胞)的端粒荧光进行评估。Flow-FISH报道提供了相对于年龄的端粒长度,这很重要,因为端粒损耗是正常老化过程的一部分(图2)。图2A显示一位正常病例淋巴细胞和粒细胞的端粒长度在第50百分位标记处,亦即约与50%的相同年龄正常人群的端粒长度相似。图2B显示某例患者的端粒长度明显缩短,小于第1百分位数。
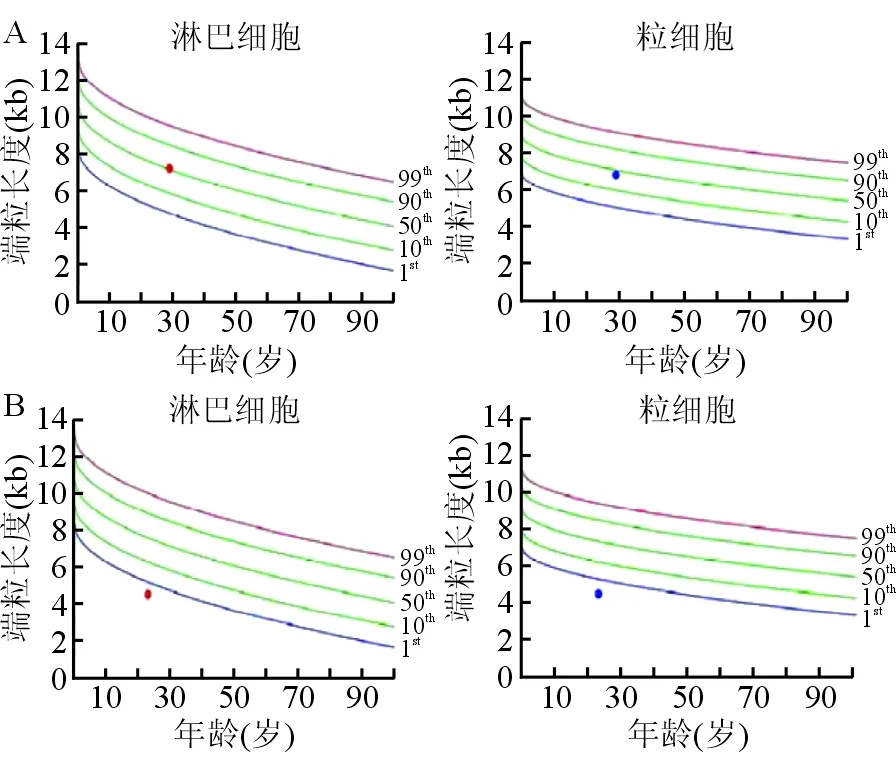
A.显示一位正常病例淋巴细胞和粒细胞在第50百分位标记处的端粒长度(与约50%的相同年龄正常人群的端粒长度相似)。B.显示一例患者的端粒长度小于第1百分位数(与所报道的TBD患者的端粒长度相似)。FISH:荧光原位杂交;TBD:端粒生物学异常性疾病
图2应用Flow-FISH分析端粒长度[1]
端粒相关基因突变分析 多个基因与端粒缩短相关,根据其在端粒生物学中的正常生理作用进行亚分类。遗传方式通常是X-连锁隐性遗传、常染色体显性遗传和常染色体隐性遗传。与端粒酶生物发生相关的基因包括DKC1。端粒核心组成基因包括hTERT、TRRC,而TCAB1(WRAP53)参与端粒酶运输。TINF2、ACD(编码TPP1)是端粒蛋白复合体的一部分。在先天性角化不良中,原型TBD的特征是花边皮疹,毛发和指甲营养不良,口腔黏膜白斑和骨髓衰竭;DKC1是一种参与端粒酶生物合成的、X-连锁隐性基因,其突变是最常见的基因组畸变。其他TBD相关突变,包括hTERT、TERC和TINF2,以常染色体显性遗传方式遗传;而常染色体隐性突变包括NOP10、NHP2和TCAB1(表1)。hTERT和TERC的突变已见诸于再生障碍性贫血、IPF、隐源性肝硬化和NRH的病例报道中(表2)。

表2 文献报道的端粒TBD相关肝病的端粒酶突变[1]
多种靶向外显子组或二代测序组可用于检测临床高度怀疑TBD的患者的潜在致病突变(图3)。无论采用何种方法,只能在约40%的TBD病例中发现潜在的致病突变,这提示有多种尚未发现的基因组和表观遗传学的改变导致了端粒长度的缩短。
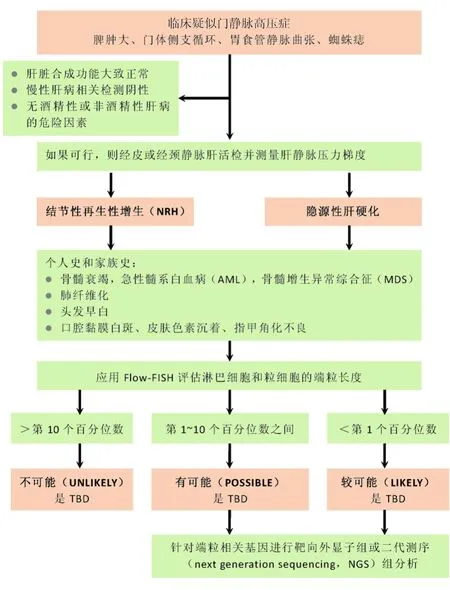
图3 TBD相关肝病的建议评估流程[1]
四、TBD潜在的治疗选择
多年来,在再生障碍性贫血和骨髓衰竭状态(包括骨髓增生异常综合征和骨髓增殖性肿瘤)的患者中试用雄激素治疗取得了一定的成功。体外和体内研究显示雄激素可增加端粒酶基因的表达和活性[1]。
2006年,Townsley等报道了一项I/II期临床试验结果,研究对象为年龄调整的端粒长度小于第1个百分位数或有骨髓衰竭、肺纤维化或两者兼而有之的TBD突变患者27例,口服达那唑800 mg/d。9例患者(33%)有肝硬化,其中6例有临床表现,3例在筛查时获得诊断。使用达那唑12个月后,12/27(44%)的患者端粒长度损耗有所缓解,不良反应包括氨基转移酶升高(41%)、肌肉痉挛(33%)、水肿(26%)和血脂异常(26%)[8]。4例肝硬化患者在基线和24个月时接受肝脏瞬时弹性成像检查,其中3例显示肝纤维化显著消退,第4例有肝硬化进展,但可能与持续过量饮酒有关。该研究使用qPCR技术测量端粒长度,显示达那唑具有减少端粒长度损耗的功能,可能是通过增加端粒酶活性。这一发现尚未得到充分证实,且qPCR技术不够准确。
2014年Khincha等研究显示[12],4例对雄激素治疗有应答的先天性角化不良患者,在基线和雄激素平均治疗2.6年时应用更为敏感的Flow-FISH技术评估淋巴细胞端粒长度,结果显示端粒长度在雄激素治疗后维持稳定或有所缩短;而5例未应用雄激素治疗的患者,端粒长度均随时间延长而缩短。
在肝病患者,使用雄激素治疗的主要问题是有发生药物性肝损伤(DILI)以及加剧液体潴留和电解质异常的风险。此外,雄激素对前列腺有刺激作用,所以应用于有前列腺肥大或前列腺腺癌病史的患者必须谨慎。
由于潜在的DILI风险,雄激素类药物尚未在晚期肝病患者中广泛研究。有一项系统回顾分析纳入5项雄激素类药物治疗酒精性肝炎或肝硬化的随机对照试验[13],涉及氧甲氢龙(oxandrolone)、免微粒化睾酮(micronized-free testosterone)、丙酸睾酮(testosterone propionate)或美替诺龙庚酸酯(methenolone enanthate),结果显示对病死率、肝病相关并发症和肝组织学无明显影响。严重不良事件包括红细胞增多症、门静脉或肝静脉血栓形成、心肌梗死等,发生率为4.6%,而安慰剂对照组为0.9%。
新近一项随机对照试验评估了睾酮对伴有肌肉减少症和低睾酮水平的男性肝硬化患者的益处[14]。睾酮治疗显著增加肌肉质量、骨质量和血红蛋白。睾酮治疗组的病死率有降低趋势(16%对25.5%),尽管未显示统计学意义。重要的是,与安慰剂组相比,睾酮治疗组未出现不良事件的增加。因此,对患有TBD相关性肝病的患者有必要进行精心设计的合成代谢类固醇的治疗研究。NRH患者通常可保持良好的肝功能,肝脏生化指标接近正常。因此,此类患者对雄激素疗法的耐受性可能更好。
TBD具有广泛的临床疾病谱。通过研究隐源性肝硬化或NRH,特别是那些与骨髓衰竭或IPF相关的患者,对TBD有了更多认识。但TBD相关性肝病患者大多可能未得到诊断,故其真实流行率高于当前报道。今后需深入阐明TBD相关性肝病的病理生理学,并探讨合成代谢类固醇对这部分患者的作用。

