紫花苜蓿高温诱导启动子pMsMBF1c的克隆与功能分析
李小冬,莫本田,牟琼,娄芬,陈文贵,陈光吉,张瑜,韩永芬*
(1.贵州省农业科学院草业研究所,贵州 贵阳 550006;2.贵州金农富平生态农牧科技有限公司,贵州 松桃 554100;3.大方县农牧局,贵州 大方 551600)
高等植物的基因行使其功能受到复杂而精细的调控,按照调控时间的先后顺序可分为转录前调控、转录调控、转录后调控、翻译调控和翻译后调控几个主要阶段[1]。启动子是基因转录前调控的主要元件,通过对下游基因表达时期与表达量的调节,决定植物完成特殊生长发育阶段的转变或应答特殊环境胁迫[2]。
按照转录启动方式可以将启动子分为组成型、组织特异型和诱导型启动子[3],但彼此之间可能有重叠,例如,果实特异启动子同时也有可能是乙烯诱导型启动子,因为其上游区域可能存在多个顺式作用元件,能够与多种不同的反式作用因子相互作用[4],特异性启动子与诱导型启动子能根据植物特殊生长发育阶段或特殊环境应激启动相应基因表达,能够实现精准高效的调控,在基因功能研究与农业分子育种中有巨大的应用潜力,目前研究较多的有光诱导[5-6]、温度诱导[7-9]、干旱诱导[10]、激素诱导[11]、伤害诱导型启动子[12]等,并且已经成功的在烟草(Nicotianatabacum)、玉米(Zeamays)、水稻(Oryzasativa)等农作物中培育了诱导型启动子驱动的抗逆种质资源。
热激转录因子Hsf与热激蛋白Hsp是植物中重要的高温诱导基因,其启动子结构比较保守,在模式植物拟南芥(Arabidopsisthaliana)中,热激转录因子Hsf与其下游基因Hsp启动子区都存在HSE模体(AGAAnnTTCT),并且21个Hsf中除HsfA4c和HsfA8外,其余都被报道参与抗热反应[13]。多桥蛋白因子(MBF1)是动植物中高度保守的转录共激活子,在植物中,MBF1c参与高温胁迫应答,并显著受热诱导[14]。MBF1c蛋白具有DNA结合的能力,能够调节DREB2A、HsfA3、HsfB2a以及HsfB2b等基因的表达[14-15],并且其抗热反应受水杨酸和乙烯等多条激素途径调节,是连接Hsf-Hsp途径和激素途径的中枢基因,然而关于MBF1c启动子的研究报道还很少。研究并开发利用其启动子为丰富高温诱导型启动子库具有重要的理论研究与实际应用价值。
1 材料与方法
1.1 材料
本研究采用的紫花苜蓿材料为“中苜1号”(Medicagosativacv.Zhongmu 1#),由中国农业科学院北京畜牧兽医研究所高洪文团队馈赠),拟南芥为哥伦比亚型野生型,拟南芥与紫花苜蓿种植条件参考Li等[16]的方法,植物生长温度为22 ℃,相对湿度为60%,光周期为16 h光照/8 h黑暗,光照强度为230~300 μE·m-2·s-1,在人工智能气候室中进行,试验时间为2014-2017年。
1.2 方法
1.2.1紫花苜蓿DNA提取 称取1 g新鲜“中苜1号”紫花苜蓿叶片,用液氮研磨成粉末,加入1 mL 65 ℃预热的2% CTAB提取缓冲液(2% CTAB,20 mmol·L-1EDTA,100 mmol·L-1Tris-HCl, 1.4 mol·L-1NaCl),65 ℃孵育1 h,12000 r·min-1离心10 min,将800 μL上清转移到新离心管;加入200 μL氯仿,震荡萃取30 min,12000 r·min-1离心10 min,将600 μL上清液转移到新离心管;加入1 mL预冷的无水乙醇,-20 ℃孵育1 h,12000 r·min-1离心10 min,加入700 μL 75%的乙醇,10000 r·min-1离心5 min,弃上清,通风厨中沥干沉淀,加入50 μL dd H2O溶解备用。
1.2.2紫花苜蓿MsMBF1c启动子序列的分离克隆 采用基于巢式PCR的酶切连接技术分离MsMBF1c启动子序列,具体操作如下:1) 合成接头引物:AF 5′-GTAATACGACTCACTATAGGGCACGCGTGGT-3′,AER (EcoRⅠ) 5′-AATTACCACGCGTGCTG-3′,AHR (HindⅢ) 5′-AGCTACCACGCGTGCTG-3′, ABR (BamHⅠ/BglⅡ) 5′-GATCACCACGCGTGCTG-3′,AXR (XhoⅠ) 5′-TCGAACCACGCGTGCTG-3′,APR (blunt-ended) 5′-ACCACGCGTGCTG-3′; 2) 制备接头:在PCR仪中进行,采用梯度变性退火方法制备,每一种内切酶对应一种接头,体系如下:取AF (10 μmol·L-1) 10 μL,A*R (10 μmol·L-1) 10 μL (A*R指AER、AHR、ABR、AXR、APR等5条反向引物中的一条),混合均匀,进行接头制备反应,反应程序如下:94 ℃ 3 min,70 ℃ 10 min,60 ℃ 10 min,50 ℃ 10 min,30 ℃ 10 min,25 ℃ 10 min,结束连接,接头制备完成。
采用EcoRⅠ、BamHⅠ、HindⅢ、XhoⅠ、SmaⅠ (Fermentas)分别酶切苜蓿基因组DNA,酶切反应体系如下:紫花苜蓿基因组DNA 2 μL,10×酶切反应缓冲液1 μL,限制性内切酶 0.5 μL,dd H2O 6.5 μL,37 ℃酶切0.5~2.0 h。酶切反应完后进行连接反应,体系如下:酶切反应样品 10 μL,连接接头1 μL,10×连接反应缓冲液 2 μL,T4 DNA连接酶 1 μL,dd H2O 6 μL,4 ℃连接16 h。
巢式PCR扩增,引物序列如下:AD1,5′-GTAATACGACTCACTATAGGGC-3′,AD2,5′-ACTATAGGGCACGCGTGGT-3′,MBFR1,5′-TAGTTTTAGGGATTAGGAGC-3′,MBFR2,5′-GTTGACGGCTT TCTCATCTT-3′,MBFR3,5′-TTCTTGCGGATAACGACTGG-3′。以稀释20~50倍的酶切连接产物为模板,以AD1与MBFR1为引物,配置PCR反应混合物(上海生工 2×Taq PCR反应试剂盒),反应体系如下: 2×Taq PCR Mixture 10 μL,AD1 (10 μmol·L-1) 1 μL, MBFR1 (10 μmol·L-1) 1 μL,模板 2 μL,dd H2O 6 μL。反应程序为:94 ℃ 3 min,94 ℃ 30 s,72 ℃ 3 min,7个循环,94 ℃ 30 s,68 ℃ 3 min,32个循环,72 ℃ 5 min,25 ℃ 5 min,反应结束。以稀释50~100倍的第一轮PCR产物为模板,进行第二轮巢式PCR扩增,引物组合为AD2与MBFR2,反应程序为:94 ℃ 3 min,94 ℃ 30 s,72 ℃ 3 min,5个循环,94 ℃ 30 s,68 ℃ 3 min,25个循环,72 ℃ 5 min,25 ℃ 5 min,反应结束。第三轮巢式PCR引物组合为AD2与MBFR3,反应体系与程序与第二轮相同。
分别取第二轮与第三轮巢式PCR产物进行水平胶电泳,将第二轮与第三轮都有明显扩增,且第三轮产物略小于(43 bp)第二轮的条带进行回收(上海生工胶回收试剂盒),参照试剂盒说明书,得到的序列即为MsMBF1c侧翼序列的候选序列。
1.2.3pBI21-pMsMBF1c::GUS双元载体的构建 利用巢式PCR测序的结果设计引物:pMBF1cF 5′-AAGCTTAATGAATTTAAGTGG-3′,pMBF1cR 5′-GTTTATCTCTTTGGTTATG-3′,采用phusion DNA聚合酶(Thermo)进行扩增,反应体系如下:10×buffer,2 μL;dNTP mix,0.5 μL;MgCl2,1.5 μL;pMBF1cF,1 μL;pMBF1cR,1 μL;DNA模板,2 μL;DNA Polymerase,0.2 μL;dd H2O,12 μL。程序如下:95 ℃ 1 min,95 ℃ 10 s,58 ℃ 10 s,72 ℃ 1 min,30个循环,72 ℃ 5 min,25 ℃ 5 min。将回收产物连接到pEASY-Blunt克隆载体(pEASY-Blunt Cloning Kit,Transgene)并进行测序分析,提取pEASY-MsMBF1c载体质粒,与pBI121载体一起,分别利用HindⅢ与BamHⅠ双酶切,回收线性化的pBI121载体片段和MsMBF1c片段, 用T4连接酶(Fermentas)连接成pBI21-pMsMBF1c::GUS双元载体,具体操作参照试剂盒说明书。
1.2.4RNA的提取及反转录 称取100 mg新鲜“中苜1号”紫花苜蓿叶片或拟南芥叶片,用液氮研磨成粉末,采用TRIZOLTMKit RNA提取试剂(Invitrogen,USA)提取总RNA。采用RevertAid H Minus First Strand cDNA Synthesis Kit (Fermentas) 反转录cDNA 第一链,参照试剂盒说明进行操作。
1.2.5pBI21-pMsMBF1c::GUS拟南芥转化与转基因拟南芥筛选 拟南芥转化与筛选参考文献[17],其操作方法如下:将活化的农杆菌悬浮于新鲜配置的5%蔗糖诱导培养基中[10 g 蔗糖充分溶解于200 mL蒸馏水中,在转化之前加入20 μL Silwet L-77(上海生工)]。去除处于盛花期野生型拟南芥的花和角果,将其浸泡在悬浮菌液中30 s,收取转基因种子,并利用卡那霉素抗生素筛选,并以卡那霉素抗性基因以及MsMBF1c正向引物与GUS反向进行分子鉴定。具体操作如下:首先将转基因的种子用75%乙醇表面消毒1 min,用50% 84消毒液消毒3 min,然后用无菌水清洗种子3~4次,将消毒好的种子均匀铺布于1/2 MS+300 mg·L-1特美汀+ 50 mg·L-1卡那霉素培养基中,在人工气候室中筛选15~30 d,挑选绿色健壮的植株移栽到营养土中备用。采用天根植物DNA提取试剂盒(DP305)提取转基因与野生型拟南芥的新鲜叶片组织的DNA,程序方法参照试剂盒说明书。利用NPTF+NPTR和pMBF1cF+GUSR两个引物组合分别对转基因植物进行PCR 鉴定(上海生工 2×Taq PCR反应试剂盒),引物序列为NPTF:5′-GAGGCTATTCGGCTATGACTG-3′,NPTR:5′-ATCGGGAGCGGCGATACCGTA-3′,GUSR:5′-GCCCACAGGCCGTCGAGT-3′。反应体系如下:2×Taq PCR Mixture,10 μL;正向引物,1 μL;反向引物,1 μL;DNA,2 μL;dd H2O,6 μL。混匀后进行PCR扩增反应,NPTF+NPTR程序如下:94 ℃ 3 min,94 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,30个循环,72 ℃ 5 min,25 ℃ 5 min。pMBF1cF+GUSR程序如下:94 ℃ 3 min,94 ℃ 30 s,58 ℃ 30 s,72 ℃ 2 min,30个循环,72 ℃ 5 min,25 ℃ 5 min。分别取8 μL PCR产物电泳检测,挑选阳性植株用于表型考察与表达分析。
1.2.6高温胁迫处理 采用1.2.5表面消毒方法消毒转基因以及野生型拟南芥,并分别播种到1/2 MS培养基上,室温生长7 d,对照组一直置于22 ℃培养箱中生长,处理组采用浸入法将培养皿置于42 ℃水浴锅中热处理1 h后分别取样进行GUS染色和热诱导表达分析,取3个独立的株系,每个株系处理30个植株。
1.2.7GUS染色分析 将正常与高温处理之后的转基因以及野生型拟南芥置于新鲜配置的GUS染色液中37 ℃染色2 h,用75%的乙醇脱色3~5次至背景色为白色,在相同曝光条件下,比较各材料GUS染色强度来判断启动子是否受诱导。
1.2.8荧光定量分析 RNA提取及反转录参照1.2.4的方法,采用GoTaq Real-Time PCR Systems (Promega,A6001)检测pMBF1c:GUS与野生型拟南芥中GUS基因以及AtMBF1c基因在正常以及高温诱导条件下的表达,引物组合为:qGUSF,5′-CGGTCAGTGGCAGTGAAGGG-3′与qGUSR,5′-CGAGGTACGGTAGGAGTTGG-3′,AtMBF1c基因:qAtMBF1cF,5′-TGCCGAGCAGATACCCAGGAGC-3′;qAtMBF1cR,5′-TAACCGTTTGAACCGCGACACC-3′,内参基因为Actin2,引物组合为Actin2 F,5′-AGCGCTGAGGCTGATGATATTCAAC-3′,Actin2 R 5′-TCTAGAAACATTTTCTGTGAACGATTC-3′,操作方法按照试剂盒说明书,反应程序为94 ℃ 2 min,94 ℃ 15 s,58 ℃ 15 s,72 ℃ 30 s,读取荧光信号,45个循环,72 ℃ 5 min,25 ℃ 5 min。采用2-ΔΔct方法分析GUS和AtMBF1c的表达变化,每个样品3个生物学重复,每个生物学重复3个技术重复。
1.3 数据分析
采用Excel 2010分析实验数据,采用t测验分析表达差异显著性,阈值设为P<0.05,采用Excel 2010与Power Point 2010作图。
2 结果与分析
2.1 紫花苜蓿MsMBF1c侧翼序列的克隆与分析
紫花苜蓿是草牧业与生物固氮领域的重要农作物之一。其同源种蒺藜苜蓿(Medicagotruncatula)作为豆科牧草的模式植物,基因组已经完成。然而由于紫花苜蓿异源四倍体的基因组特点,其基因组的研究仍相对滞后。本研究前期通过同源克隆的方法从紫花苜蓿基因组克隆获得MsMBF1c基因,并发现其显著受高温诱导,然而其启动子序列仍未知。借鉴染色体步移技术方法,采用酶切连接的方法利用EcoRⅠ、BamHⅠ、HindⅢ、XhoⅠ、SmaⅠ酶切紫花苜基因组DNA,并用相应接头连接后形成扩增模板。根据已知的MsMBF1c编码序列和接头序列信息设计了2对巢式PCR引物,经过两轮巢式PCR扩增,获得MsMBF1c的侧翼序列片段,回收在第一轮与第二轮PCR反应中都有扩增,且第二轮PCR产物略小于第一轮产物的片段(图1),测序分析获得侧翼序列信息。
2.2 MsMBF1c启动子序列结构与生物信息学分析
利用Sequencer 4.0将分离侧翼序列的测序结果与MsMBF1c基因进行比对,获得一条与MsMBF1c序列有重叠的1748 bp片段,采用PlantCARE软件(Plant Cis-Acting Regulatory Element, http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)与AGRIS软件(The Arabidopsis Gene Regulatory Information Server,http://agris-knowledgebase.org/)对该序列结构预测发现,MsMBF1c的启动子有植物耐热、抗旱、ABA信号传导以及环境胁迫紧密相关模体(表1),说明MsMBF1c可能参与植物耐热等环境胁迫应答。已经将该序列上传到GeneBank数据库,其登录号为:MH760587。
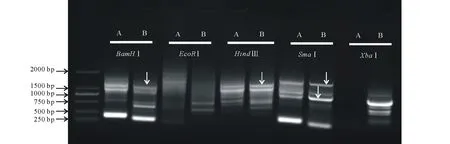
图1 MsMBF1c启动子序列的分离Fig.1 Isolation of the promoter sequence of MsMBF1c 每一个横线指示一种酶切连接方法。A:第一轮巢式PCR电泳结果;B:第二轮巢式PCR电泳结果。箭头表示回收用于测序分析的候选启动子片段。Every horizontal line stands for a digest-ligation method. A: The results of electrophoresis of the first round of nested-PCR; B: The results of electrophoresis of the second round of nested-PCR. The arrowhead indicate the potential promoter fragments recycled for sequence analysis.
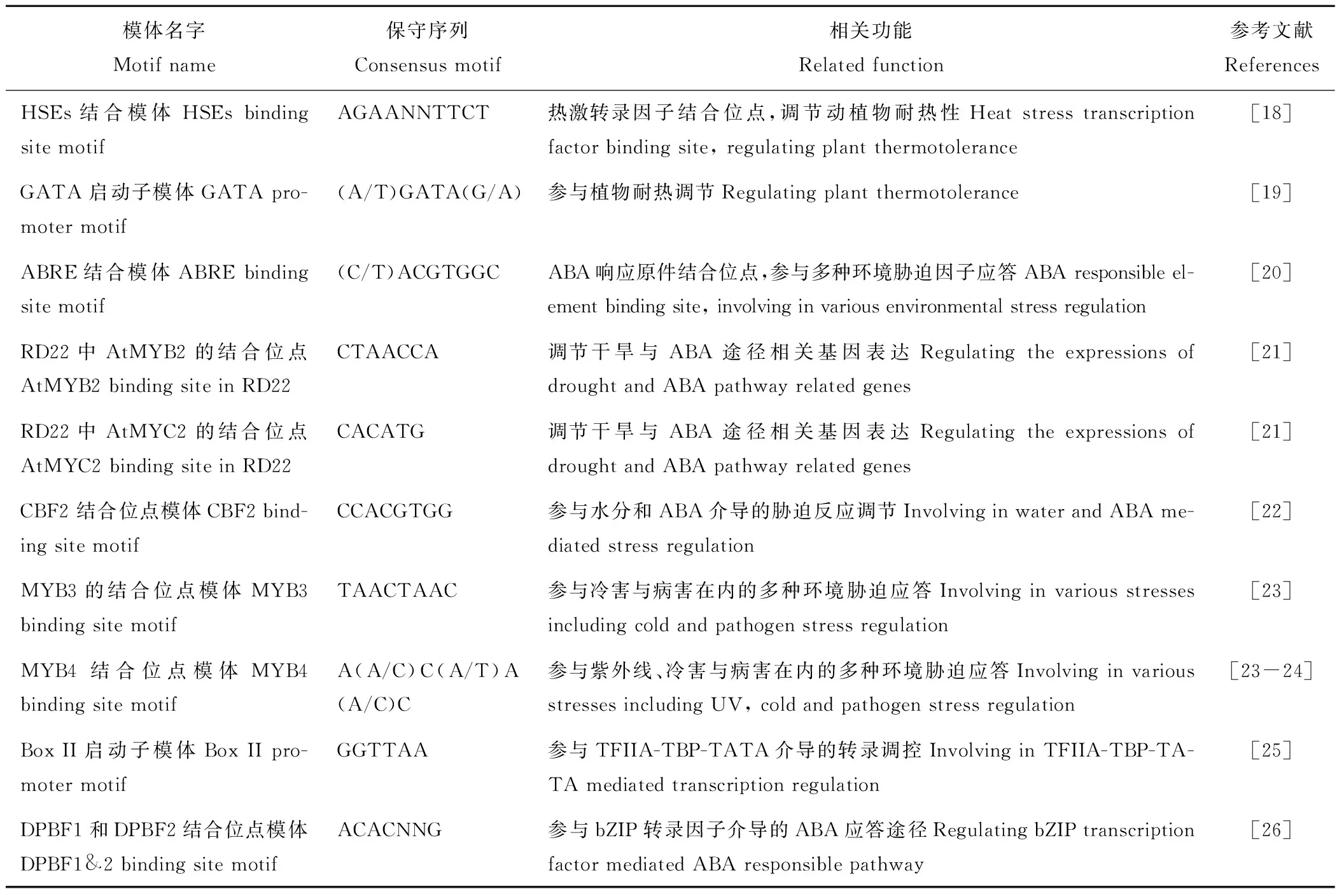
模体名字 Motif name保守序列Consensus motif相关功能Related function参考文献ReferencesHSEs结合模体HSEs binding site motifAGAANNTTCT热激转录因子结合位点,调节动植物耐热性Heat stress transcription factor binding site, regulating plant thermotolerance[18]GATA 启动子模体GATA pro-moter motif(A/T)GATA(G/A)参与植物耐热调节Regulating plant thermotolerance[19]ABRE结合模体ABRE binding site motif(C/T)ACGTGGCABA响应原件结合位点,参与多种环境胁迫因子应答ABA responsible el-ement binding site, involving in various environmental stress regulation[20]RD22中AtMYB2的结合位点AtMYB2 binding site in RD22CTAACCA调节干旱与ABA途径相关基因表达Regulating the expressions of drought and ABA pathway related genes[21]RD22中AtMYC2的结合位点AtMYC2 binding site in RD22CACATG调节干旱与ABA途径相关基因表达Regulating the expressions of drought and ABA pathway related genes[21]CBF2 结合位点模体CBF2 bind-ing site motifCCACGTGG参与水分和ABA介导的胁迫反应调节Involving in water and ABA me-diated stress regulation[22]MYB3的结合位点模体MYB3 binding site motifTAACTAAC参与冷害与病害在内的多种环境胁迫应答Involving in various stresses including cold and pathogen stress regulation[23]MYB4 结合位点模体MYB4 binding site motifA(A/C)C(A/T)A(A/C)C参与紫外线、冷害与病害在内的多种环境胁迫应答Involving in various stresses including UV, cold and pathogen stress regulation[23-24]Box II启动子模体Box II pro-moter motifGGTTAA参与TFIIA-TBP-TATA介导的转录调控Involving in TFIIA-TBP-TA-TA mediated transcription regulation[25]DPBF1和DPBF2结合位点模体DPBF1&2 binding site motifACACNNG参与bZIP转录因子介导的ABA应答途径Regulating bZIP transcription factor mediated ABA responsible pathway[26]
2.3 MsMBF1c启动子克隆与遗传转化
根据测序结果设计引物,克隆获得MsMBF1c启动子全长序列,利用HindⅢ与BamHⅠ限制性酶切外源片段与pBI121载体,并进行连接,获得pBI121-pMsMBF1c::GUS双元载体。采用农杆菌介导的花器官转化法将pBI121-pMsMBF1c::GUS双元载体转化野生型拟南芥,以50 mg·L-1的卡那霉素进行筛选,共获得了24株阳性转基因植株,分别采用抗性基因NPTF+NPTR与基因特异引物pMsMBF1cF+GUSR组合检测转基因植株。24株植株用抗性基因检测呈阳性,其中,20株植株用基因特异引物检测呈阳性(图2)。
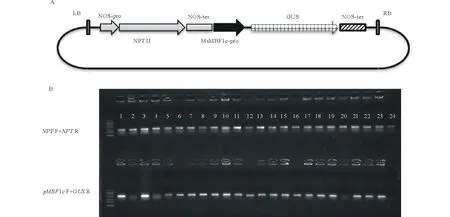
图2 pBI121-pMsMBF1c::GUS双元载体构建与转基因拟南芥分子鉴定Fig.2 pBI121-pMsMBF1c::GUS vector construction and detection of positive transgenic Arabidopsis plants A:pMsMBF1c-GUS报告基因表达载体示意图;B:转基因拟南芥分子检测示意图,上排为抗性基因检测(NPT),下排为基因特异性引物检测(pMBF1c F+GUS R)。A: A diagram showing pBI121-pMsMBF1c::GUS reporter vector; B: Results of molecular detections of transgenic Arabidopsis, antibiotic resistant gene premiers were showed in the upper line (NPT F+NPT R) and the gene specific premiers were showed in the down line (pMBF1c F+GUS R).
2.4 MsMBF1c热诱导表达分析
为进一步验证pMsMBF1c启动子的功能,本研究分析了正常与高温条件下野生型拟南芥与pBI121-pMsMBF1c::GUS转基因植株(抗性及特异性分子鉴定为阳性的植株)中GUS基因与内源的AtMBF1c的表达变化。在正常条件下,野生型与pBI121-pMsMBF1c::GUS转基因植株中AtMBF1c的表达基本相当,而在高温胁迫后,AtMBF1c基因的表达都显著被诱导,并且诱导程度相似,分别上升了3.9与4.8倍。在正常以及热诱导条件下的野生型中都没有检测到GUS基因的表达,而在pBI121-pMsMBF1c::GUS转基因植株中,GUS基因显著受热诱导,与正常条件相比,表达量增加了5.4倍(图3)。
2.5 MsMBF1c启动子热诱导GUS染色分析
动植物中MBF1家族基因的功能与耐逆性尤其与耐热调节显著相关,挑选3个独立的转pBI121-pMsMBF1c::GUS株系与野生型拟南芥一起,采用β-葡萄糖醛酸糖苷酶(β-glucuronidase,GUS) 组织化学染色分析其在正常与42 ℃高温诱导后的表达变化。在正常和高温诱导条件下,野生型均不能被染色(无GUS基因表达)。在正常条件下, 3个pBI121-pMsMBF1c::GUS转基因植株呈淡蓝色,pMsMBF1c启动子低丰度驱动GUS表达,42 ℃高温处理1 h后,3个pBI121-pMsMBF1c::GUS植株呈深蓝色,说明pMsMBF1c启动子显著受高温诱导,驱动下游报告基因GUS的表达(图4)。
3 讨论
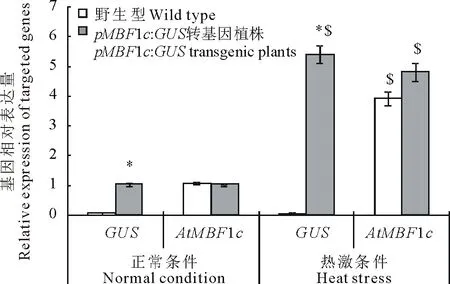
图3 AtMBF1c与GUS报告基因在正常与高温胁迫条件下的野生型及转基因拟南芥中的表达变化分析Fig.3 Expression analysis of AtMBF1c and GUS, the reporter gene, in wild type and transgenic Arabidopsis plants 每个样品3个生物学重复, Actin 7为内参基因, *表示转基因植物与野生型之间差异在P<0.05达显著水平,$表示相同材料在正常和热激条件下差异在P<0.05达显著水平。Each sample had 3 biological repeats, Actin 7 were used as an internal reference, *stands for a significant difference at P<0.05 between different materials (wild type and transgenic plants), while $ stands for a significant difference at P<0.05 between different treatment (normal and high temperature stress conditions) within the same material.
植物为光合自养型生物,不能像动物那样采取移动的方式来应对不利的环境胁迫,因此需要通过调节不同基因的表达以提高自身的适应性[27]。植物基因的表达是由不同启动子驱动,可以分为组成型、组织特异型和诱导型等几种,根据生长发育和应对胁迫需要,选择性的启动或关闭基因的表达,节约植物新陈代谢所需的能量[1]。在模式植物拟南芥[15, 28]与小麦(Triticumaestivum)[29]等农作物中,MBF家族基因都被报道能够参与植物耐热调节,然而还没有对该基因的启动子进行研究的报道,因此本研究对紫花苜蓿MsMBF1c的启动子的热诱导性进行系统研究,为更好的利用MBF基因进行耐热性改良奠定基础。
植物耐热调控网络已经有了很好的研究,前人建立了一个以HSF-HSP为核心的耐热调控网络[18]。其中受HSF调节的基因在其启动子区域都存在一个核心的保守顺式作用元件HSE[13]。在MsMBF1c启动子序列中,发现了该功能保守的元件,说明MsMBF1c可能受HSF直接作用参与植物耐热调节,最近在匍匐剪股颖(Agrostisscabra)耐热转录组中,HSF、HSP与MBF1基因都显著受热诱导[30],能够从侧面印证本研究的推论。除了HSF-HSP调控网络外,植物耐热途径还存在第二信使途径、植物激素调节途径以及其他调解途径等,这些途径之间相互独立,但也通过一些关键基因相互链接到一起[31]。最近的研究发现GATA启动子模体能够参与植物耐热调节[19],在MsMBF1c启动子序列中共有3个拷贝的GATA启动子模体,说明MsMBF1c的表达可能受耐热核心基因HSF与GATA相关途径的耐热相关基因的共同调节,前人研究发现HSP70能够通过GATA途径调控紫杉醇诱导的细胞程序死亡[32],而HSP70也是耐热调节途径的关键基因[33]。
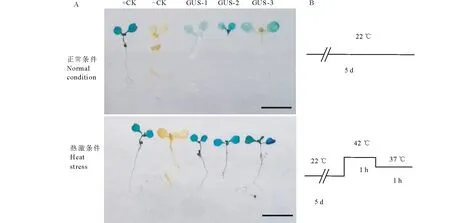
图4 GUS染色显示高温诱导MsMBF1c启动子驱动报告基因表达Fig.4 GUS staining of pBI121-MsMBF1c::GUS transgenic plants showed the MsMBF1c promoter could be induced by high temperature A:pBI121-MsMBF1c::GUS转基因植物在正常与高温条件下报告基因GUS染色结果;B:正常与高温处理示意图。+CK: pBI121空载体;-CK: 野生型拟南芥;GUS-1,-2,-3:pBI121-MsMBF1c::GUS转基因株系-1,-2,-3, 标尺=5 mm。A: GUS staining of pBI121-MsMBF1c::GUS transgenic plants under normal and high temperature conditions; B: A diagram showing the normal and high temperature stress conditions. +CK: pBI121 vector; -CK: Wild type Arabidopsis seedlings; GUS-1,-2,-3: pBI121-MsMBF1c::GUS transgenic plants -1,-2,-3, bars=5 mm.
MBF1c基因不仅能显著受高温诱导,而且在部分植物中已经被应用于耐热性改良[14]。本研究采用荧光定量的方法分析了pBI121-MsMBF1c::GUS转基因株系和野生型拟南芥中AtMBF1c的表达也能显著受高温诱导,与前人的结果一致[34]。荧光定量表达分析MsMBF1c启动子的热诱导性发现高温条件下GUS的表达也显著的高于正常条件(图3),组织化学染色(GUS)印证了荧光定量PCR的结果(图4)。
植物耐逆调控网络一直都是植物育种与植物功能基因组研究的热点,并已发现一批功能保守的转录因子,它们具有多种功能能够调节植物耐逆性,这些转录因子是连接其他转录调控因子、植物激素等信号分子与功能基因的桥梁与纽带[35],例如MBF家族基因。小麦的TaMBF1c能够促进水稻和酵母的耐热性[29]。水稻MBF1不仅能够调节植物营养生长与渗透胁迫,而且还参与水稻抗稻瘟病调节[36]。南极洲苔藓(Polytrichichastrumalpinum)MBF1c基因能显著增强拟南芥对高盐胁迫的耐受性[37],然而在牧草类作物中,还没有关于MBF参与其他耐逆性的报道。本研究中,在MsMBF1c启动子中共发现了5个ABA应答元件(ABRE、MYB2、MIC2、CBF与DPBF),分别参与干旱(水分调节)等环境胁迫调节反应,说明MsMBF1c可能参与了ABA介导的植物耐逆性调节。因为ABA是植物耐逆调控的关键激素之一,特别是在抗旱反应中对气孔的开闭起到至关重要的作用[38]。此外,在MsMBF1c启动子中还发现了MYB3与MYB4两个参与冷害与病害调节顺式作用元件,说明MsMBF1c除了参与抗旱耐热反应外,还可能参与其他耐逆性调节。
4 结论
在无参考基因组信息的作物中,酶切连接是一个经济有效的获取已知序列侧翼序列的方法,对小宗农作物重要基因启动子序列的获得与功能分析有重要促进作用。紫花苜蓿MsMBF1c启动子序列中有多个保守的参与植物耐热调节及其他抗逆调节的顺式作用元件,其可能是紫花苜蓿耐逆(热)调节的关键作用因子。从生物信息分析、基因表达分析与组织化学染色等多个角度说明MsMBF1c启动子能显著受高温诱导激活,因此可作为高温诱导型启动子用于科研与生产实践。

