脉冲强光处理对菜籽油品质的影响
周婷婷 曹少谦 李丝丝 戚向阳
(浙江万里学院生物与环境学院,宁波 315100)
菜籽油是我国主要食用植物油来源[1],丰富的不饱和脂肪酸[2]及多酚[3]、生育酚[4]等微量化合物对油脂品质具有重要影响。植物油的营养品质和抗氧化能力主要取决于自身脂肪酸组成[5];多酚具有抗癌、抗氧化、降血脂等多种生理功能[6],少部分在制油后转移到油中[3]作为天然抗氧化剂;生育酚在植物油中亦能发挥优良的抗氧化作用[7],其中α-生育酚活性最高[8],对人体抗衰老、提高免疫力、生殖功能和细胞代谢等均有影响[9]。油脂氧化受到脂肪酸组成、抗氧化剂和微量成分等的影响[1],若能在富含油脂食品的加工中降低这些成分的损失来提高食品品质具有重要的现实意义。
传统热加工易引起食品色泽、风味、质地及营养成分的变化,为了满足现代消费者对食品品质的需求,各种非热加工技术成为相关领域研究的热点,IPL就是其中的新型非热物理杀菌技术之一。IPL是一种高强度、瞬时的广波谱“白光”[10-11],可实现食品表面、包装材料和加工设备等的快速杀菌[12]。IPL处理由于其瞬时性可大幅提高生产效率,降低能源成本,且对环境影响小,有较广的应用范围。IPL技术具有良好的杀菌效果[13-15],能最大限度保持食品天然品质,但由于其每秒激发的光强度相当于太阳光到达海平面的20 000 倍[10],仍会引起食品中的敏感成分发生变化,其中脂质成分就易受IPL的影响发生氧化,而目前国内外学者对IPL处理食品时引起的脂质氧化鲜见报道。马凤鸣等[16]、戚向阳等[17]、Rajkovic等[18]、Nicorescu等[19]在各自脉冲参数下对脂质的影响已有相关报道,但他们的研究大多侧重IPL处理对油脂氧化本身的影响,并未考虑食品中其他内源性成分的变化对油脂品质的影响。因此,本试验以菜籽油为原料,研究IPL处理对储藏过程中油脂氧化稳定性的影响,同时对主要不饱和脂肪酸、总酚和α-生育酚含量的变化进行探讨,综合评价IPL诱导的菜籽油品质变化,为IPL技术在富脂食品中的应用提供参考。
1 材料与方法
1.1 实验材料
菜籽油(未精炼):中国农业科学院油料作物研究所。
1.2 主要试剂
油酸甲酯、亚油酸甲酯、亚麻酸甲酯标准品(GC≥98%);Folin-酚试剂;芥子酸标准品(纯度≥98%);α-生育酚标准品(HPLC≥98%);正己烷、甲醇、乙腈均为HPLC级;其他试剂均为分析纯。
1.3 仪器与设备
ZW-SY-2D型IPL杀菌设备。IPL光源参数:灯管总长400 mm,极距380 mm,直径8 mm;灯能量100-500 J可调,脉冲频率0.5或1 Hz;本试验选用的灯能量为500 J(单次脉冲强度为132.8 mJ/cm2),紫外区分别占总能量约35.5%,其中紫外短波(UV-C)分别占总比9.9%,紫外中波(UV-B)分别占总比14.5%,紫外长波(UV-A)分别占总比11.1%;波长范围为200~1 100 nm,最大紫外吸收波长为229.7 nm。
Agilent 7890B气相色谱仪(配FID检测器);UV2000紫外分光光度计;Waters e2695高效液相色谱仪(配PDA检测器)。
1.4 试验方法
1.4.1 菜籽油的IPL处理
取一定量的菜籽油至无盖透明盒,轻微震荡使其液膜平均厚度为1~2 mm,分别在脉冲频率1 Hz、脉冲能量500 J的条件下照射15 次,以未经照射的菜籽油为对照,将上述菜籽油分别置于棕色瓶,并在60 ℃下恒温储藏。
1.4.2 氧化稳定性测定
1.4.2.1 过氧化值(POV)的测定
参照GB 5009.27—2016[20]。
1.4.2.2p-茴香胺值(p-AV)的测定
参照GB/T 24304—2009[21]。
1.4.3 脂肪酸含量测定
1.4.3.1 脂肪酸甲酯化
称取70~80 mg油样于10 mL具塞试管,加入2 mL正己烷,溶解后加入2 mL 1 mol/L氢氧化钾-甲醇溶液,涡旋混合1 min,50 ℃恒温振荡20 min,冷却后加适量高纯水,取上层有机相加入适量无水硫酸钠,过0.22 μm有机滤膜后待测。
1.4.3.2 GC色谱条件
色谱柱:TR-Wax MS毛细管柱(Thermo,30 m×0.25 mm×0.25 μm);进样口温度250 ℃;检测器温度260 ℃;程序升温:初始温度180 ℃,保持5 min,以3 ℃/min升至230 ℃;进样量1 μL;载气为高纯氮气,流速1.0 mL/min;分流比20∶1。采用外标法定量。
1.4.4 总酚含量测定
1.4.4.1 酚类物质提取
参照Yang等的方法[22]。
1.4.4.2 总酚含量测定
采用Folin-酚法,取0.5 mL多酚提取液,加入5 mL蒸馏水和0.5 mL Folin-酚试剂,混匀后室温下放置5 min,加入1 mL澄清饱和碳酸钠溶液,用蒸馏水定容至10 mL,混匀后室温下避光静置30 min,测定747 nm波长下的吸光值。用芥子酸(SA)制作标准曲线。
1.4.5 α-生育酚含量测定
1.4.5.1 α-生育酚提取
将菜籽油和甲醇按1∶2的料液比进行超声提取10 min,共提取3 次,合并提取液,9 000 r/min离心10 min,上清液在50 ℃下旋蒸至干,加少量甲醇溶解,过0.22 μm有机滤膜后待测。
1.4.5.2 HPLC色谱条件
色谱柱:Symmetry C8柱(Waters,150 mm×4.6 mm×5 μm);流动相∶乙腈/水=95/5;流速:1.0mL/min;进样量:10 μL;柱温:30 ℃;检测波长:293 nm。采用外标法定量。
1.5 数据处理
用Origin pro 9.0软件进行数据处理与作图。用SPSS Statistics 17.0软件进行统计分析,其中脂肪酸含量采用Duncan(D)分析法,其余均采用T检验,P<0.05为差异显著。所有试验平行测定3次。
2 结果与分析
2.1 IPL处理对储藏期内菜籽油POV值的影响
IPL处理对储藏期内菜籽油POV值的影响如图1所示。IPL刚处理完(0 d)的菜籽油POV值均大于对照组(P<0.05)。处理组和对照组菜籽油POV值均随储藏时间的延长而增加。储藏期前16 d(除0 d外),处理组菜籽油POV值与对照组之间均无显著差异(P>0.05);储藏24 d后,处理组菜籽油POV值显著低于对照组(P<0.05);储藏32 d后,处理组菜籽油POV值比对照组低0.14 g/100 g。与对照组相比,经IPL处理的菜籽油在储藏过程中初级氧化速度有所减慢。

图1 IPL处理对储藏期内菜籽油POV值的影响
2.2 IPL处理对储藏期内菜籽油p-AV值的影响
IPL处理对储藏期内菜籽油p-AV值的影响如图2所示。IPL处理可使菜籽油p-AV值大于对照组(P<0.05)。随储藏天数的增加,处理组和对照组菜籽油p-AV值均升高。储藏8 d后,处理组菜籽油p-AV值小于对照组(P<0.05);储藏32 d后,处理组菜籽油p-AV值比对照组小2.2。在试验储藏期内,IPL处理可延缓菜籽油的次级氧化。

图2 IPL处理对储藏期内菜籽油p-AV值的影响
2.3 IPL处理对储藏前后菜籽油中主要脂肪酸含量的影响
经IPL处理后(0 d)和储藏32 d后的菜籽油POV值和p-AV值与对照组相比均有显著差异(P<0.05),且32 d差异最大,为进一步探讨其作用机制,对处理组和对照组不同储藏时间的菜籽油(0 d和32 d)分别进行成分分析。结果表明,该菜籽油主要不饱和脂肪酸为油酸、亚油酸和亚麻酸,其含量分别为446.39、186.39、183.30 mg/g,菜籽油脂肪酸甲酯的GC色谱图如图3所示。
IPL处理对储藏前后菜籽油中主要不饱和脂肪酸含量的影响如图4所示。菜籽油在储藏过程中主要不饱和脂肪酸含量均下降。处理组和对照组菜籽油在储藏前不饱和脂肪酸含量均无显著差异(P>0.05);但储藏32 d后,处理组不饱和脂肪酸含量显著低于照组(P<0.05),对照组菜籽油中油酸、亚油酸和亚麻酸含量分别降低0.27%、2.45%、4.88%,而处理组不饱和脂肪酸含量分别降低8.19%、8.91%、9.39%,并达显著水平(P<0.05)。

图3 菜籽油脂肪酸甲酯的GC色谱图



注:*表示有显著差异(P<0.05)。下同。图4 IPL处理对储藏前后菜籽油中主要不饱和脂肪酸含量的影响
2.4 IPL处理对储藏前后菜籽油中总酚含量的影响
IPL处理对储藏前后菜籽油中总酚含量的影响如图5所示。IPL处理使菜籽油中总酚含量显著高于对照组(P<0.05);储藏32 d后,处理组总酚含量仍高于对照组(P<0.05)。随着储藏时间的延长,菜籽油中总酚含量均下降,对照组、处理组分别降低45.98%、40.66%。IPL处理可使菜籽油在储藏过程中减慢总酚含量下降。

图5 IPL处理对储藏前后菜籽油中总酚含量的影响
2.5 IPL处理对储藏前后菜籽油中α-生育酚含量的影响
IPL处理对储藏前后菜籽油中α-生育酚含量的影响如图6所示。在试验储藏期内,菜籽油中α-生育酚含量显著降低,对照组和500 J处理组分别降低60.86%、55.90%。IPL刚处理完时菜籽油中α-生育酚含量显著降低(P<0.05);但储藏32 d后,处理组与对照组之间菜籽油中α-生育酚含量无明显差异(P>0.05)。IPL处理使菜籽油随着储藏时间的延长对α-生育酚含量的降低有一定延缓作用。
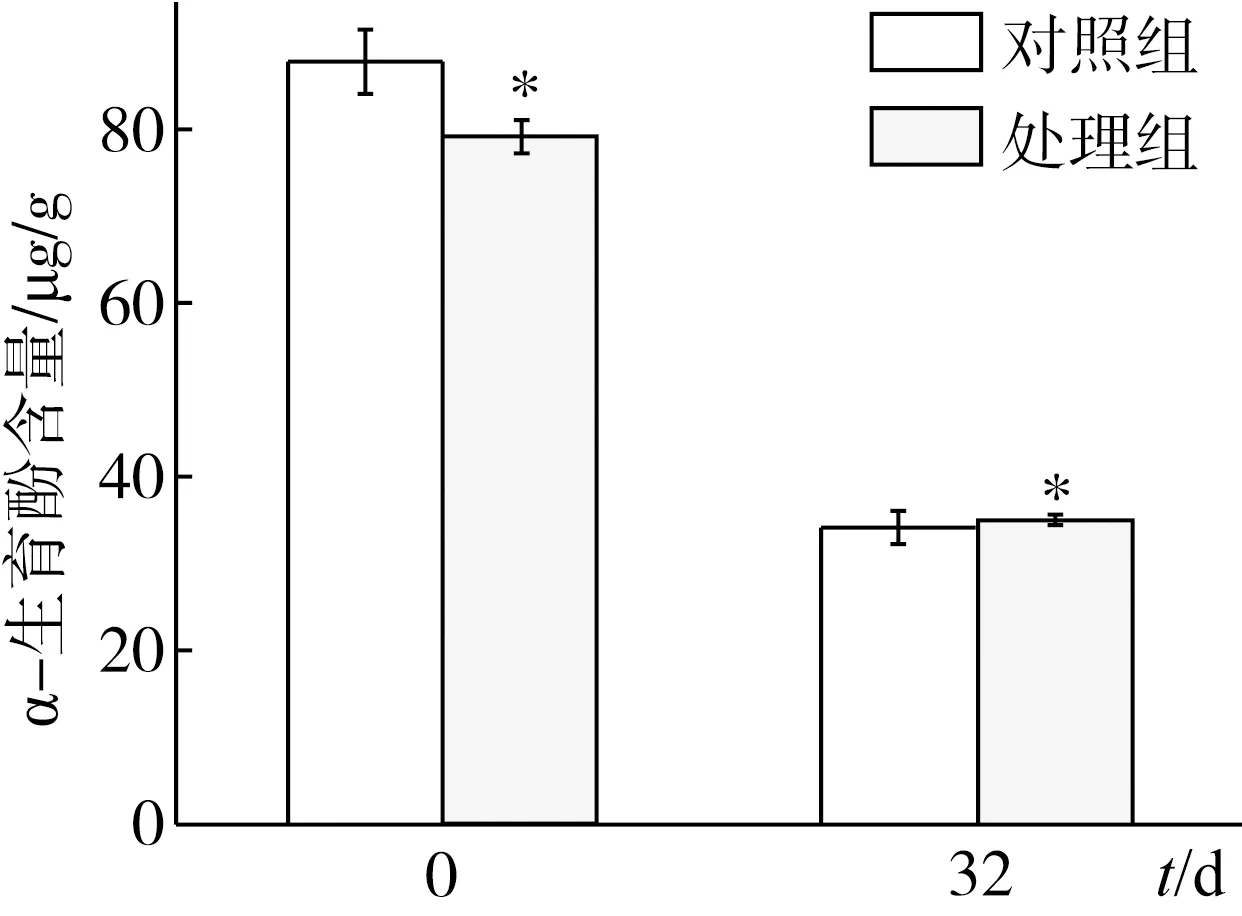
图6 IPL处理对储藏前后菜籽油中α-生育酚含量的影响
3 讨论
由试验结果可知,IPL刚处理完时(0 d)的菜籽油与对照组相比,POV值和p-AV值均增大,并达显著水平(P<0.05),这是因为油脂氧化属于典型的自由基链式反应,IPL处理给菜籽油提供了较大能量,处理完即开始加速自由基诱发,同时在分子氧的参与下,氢过氧化物(ROOH)和次级氧化产物加快形成,说明IPL处理对菜籽油的氧化起诱导作用。随着储藏时间的延长,处理组菜籽油POV值和p-AV值均低于对照组(P<0.05),这与袁勇军等[23]和Wambura等[24]的研究结果相反。该现象的产生可能与菜籽油中相关成分(脂肪酸、酚类物质)有关。不饱和脂肪酸由于含有双键,易发生氧化,本身可作为抗氧剂[25],储藏32 d后处理组菜籽油中不饱和脂肪酸含量下降速度均比对照组快,可能是储藏过程中处理组发挥的抗氧化效果优于对照组,使其成为延缓菜籽油氧化的原因之一。酚类物质是菜籽油的内源性抗氧化剂,储藏前后处理组菜籽油中总酚含量均显著高于(P<0.05)对照组,且油脂抗氧化能力与总酚浓度密切相关[26],同时储藏32 d后处理组α-生育酚含量下降减缓,说明储藏过程中处理组菜籽油抗氧化能力比对照组好,导致处理组菜籽油的氧化速度比对照组慢。
IPL处理后的菜籽油中不饱和脂肪酸含量与对照组相比均无明显变化(P>0.05),说明不饱和脂肪酸的氧化在刚处理完时仍处于诱导期,大部分不饱和脂肪酸还未反应。储藏32 d后,处理组菜籽油中不饱和脂肪酸含量显著低于对照组(P<0.05),油脂在储藏过程中部分不饱和脂肪酸经自动氧化或光敏氧化形成ROOH,部分不饱和脂肪酸起抗氧化作用后可能降解或聚合形成其他化合物,处理组菜籽油中不饱和脂肪酸起抗氧化作用消耗的速度可能大于对照组,使处理组不饱和脂肪酸含量下降速度比对照组快,具体原因有待进一步研究。
IPL处理可使菜籽油中总酚含量显著升高(P<0.05),这与王正东等[27]的研究结果一致,即用不同强度和次数的IPL对杨梅汁进行处理,其总酚含量均显著上升。其原因可能是IPL处理使试验体系中某些酚类化合物结构发生改变,使其具有更强的还原性,导致总酚含量增加;也可能是酚类化合物与菜籽蛋白相互作用形成复合物[28],少量酚类复合物随制油过程进入油脂,由于蛋白质经UV-C(100~280 nm)照射其结构发生改变[29],IPL光谱中含有UV-C成分,处理后可能使这些复合物中的蛋白质变性,释放出酚类物质,使总酚含量上升。处理组菜籽油经储藏32 d后总酚含量降低速度比对照组慢,可能是在储藏过程中部分酚类化合物自然降解,而部分受IPL诱导加速降解或聚合形成还原性更强的化合物,使处理组总酚含量高于对照组。
菜籽油经IPL处理后其α-生育酚含量显著低于对照组(P<0.05),这可能与光照有紧密相关性,Eunok[30]研究了光照和温度两种因素对葵花籽油氧化过程中生育酚的影响,结果显示光照降低了生育酚的降解对温度的依赖性。UV成分的照射会加速α-生育酚氧化[31],UV提供的能量可以使生育酚中苯并二氢吡喃醇结构中O-H键和醚键断裂,先生成半醌自由基中间体后转化成醌[32],使α-生育酚含量下降。储藏32 d后处理组菜籽油α-生育酚含量下降速度低于对照组,可能是处理组浓度相对较高的其他酚类物质对α-生育酚有一定保护作用,减弱了α-生育酚在油脂中的抗氧化能力,使其降低速度减慢。
将IPL技术应用于富脂食品的生产开发时,应考虑共存成分对油脂氧化的影响,以最大限度保留食品中的有益成分,可通过优化脉冲参数来提高食品品质。本试验后期需对相关成分与油脂氧化之间的关系进行深入探讨,以便更全面地研究IPL处理对油脂品质的影响及相关机制,为IPL技术在食用油相关领域的应用提供参考。
4 结论
本研究表明,IPL处理延缓了储藏过程中菜籽油的氧化及酚类物质含量的下降,但加速了不饱和脂肪酸含量的降低,即IPL处理在一定程度上对保持菜籽油天然品质有益。本研究结果为富脂食品的设计和开发提供了新思路,有利于IPL技术在食品工业中推广。

