超声辅助处理对乳清分离蛋白糖基化产物的理化特性影响
王 麒 李宛蓉 秦新光 刘 刚
(武汉轻工大学食品科学与工程学院,武汉 430023)
美拉德反应是糖分子与蛋白质分子上的氨基通过共价键结合形成糖基化蛋白的化学反应[6],而糖基化改性后的蛋白热稳定性、乳化性等物化性质均明显提高。目前,美拉德反应主要通过湿法和干法两种方式进行,而且两种方法所得的美拉德反应产物性质均优于原蛋白。研究发现乳清蛋白-葡聚糖糖基化产物的乳化性明显增强[7]。杜研学等[8]利用干法美拉德反应,对从米渣中提取的谷蛋白进行糖基化改性,其所得的糖基化改性产物表面疏水性显著降低,功能性质在广泛pH值范围内显著提高。
超声技术在食品工业的应用十分广泛[9-10],由于超声辅助生产具有提高生产率、缩短加工时间、操作简单、节约成本等优点,近年来受到从业者的青睐[11]。超声辅助技术也在美拉德反应中得到应用,Li等[12]研究了超声处理对花生分离蛋白-葡甘露聚糖共聚物的物化性质影响,其结果表明超声处理花生分离蛋白与葡甘露聚糖,促进了糖基化反应的进行,其糖基化产物的物化性质明显提高。
本试验采用超声辅助与水浴加热两种方式促进乳清蛋白糖基化反应,制备乳清分离蛋白与葡萄糖共聚物,并比较两种处理方式制备的糖基化产物在游离氨基以及理化性质等方面的差异,以此探讨超声辅助羰基化反应的机理。
1 材料与方法
1.1 材料与试剂
一级大豆油;乳清分离蛋白(蛋白质量分数96.88%);葡萄糖(分析纯);其他试剂均为分析纯:国药集团化学分析有限公司。
1.2 仪器
T-18型高速分散仪;超声仪(探头为Φ 6mm) FS-系列超声波处理器;Malvern200型激光粒度分析仪;高压循环均质机;TU-1800紫外可见分光光度计。
1.3 方法
1.3.1 样品制备
称取等量的乳清分离蛋白(WPI)和葡萄糖(glucose ,G)溶于0.2 mol/L pH 7.5的磷酸盐缓冲溶液中,配制成质量浓度为10 mg/mL 乳清分离蛋白、葡萄糖混合溶液,搅拌1 h并预热至一定温度。分别取几份混合溶液在最佳超声条件下(超声温度70 ℃,超声功率300 W,预实验测得)进行不同超声时间(5、10、15、20、30、40、60 min)处理。将所得溶液进行冷冻干燥,冻干后的粉末4 ℃下保存。另取等量的混合溶液在水浴锅中进行70 ℃处理,加热时间分别为3、6、9、12、24、28、32 h。后续处理步骤与超声处理组相同。
对于政府而言,水权初始分配除了需要考虑诸多因素以确保分配结构合理外,还需要确保分配规则满足时代发展需要。从历史发展来看,水权合理分配规则呈现动态发展之势,它是时间和空间的产物,会随时空的变化而变迁。影响水权合理分配规则变化的因素主要有两个:一是自然环境的变化;二是社会环境变化。
1.3.2 游离氨基测定
采用邻苯二甲醛(OPA)法[13]测定游离氨基含量从而计算WPI接枝度。取40 mg OPA溶于1 mL甲醇中,加入0.1 mol/L 25 mL硼砂溶液、体积分数为20% 2.5 mL十二烷基磺酸钠溶液、100 μL β-巯基乙醇,并用去离子水定容至50 mL,即得OPA试剂。准确称取超声、水浴处理时间分别为0、20、40、60 min的蛋白样品,将其配制成0.5 mg/mL的溶液,取样品溶液400 μL,加入8 mLOPA试剂,混合均匀后置于35 ℃水浴2 min,取反应后的溶液在340 nm下测定吸光值。并以赖氨酸作标准曲线,计算样品中游离氨基的含量,并计算接枝度,接枝度(DG)的计算公式:
DG =(A0-At) /A0×100%
式中:A0为未进行糖基化反应WPI的游离氨基含量;At为糖基化反应后WPI-G接枝物的游离氨基含量。
1.3.3 溶解性测定
分别准确称取一定量的WPI、超声处理40 min、水浴28 h处理的样品,配制成质量浓度为1 mg/mL的溶液,将溶液等体积分为6份,用1 mol/L HCl或1 mol/L NaOH溶液将6份溶液的pH值依次调节为3、4、5、6、7、8,室温下磁力搅拌10 min (搅拌过程中保持pH值稳定) 后,在4 ℃下离心15 min (10 000 r/min),取上清液用酶标仪测定溶液在590 nm处的吸光度,以5 mg/mL BSA溶液作标准曲线,计算样品中蛋白浓度。蛋白质的溶解性表示为上清液蛋白浓度占相应的总蛋白浓度的百分比 (A590/A总×100%)。
1.3.4 乳化性测定
参考Meng等[14]的方法,并略有改动,分别取超声处理40 min、水浴28 h处理后的WPI-G共聚物样品,用pH为7.0的磷酸盐缓冲液配制成质量分数为0.5%的溶液,取3 mL的蛋白溶液和1 mL大豆油采用高速均质机在20 000 r/min室温下均质1 min,从试管底部取50 μL匀浆液,用质量分数为0.1%的SDS溶液稀释100倍并用涡旋仪混合均匀,以SDS溶液为空白,用紫外分光光度计分别测定500 nm处的吸光值。放置10 min后同样位置测定吸光值。乳化性系数EAI和乳化稳定性系数ESI由公式计算:
EAI=(2.303×2×n×A0)/(C×Φ×10 000)
ESI=A0×Δt/(A0-A10)
式中:n为稀释倍数;Φ为油相体积分数0.25;C为蛋白质的浓度/g/mL;A0为均质后样品500 nm吸光度;A10为均质10 min后的样品在500 nm处的吸光度;Δt为10 min
1.3.5 乳液制备及粒径分析
分别称取WPI以及超声处理40 min、水浴28 h处理后的WPI-G共聚物分别溶于pH为7.5的磷酸盐缓冲体系中,配制成2%(m/V)的溶液,搅拌使其完全溶解,加入0.02%的叠氮钠,抑制微生物的生长,以样品溶液为水相。以油水比为1∶9的比例加入大豆油,置于高速均质机中以20 000 r/min转速进行高速分散,制备粗乳,再将粗乳液通过高压均质机均质(均质温度4 ℃,均质压力30 MPa)得到乳液,并将乳液置于4 ℃冰箱保存。各取三种乳液10 μL,用蒸馏水稀释100倍,置于Malvern 200型激光粒度分析仪中分析粒径大小,20 d后,另取乳液10 μL,蒸馏水稀释100倍,再次测量乳液粒径大小变化。
2 结果与分析
2.1 游离氨基含量分析
测定两种处理方式下蛋白溶液中的游离氨基含量,见表1,水浴加热处理WPI的游离氨基含量无明显变化,当WPI以超声波法进行加热时,游离氨基的质量浓度从0.066 mg/mL增至0.076 mg/mL。表明超声处理有助于WPI与葡萄糖聚合反应时释放出更多的游离氨基。这与Mu等[15]的结论相吻合,超声处理过程中产生的泡沫空化效应增加了坍塌气泡周围区域的局部温度和压力,导致蛋白质伸展、水解,肽键被破坏,大量的氨基酸残基暴露出来。
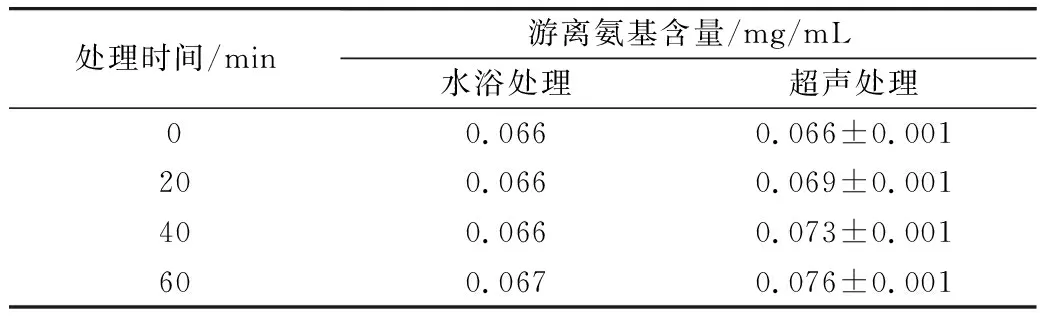
表1 不同处理方式下WPI游离氨基含量
注:其他标准偏差均<0.001。
2.2 接枝度分析
接枝度可由游离氨基含量计算,因此两种处理方式下WPI和葡萄糖的接枝度结果如表2所示,同一接枝度下的超声辅助处理下的糖基化反应时间明显低于水浴加热时间,超声辅助法处理WPI与葡萄糖接枝度达到44.61%只需30 min,而相比之下,通过传统加热法接枝度达到45.05%则需24 h。此外,无论是水浴加热还是超声波处理,共聚物的接枝度均呈现出先增大后减小的趋势。这与JIANG等[16]的研究相符,可能是由于在美拉德反应初始阶段,乳清分离蛋白结构部分展开,乳清分离蛋白与葡萄糖受热后逐步结合,接枝度逐渐提高;但过度加热时,一方面使乳清分离蛋白中的部分赖氨酸被破坏,另一方面则造成乳清分离蛋白结构的充分伸展,乳清分离蛋白分子之间的相互作用增强,导致蛋白凝聚、沉淀,不利于接枝反应的进行,最终导致接枝度反而降低。因此本文选取超声处理40 min、水浴处理28 h作为后续试验的样品处理条件,此时两种处理条件得到的共聚物接枝度均为48%左右,表明美拉德反应程度较为接近,作为后续实验的样品处理条件具有可比较性,以便进一步比较超声与水浴两种处理方式对反应产物物化性质的影响更为明显。
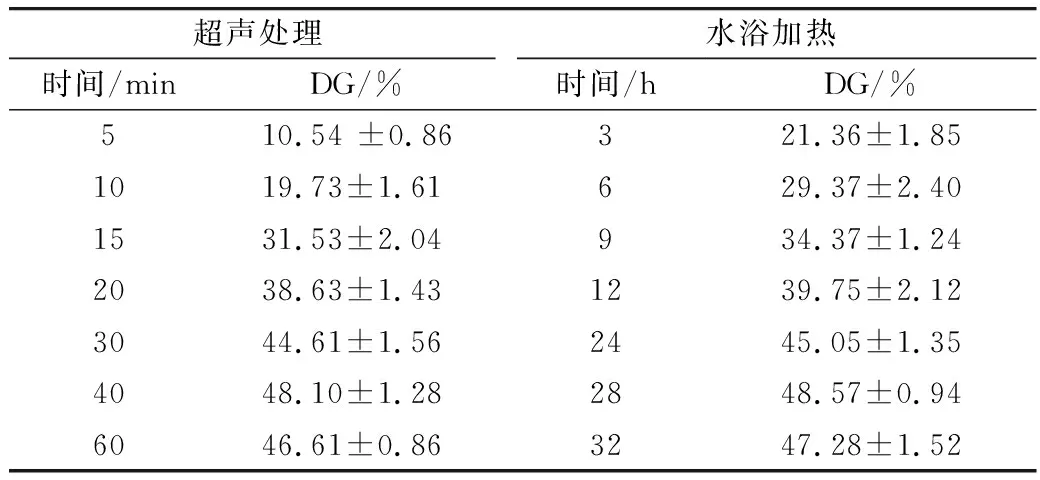
表2 水浴和超声处理下WPI和葡萄糖的接枝度
2.3 溶解性分析
蛋白的溶解性与其他物化性质具有相关性,因此我们对不同pH值下的WPI及两种处理方式的WPI-G共聚物进行溶解性分析,结果如图1所示,未经处理的WPI在pH在5.0左右溶解度最低,这是由于WPI的pH在等电点(5.0)左右,此时蛋白净电荷为零,由于电荷不对称而产生静电相互作用引起蛋白发生聚集。而改性后的WPI糖基化产物在pH 5.0处溶解度明显提高,且超声处理相比于水浴热处理条件下的WPI-G共聚物溶解度更好。可能是由于超声处理导致肽键断裂,蛋白亲水性氨基暴露提高了蛋白质的溶解性。
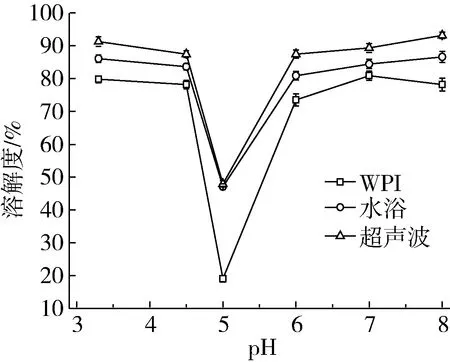
图1 不同处理方式下WPI-G共聚物的溶解度
2.4 乳化性分析
WPI和WPI-G共聚物的乳化性和乳化稳定性变化如图2所示,随着超声处理时间的延长,WPI-G共聚物的乳化性逐渐增强,EAI值在超声时间为40 min时达到峰值。而水浴加热WPI-G糖基化产物的EAI值也明显高于原WPI。超声处理40 min的WPI-G糖基化产物EAI值由初始值20.67 m2/g增加至40.84 m2/g,增加了99%。与水浴处理的WPI糖基化产物相比EAI值增加了59%。这均表明,超声辅助糖基化反应有效地改善了乳清蛋白的乳化活性和乳化稳定性。而且,超声辅助糖基化反应产物的乳化稳定性指数随超声时间的延长而逐渐增加,在超声时间为30 min时达到峰值76.85 min,而后逐渐降低,可能是由于超声时间过长,溶液温度升高,蛋白分子结构被破坏,出现絮凝等现象,导致后期乳化稳定性降低。

注:0表示WPI-G共聚物水浴加热28 h。图2 WPI及WPI-G共聚物不同超声处理时间下的EAI和ESI值
2.5 粒径分布
两种处理方式下制得的WPI共聚物乳液粒径分布如图3所示,结果表明两种糖基化产物为基质的乳液平均粒径均明显小于原WPI乳液,且超声处理所得的糖基化产物乳液粒径更小,平均粒径为60 nm左右,水浴处理的WPI-G共聚物乳液平均粒径为200 nm左右,原WPI乳液平均粒径为300 nm左右。而且三种乳液于4 ℃冰箱中静置20 d后,所测得的乳液平均粒径均没有明显变化,超声处理制得的WPI-G共聚物乳液平均粒径仍小于100 nm。表明WPI及WPI-G共聚物乳液均具有良好的储藏稳定性。这可能是由于WPI及其共聚物作为乳化剂提高了乳液稳定性[17],且超声处理的WPI-G共聚物乳化性高于水浴处理的WPI-G共聚物,可能是由于超声处理能量更加集中,使WPI与葡萄糖的接枝反应进行的更加完全,从而使其处理后的共聚物乳化性能更好。
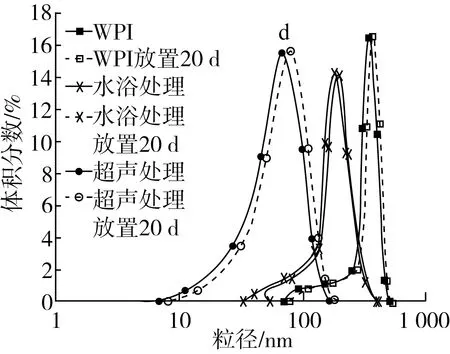
图3 不同处理方式下WPI和WPI-G共聚物乳液的的粒径分布
3 结论
3.1 乳清分离蛋白和葡萄糖的最佳超声处理温度为70 ℃,功率为300 W,当超声时间为40 min时,蛋白溶液中游离氨基浓度增加,且此时接枝度最佳为48.10%,美拉德反应程度达到最佳,而水浴加热处理达到相同的接枝度需耗时28 h。
3.2 超声辅助处理和水浴加热处理的WPI-G共聚物在等电点附近的溶解性均明显增强,溶解度由19.09%增大至47.95% 。在等pH条件下超声处理的WPI-G共聚物的溶解性优于水浴加热处理。
3.3 超声辅助处理WPI- G共聚物的乳化性增强,其乳化性数由20.67 m2/g增至40.84 m2/g,增大了99%,而相对于水浴加热法乳化系数25.3 m2/g增大了59%。
3.4 超声辅助处理所得的WPI-G共聚物乳液平均粒径为60 nm,明显小于水浴加热处理的WPI-G乳液粒径(200 nm),二者与未处理的WPI乳液(粒径300 nm)相比,粒径更小、更稳定,储藏稳定性更好。

