三七总皂苷调节能量代谢干预心肌细胞肥大的效应机制研究*
罗 凯,张 腾1,**,陈 瑜1,**
(1.上海中医药大学附属岳阳中西医结合医院 上海 200437;2.上海市中医药研究院中西医结合临床研究所 上海 200437)
根据2019 年3 月发布的《中国心血管病报告2018》显示,近十年来,我国心血管病死亡率一直位居各类疾病首位,并且发病率呈现不断上升趋势[1]。作为多种心血管疾病形成过程中共同病理表型之一的心肌细胞肥大也越来越多的受到医学界的关注。心肌细胞肥大是心肌细胞对各种内外因素诱导的生物学压力增加所作出的反应,其特点是心肌细胞体积增大,直径增宽,长度增加,肌节数量增多,并且与心肌肥厚和心衰的发生密切相关[2]。三七是五加科植物三七的干燥根和根茎,味甘、性温、微苦,最早明确记载于《本草纲目》之中,迄今有数百年的临床应用历史。《医学衷中参西录》记载:“三七,善化瘀血,又善止血妄行,病愈后不致瘀血留于经络。”三七具有化瘀止血、活血定痛的功效。PNS 是中药三七最主要活性成分之一,具有抗炎、抗凝、抗氧化、抗凋亡、抗心律失常、减少心肌耗氧量等多种药理活性,其相关制剂临床广泛应用于心血管疾病的防治[3,4]。近年来,有研究报道PNS 能够显著降低心肌损伤小鼠的心肌细胞横截面积,提示PNS 可能具有抑制心肌细胞肥大,抗心肌肥厚的效应[5,6],然而有关其作用机制尚未见深入的研究报道。亦有报道,心肌细胞肥大与能量代谢紊乱关系密切[7]。因此,本实验从能量代谢途径发掘并探索PNS 抑制心肌细胞肥大效应可能的分子机制,以期为其临床应用和推广提供扎实的理论和实验依据。
1 材料与方法
1.1 实验动物、试剂
新生1-3 天C57BL/6J 乳鼠(由购自斯莱克动物有限公司的成年C57BL/6J 小鼠繁育所得);小鼠心肌细胞分离试剂盒(Thermo Scientific);三七总皂苷(纯度≥98%)(上海泛亚生物医药集团);异丙肾上腺素(纯度≥99%)(东京化成工业株式会社);罗丹明-鬼笔环肽染料(Thermo Scientific);ATP检测试剂盒(碧云天生物科技公司);miRNA 逆转录试剂盒(Qiagen);5xPrime Script RT Master Mix(TaKaRa);SYBR GREEN(Roche);PPAR-δ一 抗(Thermo Scientific,PA1-823A);PPAR-δ二抗(Thermo Scientific,SH253595)。
1.2 实验仪器
荧光化学发光凝胶成像仪(美国UVP 公司);多功能酶标仪(BioTek 公司);倒置荧光显微镜(Leica,DM6000B);实时荧光定量PCR 系统(Roche);细胞培养箱(Thermo Scientific);微量紫外分光光度计(Shimadzu)。
1.3 细胞分离及模型制备
新生1-3 天C57BL/6J 乳鼠,75%的医用酒精皮肤消毒,沿左侧肋弓下缘将肋弓与胸腔分离,使心脏暴露于体外,用镊子迅速离断心脏,于HBSS 缓冲液中(不含Ca2+、Mg2+)将心脏残血浸涤干净并剪碎,每个心脏置于备有木瓜蛋白酶200 μL和嗜热菌蛋白酶10 μL混合液的EP 管中,37℃震荡消化30 min,3000 rcf 常温离心3 min,去上清液留心肌细胞沉淀物,每管加入HBSS缓冲液1 mL将沉淀吹打均匀,室温放置5 min终止消化反应,2000 rcf 常温离心3 min,去上清留沉淀,每管加入含1%青链霉素和10%胎牛血清的DMEM培养基1 mL 将沉淀吹打均匀,将各个EP 管中含有心肌细胞的培养基置于50 mL 离心管中混匀,调整细胞浓度为5 × 105/mL,接种至12 孔培养板,1000 μL/孔,37℃条件下置于5%二氧化碳培养箱中孵育。待心肌细胞贴壁(约24 h)后,将上清连同没有贴壁的心肌细胞吸出,重新加入DMEM 培养基继续孵育。利用ISO(10 μmol/L)在二氧化培养箱5%CO2,37℃环境中培养孵育72 h,制备心肌细胞肥大模型。
1.4 分组给药
将心肌细胞随机分为4 组:①正常组:加入等体积的生理盐水溶液;②模型组:等体积生理盐水+ISO 10 μmol/L;③PNS 低剂量组:PNS 50 mg/L+ISO 10 μmol/L;④PNS 高剂量组:PNS 200 mg/L+ISO 10 μmol/L。PNS 干预后30 min 给予ISO,在二氧化培养箱5%CO2,37℃环境中培养孵育72 h。
1.5 心肌细胞病理染色及横截面积计算
心肌细胞孵育72 h 后吸去培养基,用PBS 清洗细胞10 min× 2 次,1% Triton 200 μL 透明化浸泡3 min,PBS清洗细胞10 min×2次,10%BSA 200 μL孵育20 min,5 μg/mL罗丹明-鬼笔环肽200 μL室温避光孵育20 min,PBS 清洗细胞10 min × 2 次,0.1 mg/mL DAPI 200 μL溶液室温孵育1 min,对细胞核进行复染,400 倍荧光显微镜下观察拍摄细胞形态。每孔观察5 个视野,每个视野测5-10 个细胞,应用image J 软件计算心肌细胞横截面积,取其平均值。
1.6 总RNA抽取及miRNA、基因表达分析
心肌细胞孵育72 h后吸去培养基,9%生理盐水清洗,每孔分别加入500 μL Trizol 吹打,室温放置5 min;离心取上清,加入氯仿100 μL,温和振荡室温放置20min;离心取上清,加入异丙醇250 μL,振荡混匀室温放置15 min;离心弃上清,RNA 沉于管底加入75%乙醇500 μL,振荡混匀室温放置5 min;离心弃上清,室温晾干10 min,每管加入DEPC 水50 μL 溶解,完成总RNA 提取。计算总RNA 浓度,进行逆转录,获取cDNA。利用SYBG法进行Real-Time PCR 检测。
各引物如表1和表2所示。
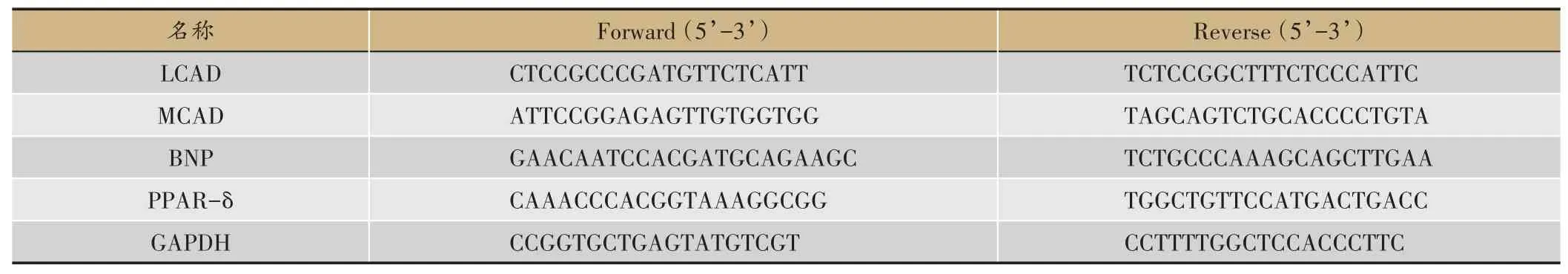
表1 用于mRNA表达分析的引物
1.7 心肌细胞ATP水平分析
心肌细胞孵育72 h 后吸去培养基,9%生理盐水清洗,4℃环境按150 μL/孔加ATP 细胞裂解液,4℃离心取上清(即ATP 样品),按照20 μL/孔,将样品加入检测孔中,利用多功能酶标仪检测样品中ATP 浓度,利用BCA 法测定样品中蛋白浓度,计算样品单位心肌细胞ATP 含量=样品ATP 浓度/样品蛋白含量,计算各组单位心肌细胞所含ATP的相对比值。
1.8 蛋白提取及表达水平分析
心肌细胞孵育72 h 后吸去培养基,9%生理盐水清洗,裂解心肌细胞,收集上清,BCA 法测蛋白浓度,配SDS 凝胶,每个凝胶孔加入蛋白样品20 μg 进行电泳分离,80 V电泳约25 min,120 V电泳约80 min,切取目的条带所在的凝胶进行湿式电转膜,30 mA 持续转膜约12 h,将转膜后的印迹膜用TBST缓冲液洗膜10 min×2次,10%牛血清球蛋白封闭2 h,一抗(1:500,PA1-823A)4℃孵育过夜,TBST 缓冲液洗膜10 min ×2 次,二抗(1:5000,SH253595)室温孵育2 h,TBST 缓冲液洗膜10 min×2 次,DAB法显色、成像,Launch visionworksLS分析软件分析测定PPAR-δ与β-actin 的灰度值,取PPAR-δ/β-actin比值为蛋白水平进行统计学分析。
1.9 统计学方法
采用SPSS18.0 软件进行统计学分析,计量资料以均数±标准误(mean±SEM)表示,组间比较采用两独立样本的t检验,结果取P<0.05具有统计学意义。
2 结果
2.1 PNS对ISO诱导的原代心肌细胞肥大具有显著直接抑制效应
罗丹明-鬼笔环肽可以特异性的识别心肌细胞内的肌动蛋白微丝,对心肌细胞进行染色在荧光显微镜下可呈现红色,以示意心肌细胞轮廓;心肌细胞核因DAPI 染色可呈现为蓝色,代表心肌细胞数量。如图1所示,400 倍镜下,正常组心肌细胞体积较小,细胞呈现圆形或小梭形;模型组心肌细胞体积增大,最短径增宽,长度增加,心肌细胞轮廓呈现为大梭形、长方形;与模型组比较,PNS 低、高剂量组心肌细胞体积不同程度变小。
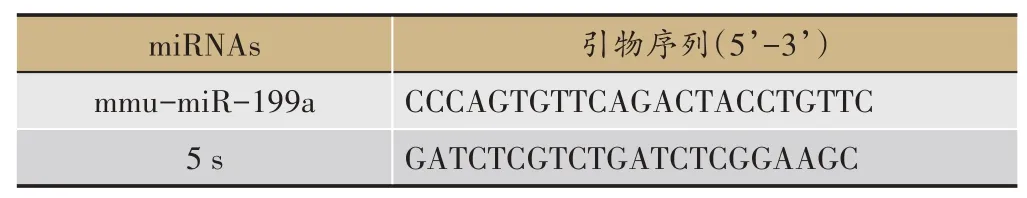
表2 用于miRNA表达分析的引物

图1 心肌细胞罗丹明-鬼笔环肽染色(× 400)
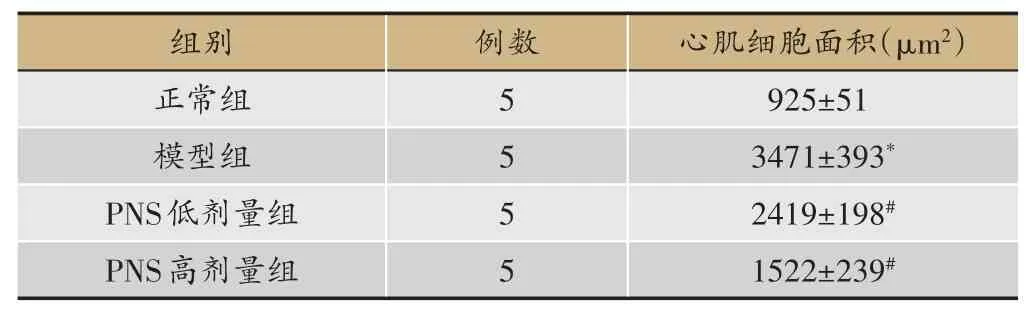
表3 心肌细胞横截面积(mean ± SEM)
应用image J软件计算心肌细胞横截面积。如表3所示,与正常组比较,模型组心肌细胞横截面积显著增大(P<0.05);与模型组比较,PNS 低、高剂量组心肌细胞横截面积显著减小(P<0.05)。
2.2 PNS显著下调心肌细胞肥大相关因子mRNA表达
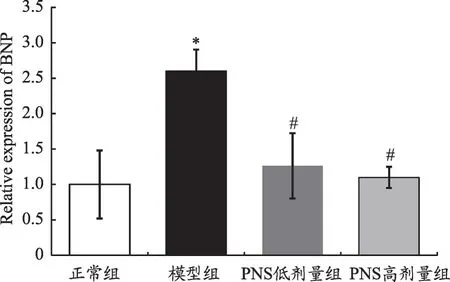
图2 心肌细胞BNP mRNA表达水平
如图2 所示,Real-Time PCR 分析结果显示:与正常组比较,模型组心肌细胞BNP mRNA 表达水平显著上调(P<0.05);与模型组比较,PNS 低、高剂量组心肌细胞BNP mRNA表达水平显著下调(P<0.05)。
2.3 PNS显著升高心肌细胞ATP水平
如图3所示,与正常组比较,模型组心肌细胞ATP水平显著降低(P<0.05);与模型组比较,PNS 低、高剂量组心肌细胞ATP水平显著升高(P<0.05)。
2.4 PNS 显著上调心肌细胞脂肪酸β 氧化相关因子mRNA表达
如图4 所示,Real-Time PCR 分析结果显示:与正常组比较,模型组心肌细胞PPAR-δ、MCAD、LCAD mRNA 表达水平显著下调(P<0.05);与模型组比较,PNS低剂量组心肌细胞MCAD、LCAD mRNA 表达水平显著上调,PNS 高剂量组心肌细胞PPAR-δ、MCAD、LCAD mRNA表达水平显著上调(P<0.05)。
2.5 PNS显著上调心肌细胞PPAR-δ蛋白水平
如图5 所示,Western blotting 分析结果显示:与正常组比较,模型组心肌细胞PPAR-δ蛋白水平显著下调(P<0.05);与模型组比较,PNS 低、高剂量组心肌细胞PPAR-δ蛋白水平显著上调(P<0.05)。
2.6 PNS显著下调心肌细胞miRNA-199a表达
如图6 所示,Real-Time PCR 分析结果显示:与正常组比较,模型组心肌细胞miRNA-199a 表达水平显著上调(P<0.05);与模型组比较,PNS 低、高剂量组心肌细胞miRNA-199a表达水平显著下调(P<0.05)。
3 讨论
祖国医学中并无与心肌细胞肥大直接对应的中医病名,但根据其病因病机和临床表现可将其归属于中医的心悸、怔忡、胸痹等范畴,其病机多样,瘀血阻滞是发病的重要环节之一。基于病因病机及临床特点,后世医家在总结前人经验基础上,对这类疾病往往采用不同的治疗方式,其中“活血化瘀”是常用的治法之一。无论是古方还是现代临床用药,三七都是活血化瘀治法中重要的组成部分,PNS 是三七中最主要也是研究最多的活性成分之一[8]。
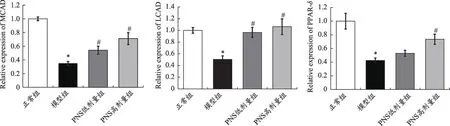
图4 心肌细胞MCAD、LCAD、PPAR-δ mRNA表达水平
体内心肌细胞发生肥大的过程中,一方面心脏在感受压力和容量负荷增加等不良刺激后会直接诱导心肌细胞发生肥大;另一方面心脏感受不良刺激后处于氧化应激状态,激活ROS 系统,促使炎症细胞释放大量炎性因子作用于心肌细胞肥大相关受体,导致炎症周围心肌细胞发生肥大,炎症因子也可以促进成纤维细胞增殖,使心肌发生纤维化,进而激活心肌细胞肥大相关受体,加快心肌细胞肥大进程[9,10]。在前期实验研究中观察到,PNS 能够显著降低心肌损伤小鼠的心肌细胞横截面积,提示PNS 可能具有抑制心肌细胞肥大的效应。心肌组织主要由心肌细胞和成纤维细胞组成,并且病理状态下心肌内富含各种炎症细胞,基于心肌细胞肥大发生的分子学机制,单纯的小鼠体内实验并不能系统准确的阐述PNS 是否具有直接抑制心肌细胞肥大的效应。对此,本实验基于PNS 在小鼠体内抑制心肌细胞肥大有效的前提下,对原代心肌细胞进行分离,将心肌组织中绝大多数的成纤维细胞、炎症细胞进行消化剔除,最大比例的保留原代心肌细胞后,在成功复制原代心肌细胞肥大模型基础上,继续探讨PNS 是否具有直接抑制心肌细胞肥大的效应。实验结果显示,给予不同剂量的PNS 后,ISO 诱导的心肌细胞横截面积显著减小,心肌细胞肥大相关因子BNP 的mRNA 表达水平显著下调。提示PNS 具有显著直接抑制心肌细胞肥大的效应。
生理状态下,心肌细胞活动所需要的能量60%-90%来自脂肪酸β氧化,10%-40%来自葡萄糖有氧氧化,少量来自酮体、氨基酸分解[11]。病理状态下,心肌细胞内能量底物由脂肪酸向葡萄糖转换,脂肪酸β氧化减少,糖酵解增加[12]。糖酵解虽然能够在短时间内迅速提供能量,暂时满足心肌细胞对能量的需求,但是这种产能方式产能效率低下。由于糖酵解过程中会产生大量乳酸,使细胞内环境发生改变,ATP 此时大多用于维持内环境中Na+、Ca2+等离子的转运,用于心肌细胞收缩的供能减少,导致心脏效率下降,发生心肌细胞肥大、心肌肥厚[2]。ATP 又称三磷酸腺苷,是机体的直接供能物质,ATP 发生水解时,形成ADP 并释放一个磷酸根,同时释放能量。脂肪酸、葡萄糖、蛋白质给机体供能,都要通过代谢转化成为ATP实现[13]。因此ATP 可以直接反映心肌细胞最终的能量生成。有研究报道[14],心肌细胞肥大发生时伴有ATP 生成减少,提示心肌细胞肥大可能与能量代谢异常存在密切关系。本实验在PNS 具有显著直接抑制心肌细肥大效应的基础上进一步对心肌细胞能量代谢进行探索。实验通过对原代心肌细胞中ATP 含量进行测定,以此反映心肌细胞能量代谢情况。实验结果显示,ISO 诱导的心肌细胞在肥大过程中ATP 水平显著降低;给予不同剂量的PNS 后,ATP 水平显著升高。提示PNS 可能通过改善心肌细胞能量代谢,发挥抑制心肌细胞肥大的效应。
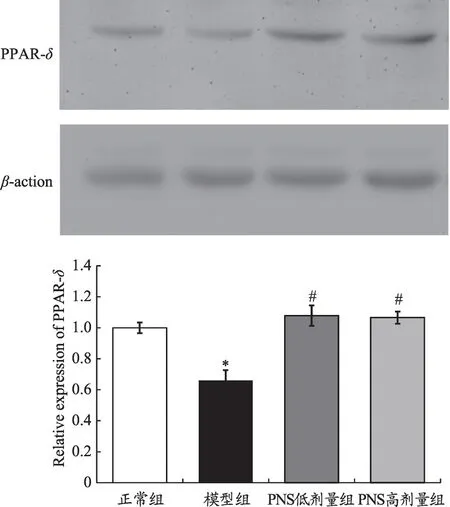
图5 心肌细胞PPAR-δ蛋白水平
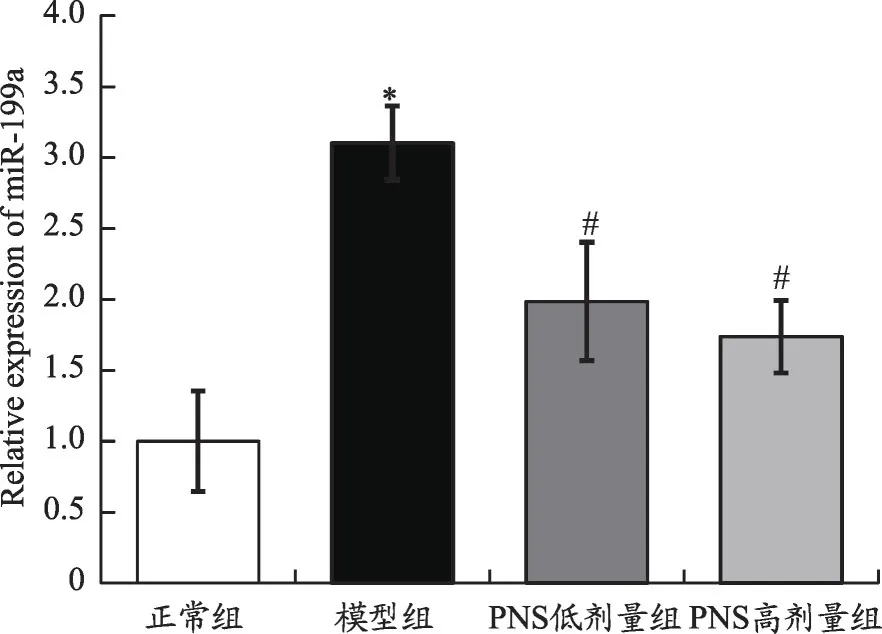
图6 心肌细胞miRNA-199a表达水平
正常状态下,甘油三酯可以在胞质内分解为甘油和脂肪酸。中链和长链脂肪酸需要转化为脂酰COA,在肉碱脂酰转移酶I催化下与肉碱结合形成脂酰肉碱才能转运进入线粒体内,进行脂肪酸β氧化,生成大量ATP[15]。心脏病理状态下,心肌细胞及线粒体内的酶活性和代谢发生显著变化,影响脂酰COA 由胞质向线粒体内转运速率,使参与脂肪酸β氧化的底物水平下降,导致ATP 生成减少,产能降低。LCAD 和MCAD 是肉碱脂酰转移酶I 重要组成部分,二者分别协助长链脂肪酸和中链脂肪酸进入线粒体,在脂肪酸β氧化过程中发挥着重要作用[16]。有研究报道心肌细胞肥大过程中,LCAD 和MCAD 活性降低,造成线粒体外膜上的肉碱脂酰转移酶I 表达下降,影响脂酰COA 与肉碱结合形成脂酰肉碱,使脂酰COA 由胞质向线粒体内转运速率降低,线粒体摄取脂酰COA 功能出现障碍[17]。实验采用Real-Time PCR 分析心肌细胞中LCAD、MCAD的mRNA 表达。结果显示,ISO 诱导心肌细胞肥大过程中,心肌细胞中LCAD、MCAD 的mRNA 表达水平显著下调;给予不同剂量PNS 后心肌细胞中LCAD、MCAD 的mRNA 表达水平显著上调。提示PNS可能通过上调LCAD、MCAD 的表达,促进脂肪酸代谢,增加心肌细胞能量生成。
PPAR-δ是心肌细胞内重要的转录调节因子之一,可以激活与脂肪酸摄取、氧化相关的多种基因的表达,与心肌细胞脂肪酸代谢密切相关[15]。有研究报道在心肌细胞脂肪酸代谢过程中,PPAR-δ可能通过调控其下游靶基因LCAD 和MCAD 的活性,影响脂肪酸β氧化[18]。实验采用Real-Time PCR 分析心肌细胞中PPAR-δ的mRNA 表达。结果显示,ISO诱导心肌细胞肥大过程中,心肌细胞中PPAR-δ的mRNA 表达水平显著下调;给予不同剂量PNS 后,心肌细胞中PPAR-δ的mRNA 表达水平出现不同程度上调,其中以PNS 高剂量组为显著上调。由于PPAR-δ在脂肪酸代谢过程中,可能与微小RNA(microRNA,miRNA)存在密切联系,实验采用Western Blotting 进一步分析PPAR-δ蛋白水平。结果显示,ISO 诱导心肌细胞肥大过程中,心肌细胞PPAR-δ蛋白水平显著下调;给予不同剂量PNS 后,心肌细胞PPAR-δ蛋白水平显著上调。提示PNS 可能通过上调PPAR-δ促进LCAD、MCAD 的表达。
MiRNA 属于非编码微小RNA,作用于靶基因mRNA 分子3’端非编码区域,通过负性调控或直接降解mRNA,参与蛋白合成和表达,影响生物活动的进程[19]。研究报道心脏超负荷和缺氧状态下可能存在miRNA-199a 表达水平的上调,进而抑制PPAR-δ活化,限制细胞内脂肪酸β氧化速率,影响能量代谢,诱导心肌细胞肥大[20]。实验结果显示,ISO 诱导心肌细胞肥大过程中,心肌细胞miRNA-199a 表达水平显著上调;给予不同剂量PNS 后,miRNA-199a 表达水平显著下调。提示PNS 下调心肌细胞miRNA-199a 的表达,上调其靶基因PPAR-δ的表达,可能是PNS 改善心肌能量代谢,增强脂肪酸β氧化的作用机制之一。
综上所述PNS 具有显著直接抑制心肌细胞肥大的效应;PNS 干预MiR-199a/PPAR-δ调控、改善心肌能量代谢可能是其抑制心肌细胞肥大的作用机制之一。PNS改善能量代谢抑制心肌细胞肥大过程中是否涉及葡萄糖有氧氧化、糖酵解等其他能量代谢途径尚需要进一步探索研究。这将为改善心肌肥厚、防治心衰提供新的视点和思路。