弓形虫沉默信号调节子2(TgSir2)的克隆表达与多克隆抗体制备
张芳菲, 曹佳欣, 王晨红, 毛懿杰, 华倩倩, 刘淑贤, 谭 峰, 胡 昕
刚地弓形虫广泛寄生于人和动物的有核细胞内,引起弓形虫病[1]。据统计,全世界约有1/3人群属于弓形虫隐性感染人群[2]。当机体免疫力受损或抑制,缓殖子期可转化为速殖子期,在患者体内播散,造成多器官炎症反应,严重可致死亡[3-4]。然而目前对弓形虫病的治疗主要针对的是显性感染阶段速殖子,无法根除隐性感染人群体内的缓殖子,阻碍了疾病的治疗[5]。
沉默信号调节子2(Silent information regulator 2, Sir2),是一类高度保守的、烟酰胺腺嘌呤二核苷酸(NAD+)依赖的组蛋白去乙酰化酶(histone deacetylase, HDAC),属第III类HDAC家族——sirtuins家族[6-7],其底物包括组蛋白、非组蛋白等多种蛋白[7]。
Sir2最早发现于酵母细胞中,随后在多种原核、真核细胞中被证实。人体内,Sir2被命名为SIRT2。SIRT2既可定位胞浆,也可入核,对胞浆蛋白、组蛋白或转录因子进行去乙酰化修饰,参与微管动力学、氧化应激反应、细胞周期调控等许多生理和细胞活动,与肿瘤、衰老、II型糖尿病等疾病密切相关[7]。
然而,在弓形虫体内尚未见TgSir2蛋白的相关研究报道。据此,本研究利用生物信息学分析方法,在弓形虫基因组中挖掘出与酵母细胞TgSir2蛋白的同源蛋白,通过原核表达TgSir2,制备其多克隆抗体,为进一步研究该蛋白功能提供实验材料。
1 材料与方法
1.1 材 料
1.1.1虫株、质粒、菌株及实验动物 弓形虫RH株速殖子、人包皮成纤维细胞(HFF)、原核表达载体pET28b、大肠埃希菌(E.coli)DH5α和BL21均为本实验室保存,新西兰大白兔购自温州医科大学实验动物中心。
1.1.2逆转录PCR(RT-PCR)引物的设计与合成 根据ToxoDB中TgSir2基因编码序列(TGGT1_227020),分别设计去除信号肽片段的上游引物(TgSir2△1-15aa-F: 5′GAATTCTTGCCTCTTTGAGCCTCATGAAC-3′)和下游引物(TgSir2△1-15aa-R: 5′-GCGGCCGCCTATCTCCTTTGCAGCGCC-TT-3′),下划线部分分别为限制性内切酶EcoRI和NotI的酶切位点。引物由上海祥音生物科技有限公司合成。
1.1.3主要试剂 Trizol Reagent试剂盒、4×蛋白上样缓冲液购自美国Invitrogen 公司;逆转录试剂盒RNA PCR Kit(AMV)Ver3.0购自日本Takara公司;KAPA HiFi HotStart ReadyMix PCR Kit购自美国KAPA Biosystems公司;DNA凝胶回收试剂盒和质粒提取试剂盒购自美国OMEGA Bio-tek公司;限制性内切酶NotI、EcoRI和T4 DNA连接酶购美国Thermo Fisher Scientific公司;GoTaqTMGreen Master Mix购自美国Promega公司;异丙基-β-D-硫代半乳糖苷(IPTG)购自美国Sigma公司;蛋白酶抑制剂购自瑞士Roche 生物公司;蛋白纯化镍柱Ni-NTA Agarose购自QIAGEN公司;鼠源抗His单克隆抗体购自美国CMCTAG公司;Dlight 488山羊抗兔IgG抗体购自美国EarthOx life science公司;辣根过氧化物酶标记的山羊抗小鼠IgG抗体、山羊抗兔 IgG 抗体购自合肥市Biosharp生物科技公司,0.22 μm PVDF转移膜购自美国Millipore公司。
1.2 方 法
1.2.1生物学信息分析 在弓形虫数据库ToxoDB中,采用Blast序列比对软件进行氨基酸序列比对,寻找与酵母Sir2相似性最高的蛋白序列,并利用ClustalW软件将TgSir2与其他物种Sir2同源物进行同源比对。
1.2.2目的片段扩增将RH株速殖子在HFF宿主细胞中常规培养(1%胎牛血清的DMEM)。待虫体完全出胞后,将虫体经3 μm滤器纯化后以Trizol法提取总RNA并逆转录合成cDNA,以cDNA为模板,扩增TgSir2△1-15aa编码序列(去除1-15位氨基酸的编码序列)反应体系为:cDNA(<1 ng),上、下游引物(10 nmol)各1.5 μL,2×Kapa HiFi hotstart ready mix 25 μL,加去离子水至50 μL。反应条件为:95 ℃预变性1 min,98 ℃变性30 s、60 ℃退火30 s、72 ℃延伸1 min,共30个循环,72 ℃再延伸10 min。
1.2.3重组质粒pET28b-TgSir2△1-15aa的构建与鉴定 用NotI和EcoRI酶分别双酶切pET-28b载体、PCR目的片段。胶回收酶切产物,连接后将连接产物转化入DH5α感受态细胞,涂Kan LB固体培养基平板筛选阳性单克隆,提质粒通过PCR扩增和双酶切鉴定后,阳性质粒送北京六合华大基因科技有限公司测序验证。
1.2.4TgSir2蛋白诱导表达、纯化与鉴定 将测序正确的重组质粒转化入BL21感受态细胞,挑取单克隆菌落,经IPTG于16 ℃ 220 r/min振荡诱导22 h。将诱导后产物离心收集菌体,超声裂解后4 ℃ 12 000 r/min离心10 min,镍柱纯化上清中的TgSir2融合蛋白,随后以小鼠抗His单克隆抗体作为一抗(1∶1 000),羊抗小鼠HRP-IgG作为二抗(1∶5 000),进行12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)与Western blotting分析。
1.2.5抗体制备 将纯化后的TgSir2融合蛋白背部皮下多点注射免疫2只新西兰大白兔,初次免疫以1 mg,之后每隔15 d,0.5 mg抗原加强免疫1次,共4次。
1.2.6抗体效价和特异性鉴定 免疫结束后,采集兔血清,以His-TgSir2△1-15a蛋白包被酶标板,间接酶联免疫吸附试验(ELISA)法检测免疫后兔血清抗体效价。待血清效价达到1∶64 000后常规心脏取血,收集两只兔血清,分别命名为1号和2号免疫兔抗TgSir2血清,于-80 ℃保存备用。同时将纯化的His-TgSir2△1-15a蛋白经SDS-PAGE分离,转膜、封闭,后依次用经亲和层析纯化的1号和2号免疫兔抗TgSir2多克隆抗体作为一抗,羊抗兔HRP-IgG作为二抗,电化学发光试剂(ECL)显色,观察结果。
1.2.7多抗识别弓形虫内源性TgSir2将从弓形虫中提取的蛋白(按步骤1.2.2收集弓形虫RH株速殖子,超声裂解虫体后,取上清)行SDS-PAGE后,以制备的兔抗TgSir2多克隆抗体(1∶500)作为一抗,羊抗兔HRP-IgG(1∶5000)作为二抗,Western blotting检测抗体特异性。HFF细胞提取的蛋白为阴性对照。
2 结 果
2.1生物学信息分析 通过Blast软件发现一个TgSir2基因(ToxoDB:TGGT1_227020),其在ToxoDB数据库中的基因注释为组蛋白去乙酰化酶。利用ClustalW进行同源比对,发现虽然TgSir2与酵母、人Sir2相似性较低,但其酶活性中心却高度保守,尤其是与疟原虫Sir2蛋白相似性最高(图1A)。用Signal 4.1软件对其表达的蛋白进行信号肽预测,发现TgSir2蛋白存在一段长度为15个氨基酸的信号肽(图1B)。
2.2TgSir2基因的PCR扩增结果 TgSir2△1-15aa基因片段的理论大小为1 038 bp,PCR产物经琼脂糖凝胶电泳后,在约1 000 bp处可见一条清晰的特异性扩增条带,与TgSir2△1-15aa基因片段的理论大小(1 038 bp)一致(图2)。
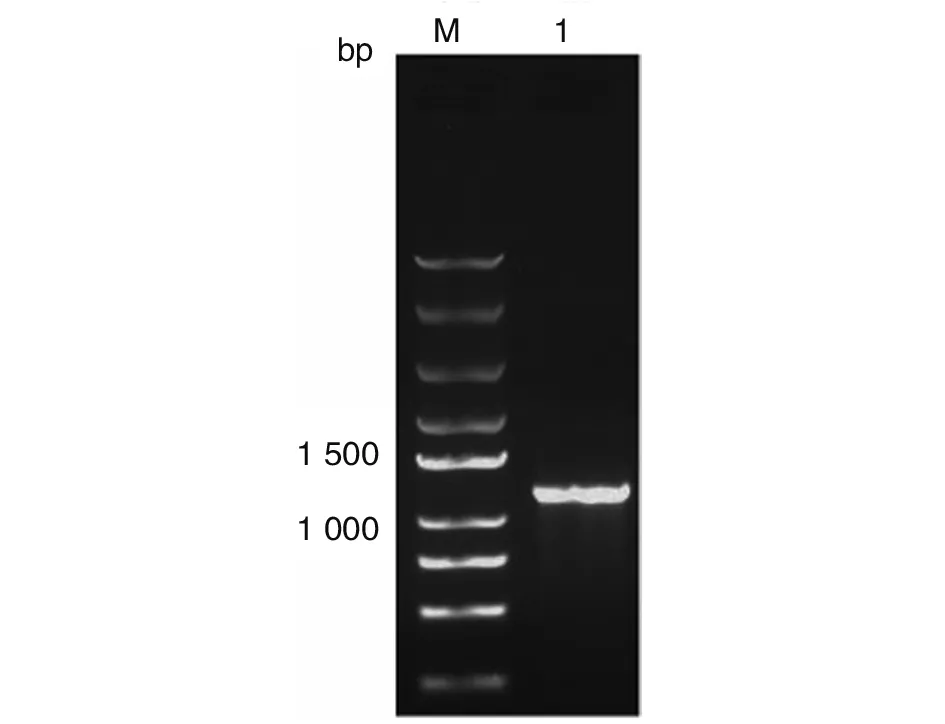
M:DNA标志物;1:TgSir2△1-15aa基因PCR产物
2.3重组质粒pET28b-TgSir2△1-15aa的鉴定 重组质粒pET28b-TgSir2△1-15aa经PCR扩增和双酶切鉴定,目的基因片段均约为1 000 bp(图3),测序表明pET28b-TgSir2质粒构建正确。
2.4TgSir2融合蛋白的表达、纯化和鉴定 将鉴定正确的重组质粒pET28b-TgSir2转化至BL21表达菌中,以IPTG诱导表达后,经镍柱纯化,SDS-PAGE检测可见大量目的蛋白,其蛋白大小符合预

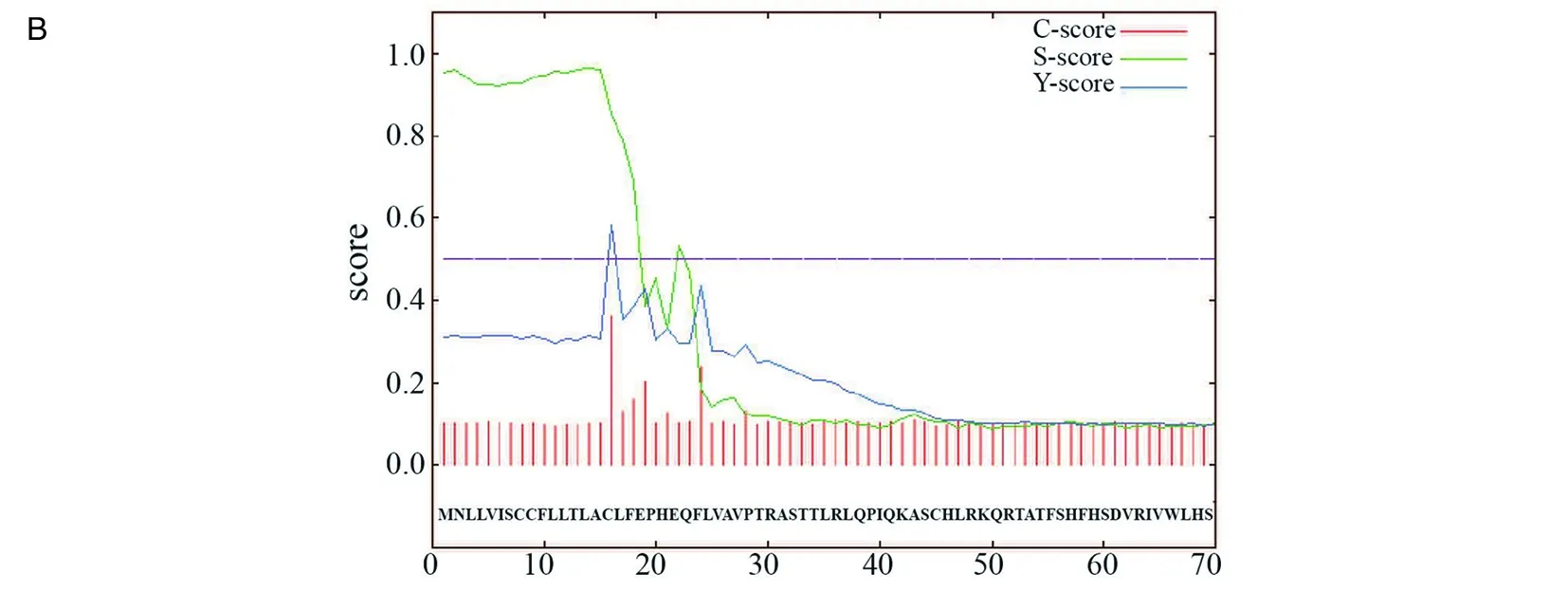
a表示构成酶活性的关键氨基酸残基;b表示NAD+结合位点;c表示既可结合NAD+,同时也是酶活性关键氨基酸残基;d表示构成锌指结构的关键氨基酸残基。
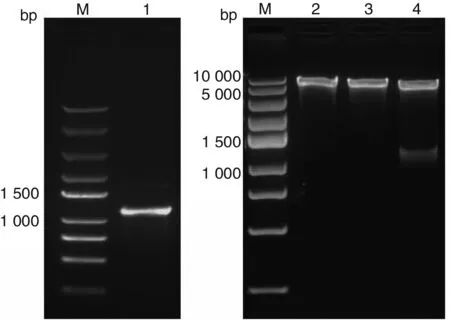
M:DNA标志物;1:阳性克隆PCR产物;2:pET28b;3:pET28b-TgSir2重组质粒;4:pET28b-TgSir2重组质粒双酶切
期(图4A)。随后经Western blotting检测,TgSir2融合蛋白能被小鼠抗His单克隆抗体识别,在相应分子量大小处有特异条带(图4B)。
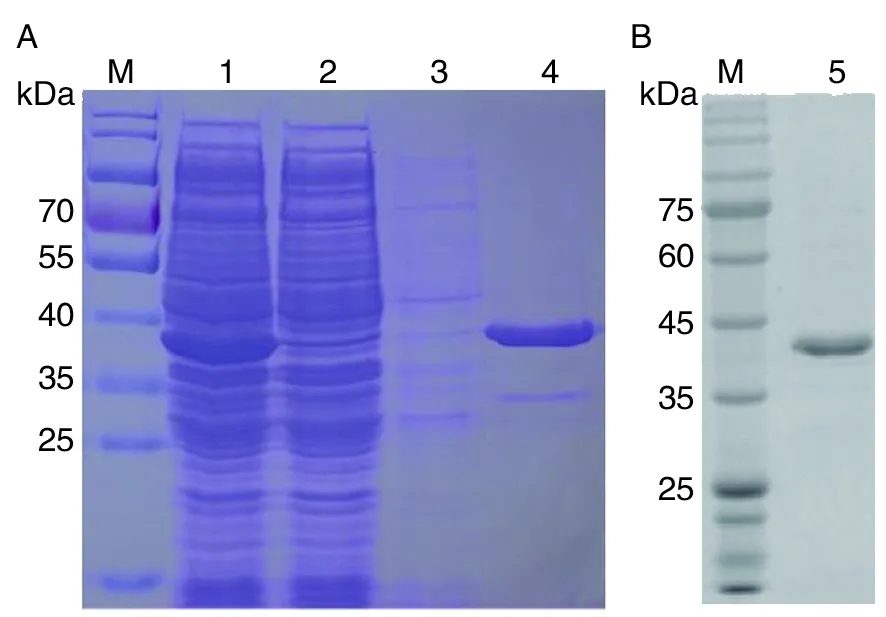
M:蛋白质标志物;1:诱导后样品;2:诱导前样品;3:PBS洗脱液;4:纯化后融合蛋白;5. 纯化后融合蛋白
2.5兔抗TgSir2多克隆抗体鉴定 经4次免疫后,以免疫前兔血清为对照,ELISA法测定2只免疫兔抗His-TgSir2血清效价均达1∶64 000。将2只兔血清收集后经亲和层析纯化,Western blotting检测显示,所制备的抗体能够特异性识别原核表达
的TgSir2融合蛋白(图5)。
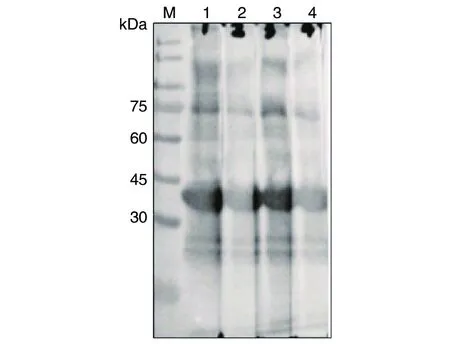
M:蛋白质标志物;1:1号免疫兔抗TgSir2多克隆抗体作为一抗(1∶8 000);2:1号免疫兔抗TgSir2多克隆抗体作为一抗(1∶16 000);3:2号免疫兔抗TgSir2多克隆抗体作为一抗(1∶8 000);4:2号免疫兔抗TgSir2多克隆抗体作为一抗(1∶16 000)
2.6评价兔抗TgSir2多克隆抗体识别弓形虫内源性TgSirt蛋白的能力 提取弓形虫全虫蛋白,经SDS-PAGE与Western blotting检测,发现兔抗TgSir2多克隆抗体不但可以与预期大小的目的条带(图6箭头所指处)特异性结合,同时在70 kDa左右也有一条反应条带。而宿主细胞对照组作为阴性对照,与兔抗TgSir2无特性性结合(图6)。
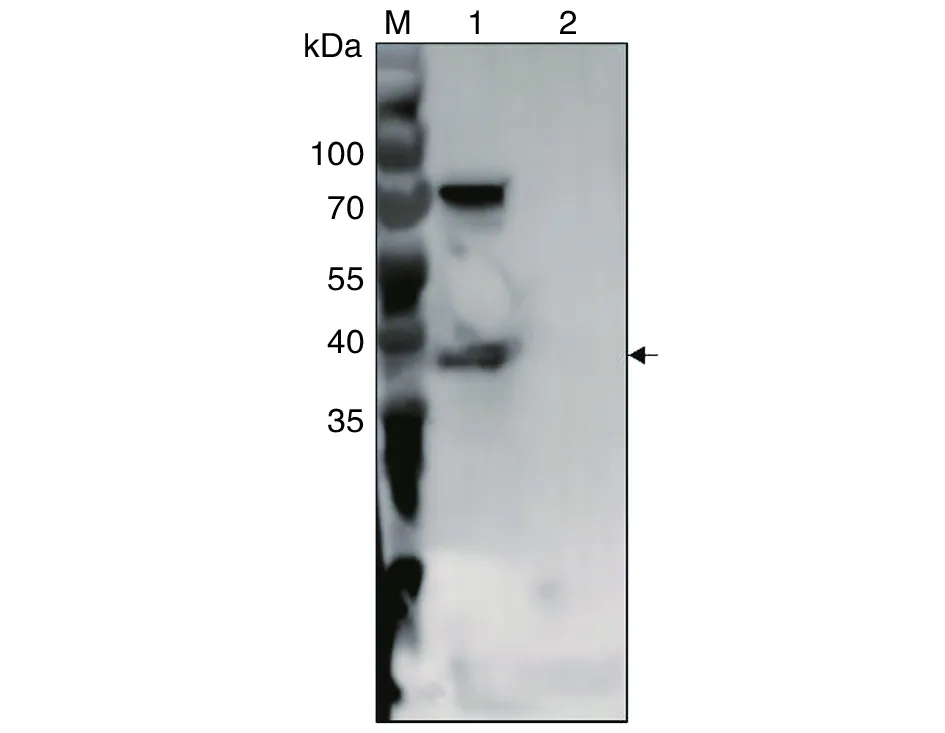
M:蛋白质标志物;1:弓形虫速殖子全虫蛋白;2:HFF细胞蛋白
3 讨 论
Sir2同源物目前已在溶组织内阿米巴[8]、锥虫[9-11]、利什曼原虫[12-14]、疟原虫[15-16]等多种寄生性原虫体内被发现,其功能涉及修复损伤DNA[11]、参与虫体入侵与增殖[10, 17]、调节宿主免疫应答[11-12]、调控虫体抗原变异基因从而逃避宿主免疫应答[18]等。因此,在多种寄生性原虫病防治中,Sir2蛋白是一个具有研发前景的药物、疫苗靶点[18-22]。在本实验室前期研究过程中发现,TgSir2蛋白无法利用传统的double-crossover策略进行基因敲除,提示该蛋白是虫体生长发育过程中的必需蛋白。
Sir2结构中包含了保守的NAD+结合域和2个酶活性核心域:Rossmann折叠构成大结构域、锌指结构(CX2CX20CX2C)构成小结构域。在2个结构域之间的缝隙中,乙酰化肽段与NAD+结合形成酶-底物结构而发生催化反应[3]。通过蛋白质同源性分析,我们发现,虽然TgSir2蛋白与其他种属Sir2蛋白的序列相似度较低,但是核心功能域高度保守。这预示着TgSir2在弓形虫中可能具有调节蛋白质去乙酰化的功能。随后,我们通过信号肽预测发现,TgSir2蛋白可能作为一种分泌蛋白发挥作用。而这一信号肽在其他物种Sir2蛋白中尚未发现。
本实验原核表达并纯化了重组TgSir2蛋白,并以此为抗原成功制备了效价达1∶64 000的兔抗TgSir2多克隆抗体,适合进行后续实验。进一步的Western blotting实验结果显示,该多抗既可识别原核表达的TgSir2融合蛋白,也可识别弓形虫体内的内源性TgSir2蛋白。然而,在多抗识别内源性TgSir2蛋白的Western blotting实验中,我们发现该抗体与虫体蛋白反应后,不但出现了预期大小的目的条带,还出现了一条分子量更大的蛋白条带。尽管经过多次重复实验,该条带仍然存在,而对照组宿主细胞中却并未检测到任何条带,因此,我们认为本研究中所制备的抗体是特异针对弓形虫蛋白的多克隆抗体。由于该条带的大小接近于目的条带的两倍,我们推测可能由以下3个原因:1)TgSir2在弓形虫体内很可能以二聚体的形式存在并发挥生物学功能;2)作为一种修饰酶,TgSir2在弓形虫生长发育过程中与某种蛋白发生了共价结合,从而发挥作用;3)该抗体除了可以识别弓形虫TgSir2蛋白,还可能与虫体内某种分子量约70 kDa的蛋白结合。以上推测,我们将在后续研究中进一步通过亲和层析与质谱分析进行验证。
由于本实验已证实所制备的兔抗TgSir2多克隆抗体可识别弓形虫内源性TgSir2,这将为进一步研究弓形虫内的TgSir2分子机制及去乙酰化修饰机制提供了必要的实验工具。
利益冲突:无

