添加不同表面活性剂对胞苷发酵的影响
赵贝贝,方海田*,刘慧燕,马若霜,王茹,刘予煊,李金娜
1(宁夏食品微生物应用技术与安全控制重点实验室,宁夏 银川,750021) 2(宁夏大学 农学院,宁夏 银川,750021)
胞苷(cytidine)又称胞嘧啶核苷、1-β-D-呋喃核苷胞嘧啶[1-2],在生物体的生理生化过程中起着非常重要的作用[3-4]。以胞苷为原料的胞苷类似物作为临床药物应用广泛[3],主要用于生产抗肿瘤、抗病毒药物的中间体,是制造阿糖胞苷(Ara-CR)、环胞苷(Cyclo C)、三磷酸胞苷(CTP)等药物的主要原料,也可作为核苷类功能食品配料[5-8]。目前胞苷的生产方法主要是添加前体物发酵法和直接发酵法,具有成本低、周期短、产量高等优势,近年来通过发酵法提高胞苷产量的研究逐渐增多。胞苷的发酵单位与菌体细胞膜的渗透性存在密切关系[9]。发酵过程中添加表面活性剂能提高细胞膜的通透性,减少营养物质和氧进入细胞的传递阻力,从而提高发酵过程中目的代谢物的产量[10-11]。LIANG等[12]研究发现添加16 g/L Tween-80改变了根癌农杆菌细胞膜的精细结构,增加了细胞膜通透性,使凝胶多糖的产量明显提高。SHENG等[13]研究了Tween-80对普鲁兰多糖产生、细胞生长、葡萄糖基转移酶活性和脂肪酸组成的影响,结果发现Tween-80的添加对生物量没有影响,可显著提高普鲁兰多糖的产量;GALINDO等[14]发现添加Triton X-100的发酵体系中溶氧量明显高于对照,黄色素的产率提高了1.45倍。研究发现,Triton X-100可诱导提高竹红菌素的产量且能明显缩短了发酵时间[15-16];温琦等[17]添加阳离子型表面活性剂CTAB使透明质酸产量提高了20%。目前国内外有关表面活性剂对发酵产物产量影响的报道较多,但在表面活性剂对胞苷发酵影响方面的研究尚未见报道。
本文主要选择了Tween-80、TritonX-100、十六烷基三甲基溴化铵(hexadecyl trimethyl ammonium broxide,CTAB)和乙胺丁醇二盐酸盐(ethambutol dihydrochloride,EMB)4种表面活性剂作为胞苷发酵的促进剂,在摇瓶条件下研究了4种表面活性剂对细菌生长、耗糖速率和胞苷发酵单位的影响,为进一步提高胞苷发酵产量奠定基础。
1 材料与方法
1.1 试验材料
菌株:大肠杆菌EscherichiacoliBG-12为本实验室保藏。
试剂:蛋白胨、酵母粉、NaCl、琼脂、Tween-80、CTAB、EMB、Triton X-100等均为市售分析纯。
1.2 培养基
斜面活化培养基(g/L):蛋白胨10,酵母粉5,NaCl 10,琼脂20,pH 7.0~7.2,121 ℃灭菌20 min。
种子培养基(g/L):蛋白胨10,(NH4)2SO42,NaCl 10,葡萄糖5,pH 7.0~7.2,115 ℃灭菌15 min。
摇瓶发酵培养基(g/L):葡萄糖100,玉米浆40,K2HPO410,KH2PO40.5,FeSO410 mg,MnSO410 mg,MgSO4400 mg,pH 7.0~7.2,苯酚红(0.1%)20 mL/L,115 ℃灭菌15 min,0.5% CaCO3(单独灭菌)。
1.3 主要仪器
LRH-150-B型生化培养箱,广东省医疗器械厂;BSD-WX2200卧式智能精密型摇床,上海博迅实业有限公司;UV-752N分光光度计,上海精科实业有限公司;SBA-40E生物传感分析仪,山东省科学院生物研究所;LC-16型岛津液相色谱仪,北京岛津医疗器械有限公司。
1.4 培养方法
1.4.1 菌种活化
取保藏菌种划线接种于斜面培养基,37 ℃恒温静置过夜培养。
1.4.2 种子培养
从活化斜面上取一环生长状况良好的菌种转接到装有50 mL种子培养基的500 mL三角瓶装液量,9层纱布封口,置于旋转式摇床上(200 r/min)振荡培养12 h。
1.4.3 发酵培养
吸取5.0 mL培养好的种子发酵液至装有45 mL发酵培养基的500 mL挡板三角瓶中,置于旋转式摇床上,37 ℃、200 r/min振荡培养40 h。
1.4.4 表面活性剂溶液的配制
将Tween-80配制为质量分数为10.0%的溶液待用;将TritonX-100、CTAB、EMB配制为10 mg/mL的母液,在无菌条件下,以不同添加浓度,吸取相应的表面活性剂母液于10 h时添加到发酵液中。表面活性剂的添加量如表1所示。

表1 不同种类表面活性剂的添加量Table 1 The addition of different kinds of surfactants
1.5 分析方法
1.5.1 菌体量测定方法
分别取不同发酵时间的发酵液,用蒸馏水稀释20倍,采用752型分光光度计于600 nm处测其吸光值。
1.5.2 葡萄糖质量浓度的测定
取不同发酵时间的发酵液,稀释发酵液到其中葡萄糖质量浓度为0~1 g/L,采用SBA-40C生物传感分析仪测定。
1.5.3 胞苷产量测定
取不同发酵时间的发酵液13 000 r/min离心5 min,取上清液采用高效液相色谱仪测定发酵液中胞苷产量。色谱条件为:色谱柱Agilent C18(5 μm,250 mm×4.6 mm),流动相V(乙腈)∶V(水)=4∶96,流速为1.0 mL/min,检测波长为270 nm,柱温30 ℃,检测器为紫外检测器。
2 结果与讨论
2.1 添加Tween-80对胞苷发酵的影响
在发酵过程中,添加不同质量浓度的Tween-80对胞苷产量、菌体生长及耗糖速度的变化进行了分析。结果如图所示。由图1可以看出不同质量浓度的Tween-80质量对菌体的生长影响不大。当Tween-80浓度为5 g/L时,菌株生长最快,3 g/L时生长最慢,说明较高质量浓度的Tween-80没有抑制菌株的生长。

图1 不同质量浓度Tween-80下的菌株生长曲线Fig.1 Growth curve of strain Tween-80 with different concentration
由图2可以看出,菌株的耗糖速率是呈现先上升后下降的趋势。在0~20 h由于菌株进入对数生长期,生长迅速耗糖速率不断增加,20 h后可能由于菌株的生长不以葡萄糖为直接的营养物质,消耗葡萄糖逐渐减慢,在38 h后葡萄糖的消耗又逐渐增多,由于发酵液中其他营养物质的消耗或其他物质又转化为葡萄糖为菌株代谢所用。对比发现不添加Tween-80的发酵液葡萄糖的消耗速率整体最快,在20 h为0.875 g/(L·h),为添加5 g/L Tween-80的1.86倍,而添加5 g/L Tween-80的耗糖速率整体最慢,可能是高浓度的Tween-80可以促进其他营养物质的消耗,减少对葡萄糖的消耗速率。总体来说,Tween-80的添加可以降低菌株对葡萄糖的消耗速率。而菌体密度与耗糖速率呈现相反的变化趋势,说明添加Tween-80菌株的生长与葡萄糖的消耗不是线性关系,在发酵液中菌株的生长不以葡萄糖为最主要的营养物质。
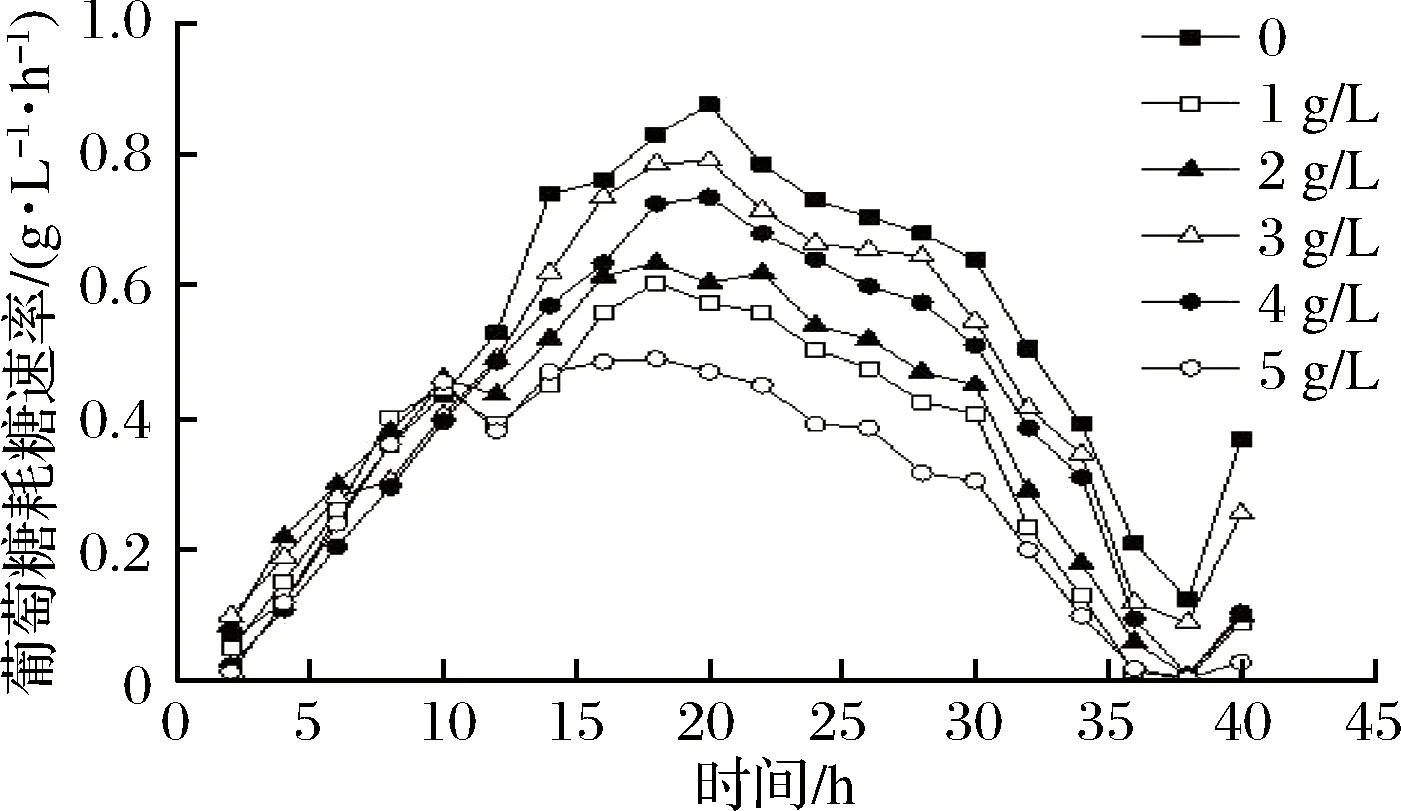
图2 不同质量浓度Tween-80下的菌株耗糖速率曲线Fig.2 Curve of sugar consumption rate of strain Tween-80 with different concentration
由图3可知,发酵40 h过程中胞苷的产量随时间呈现逐渐增加的趋势。在发酵20 h后胞苷产生速度加快开始大量积累,当Tween-80添加量为1~4 g/L时,都有助于胞苷的产生积累,添加量为3 g/L时,胞苷的积累远远大于对照组。添加量为5 g/L时,则胞苷的产量明显低于其他实验组。

图3 不同质量浓度Tween-80对胞苷发酵的影响Fig.3 Effect of different concentrations of Tween-80 on cytidine fermentation
发酵40 h结束后,添加不同浓度的Tween-80的胞苷产量如图4所示。

图4 不同质量浓度Tween-80对胞苷发酵40 h产量的影响Fig.4 Effects of different concentrations of Tween-80 on 40 h production by cytidine fermentation
可知,适量Tween-80的添加有助于胞苷产量的提高。其中,Tween-80最适添加量为3 g/L,其产量为1.696 g/L是对照组的2.42倍,高浓度的Tween-80则抑制了胞苷的产量。另外,添加Tween-80时葡萄糖的消耗速率越快则胞苷的产量越多,因此可以用葡萄糖的消耗速率衡量胞苷产量的高低。
非离子表面活性剂Tween-80对菌体的生长影响较小,对菌体的伤害不明显。有文献报道添加0.1~10 g/L的表面活性剂对微生物生长的抑制作用较小[18-19],本实验也得到相同的结果。另外,营养培养基中存在Tween-80不影响细胞生长,Tween-80不是屎肠球菌ATCC 31749的营养物[20],这与本实验的结果一致。添加Tween-80可以微弱降低对葡萄糖的消耗速率,可能原因是Tween-80改变了细胞膜的通透性,从而使发酵培养基中其他营养物质的吸收增加,改变了菌株对培养基中物质的吸收分解代谢通路的变化。当Tween-80的质量浓度高于4 g/L时,胞苷的产量就会迅速降低,可能与葡萄糖的消耗速率较低和菌株本身的性质有关,在大于4 g/L浓度时不利于该菌株向合成代谢物胞苷的方向移动。
2.2 TritonX-100对胞苷发酵的影响
选择TritonX-100的质量浓度分别为0.4、0.8、1.2、1.6和2.0 g/L。TritonX-100对菌体生长、葡萄糖耗糖速率、胞苷产量的影响,结果如图5~图8所示。
由图5可知,不同浓度TritonX-100对菌株生长有一定的影响。在适宜的浓度范围内,TritonX-100可以促进菌株的生长。在TritonX-100质量浓度大于0.8 g/L时菌株的生长将受到抑制,且浓度越大抑制作用越强。

图5 不同质量浓度TritonX-100下的菌株生长曲线Fig.5 Growth curve of strain TritonX-100 with different concentration
由图5、图6可知,不同浓度TritonX-100对菌株耗糖速率和菌体生长呈相同的变化趋势,在一定的浓度范围内,低浓度促进高浓度则抑制。在20 h时,各菌株的耗糖速率均达到最大,当TritonX-100为0.8 g/L,20 h的耗糖速率为0.915 g/(L·h),为对照组的1.05倍。

图6 不同质量浓度TritonX-100下的菌株耗糖速率曲线Fig.6 Curve of sugar consumption rate of strain TritonX-100 at different concentrations
由图7、图8可见,添加0.4~2.0 g/L的TritonX-100均抑制胞苷的产生。胞苷产量随发酵时间逐渐增多,在发酵25 h后胞苷的积累速度加快。当TritonX-100添加浓度为1.6 g/L时,其胞苷产量较大,发酵40 h胞苷产量最高为0.362 g/L,是对照组的0.52倍,而该浓度的菌体生长和耗糖速率均较低,即1.6 g/L的TritonX-100对菌株的生长有影响,但对胞苷的胞外分泌量的抑制作用最弱。
图7 不同质量浓度TritonX-100对胞苷发酵的影响Fig.7 Effect of different concentrations of TritonX-100 on cytidine fermentation

图8 不同质量浓度TritonX-100对胞苷发酵40 h产量的影响Fig.8 Effects of different concentrations of TritonX-100 on 40 h production by cytidine fermentation
TritonX-100的添加对菌体的生长有一定的影响,呈现低浓度促进高浓度抑制的现象。低质量浓度(小于1.2 g/L)的TritonX-100促进菌体的生长,当TritonX-100质量浓度在0.8 g/L时,菌体生长最快,明显优于对照组。TritonX-100的添加对菌株葡萄糖的耗糖速率和菌体生长呈现一致的变化趋势,说明添加TritonX-100使菌株的生长主要依赖于葡萄糖。当添加TritonX-100的质量浓度为0.8 g/L时,菌体生长和耗糖速率均较低,而胞苷产量比其他添加组较高,说明添加TritonX-100对产物胞苷的积累有影响,使胞苷的合成不以葡萄糖为主要的营养物质。
2.3 添加CTAB对胞苷发酵的影响
在发酵培养基中添加质量浓度分别为0.4、0.8、1.2、1.6和2.0 mg/L的CTAB,考察其对菌体生长、葡萄糖耗糖速率、胞苷产量的影响,结果如图9~图12所示。
由图9、图10可知,CTAB在0.4~2 mg/L时,对菌株的生长和耗糖速率影响不大,且在该浓度范围内,菌株的生长和耗糖速率呈相同的变化趋势。

图9 不同质量浓度CTAB下的菌株生长曲线Fig.9 Growth curve of strain CTAB with different concentration

图10 不同质量浓度CTAB下的菌株耗糖速率曲线Fig.10 Curve of sugar consumption rate of strain CTAB with different concentration
由图11、图12可知,添加0.4~2 mg/L的CTAB,与对照组相比,均抑制了胞苷的产生。在该浓度范围内菌株生长和耗糖速率均与对照组相差不大,而胞苷产量明显减少,说明添加CTAB不利于胞苷的积累。有研究也表明添加各种表面活性剂对微生物的毒性不同,一般来说阳离子表面活性剂对生物的毒性较大[21]。本试验也证明添加CTAB对大肠杆菌BG-12的生长和耗糖速率影响不大,但对发酵产胞苷是不利的。

图11 不同质量浓度CTAB对胞苷发酵的影响Fig.11 Effect of different concentrations of CTAB on cytidine fermentation

图12 不同浓度CTAB对胞苷发酵40 h产量的影响Fig.12 Effects of different concentrations of CTAB on 40 hour production by cytidine fermentation
由图11和图12可知,添加CTAB的质量浓度在0.4~2 mg/L,对菌体的生长、葡萄糖消耗速率影响不大且均有一定的促进作用,说明添加CTAB时,菌株的生长主要依赖于葡萄糖的消耗。随着添加CTAB的质量浓度的增加,胞苷的发酵抑制加强几乎停止。一般来说,阳离子表面活性剂对生物的毒性较大[21-22]。实验结果表明,添加质量浓度0.4~2 mg/L的CTAB对大肠杆菌BG-12的生长速率、葡萄糖的耗糖速率影响不大,但对代谢产物胞苷的积累产生明显的抑制作用。
2.4 添加EMB对胞苷发酵的影响
在发酵培养基中添加质量浓度分别为5、10、15、20和25 mg/L的EMB,考察其对菌体生长、葡萄糖耗糖速率、胞苷产量的影响,结果如图13~图16所示。
由图13、图14可知,添加EMB质量浓度为5~25 mg/L,对菌株生长和耗糖速率影响不大。

图13 不同质量浓度EMB下的菌株生长曲线Fig.13 Growth curve of strain EMB with different concentration

图14 不同质量浓度EMB下的菌株耗糖速率曲线Fig.14 Curve of sugar consumption rate of strain EMB with different concentration
由图15、图16可以看出,添加EMB均抑制了胞苷的产量。说明添加EMB对胞苷产量的积累是有害的。

图15 不同质量浓度EMB对胞苷发酵的影响Fig.15 Effect of different concentrations of EMB on cytidine fermentation

图16 不同浓度EMB对胞苷发酵40 h产量的影响Fig.16 Effects of different concentrations of EMB on 40 hour production by cytidine fermentation
在发酵培养基中分别加入不同质量浓度的EMB,大肠杆菌BG-12发酵产胞苷均较空白试验有不同程度的抑制作用;从菌体生长曲线、葡萄糖的耗糖速率可以看出,加入一定质量浓度的EMB对菌株生长和耗糖影响不大,菌体的生长还是主要依赖于葡萄糖的消耗。
综合比较认为,添加Tween-80的效果较好,可将胞苷产量最多提高2.42倍。
2.5 表面活性剂对胞苷产量的影响
利用SPSS分析软件对添加不同种类和含量的4种表面活性剂的胞苷产量进行方差分析,结果见表2。

表2 添加不同种类表面活性剂对胞苷产量的组统计量Table 2 Group statistics of cytidine production with different surfactants
从表2可以看出,Tween-80、CTAB和EMB的P值均小于0.05,表示有统计学差异,说明添加不同浓度的表面活性剂可以影响菌株BG-12的胞苷产量,有效影响菌株BG-12胞苷的生物合成量,为添加表面活性剂对胞苷合成奠定了基础。
3 结论
非离子表面活性剂Tween-80可在一定添加量范围内有利于胞苷发酵单位的提高。Tween-80添加量在1~5 g/L时,对菌体的生长影响不大;对葡萄糖的耗糖速率均有所下降,发酵20 h时耗糖速率均达到最大,且添加量为5 g/L时耗糖速率仅为对照组的0.54倍;添加量在1~4 g/L时,均有促进胞苷发酵单位的提高,其中,Tween-80最适添加量在3 g/L,发酵40 h时其产量为1.696 g/L,是对照组的2.42倍。
TritonX-100对菌株生长和耗糖速率均有一定的影响,当添加量大于0.8 g/L会抑制菌株的生长和耗糖速率,浓度越大抑制作用越强,在20 h时,添加2.0 g/L TritonX-100,耗糖速率仅为对照组的0.59倍;当TritonX-100添加质量浓度为1.6 g/L时,胞苷产量为0.362 g/L,是对照组的0.52倍。添加0.4~2 mg/L 质量浓度的CTAB和5~25 mg/L的EMB,对菌株生长和耗糖速率影响不大,在该质量浓度范围内均抑制胞苷的积累,可见CTAB和EMB对胞苷发酵是不利的。
不同类型的表面活性剂性质不同,对微生物的生长及代谢产物的积累亦不同。非离子表面活性剂Tween-80对菌体生长的影响较弱,但对胞苷的积累有较大的影响,当添加3 g/L发酵40 h时其产量达到最大。可能原因是添加表面活性剂Tween-80可以增加细胞膜的通透性,减少氧及营养物质进入细胞的传递阻力,改善发酵体系的供氧能力。非离子表面活性剂TritonX-100,该菌种对其比较敏感,加入剂量在0.4~2 g/L均抑制胞苷的积累。对于添加表面活性剂TritonX-100、CTAB和EMB均抑制胞苷的积累,可能是由于在加入表面活性剂后,在菌体表面进行了沉积和结合,改变了细胞的通透性降低氧传递,从而减弱发酵体系的供氧能力同时增加了代谢产物的副反馈作用,使代谢产物胞苷的积累大大减少。综合分析造成以上结果的原因可能在于,不同的表面活性剂,因其不同的结构和化学性质,当其干扰大肠杆菌BG-12细胞膜合成,造成细胞膜渗漏、缺失等效果,会产生不同的影响效果。本实验研究表明,添加适合浓度的表面活性剂对于胞苷发酵单位的提高有一定的促进作用,但是浓度过高时产量将受到抑制,这可能是表面活性剂浓度过高,对菌体造成伤害,导致代谢产物的产量下降。本试验中在最适的添加浓度下,Tween-80添加后胞苷产量提高2.42倍,且Tween-80对菌体的生长影响不大,表现出添加Tween-80优于TritonX-100。Tween-80、TritonX-100同属非离子型表面活性剂也因其结构、性质和浓度的不同,而影响大肠杆菌BG-12的发酵代谢,其中Tween-80表现出高浓度抑制、低浓度促进的现象。在发酵液中添加Tween-80,减少胞苷在细胞内的沉积,从而促进胞苷发酵单位的提高。

