磁珠固定化结核分枝杆菌二氢叶酸还原酶及其表征
周伟,卢进鹏,李亚平,杨林玉,胡小蕾,廖飞,杨晓兰
1重庆医科大学 检验医学院 临床检验诊断学教育部重点实验室,重庆 400016
2重庆理工大学 药学与生物工程学院,重庆 400054
结核(Tuberculosis,TB)是由致病性结核分枝杆菌引起的全球流行病[1]。2016年约1 040万人患结核,发病率高于艾滋病,是全球主要的公共卫生问题[2]。现有结核治疗策略面临复发、药物副作用和多药耐药的风险[3–5];应对结核,迫切需要新药[6–7]。二氢叶酸还原酶 (Dihydrofolate reductase,DHFR)是细胞核酸代谢途径关键酶,是肿瘤和细菌感染的治疗靶标[8–9]。结核分枝杆菌与人的DHFR氨基酸序列一致性仅为26%左右,基于此结构差异有望设计结核分枝杆菌二氢叶酸还原酶(Mycobacterium tuberculosisDHFR,MtDHFR) 选择性抑制剂[10],使MtDHFR成为结核治疗药物的新靶点[11–12]。基于靶蛋白发现配体类药物先导化合物主要依靠筛选配体库。因此,建立适合筛选MtDHFR抑制剂库的技术体系,对发现治疗结核的化学新药具有重要意义。
传统方法筛选配体库需制备纯化合物库再高通量筛选,库制备成本高且效率低,筛选过程耗时且成本高。天然产物混合物和组合合成混合物作为配体库价值很大,而且库制备成本低且制备效率高,但筛选此类混合物库的技术难度巨大[13–15]。药用MtDHFR抑制剂需要具有高亲和力;目前筛选混合库发现高亲和力配体的方法,主要基于亲和结合、靶蛋白配体复合物分离和LC-MS分析[16–18],但也仅限于成分含量相差不大的混合物库。天然产物混合物或组合合成混合物中有效成分含量未知或极低,如何发现极低含量的有效成分仍是技术挑战[19]。本课题组建立了磁分离靶蛋白配体复合物后LC-MS分析筛选混合物组合库的方法[20–21];在此基础上,优化竞争结合反应体系实现选择性迭代富集,可快速发现混合物中极低含量的高亲和力配体;LC-MS为成套的分析系统,靶蛋白大量活性表达、在磁珠表面固定化并保留其活性,就成为应用此策略的关键。
此前发现,对带6×His标签融合蛋白可用Ni2+-NTA磁珠位点选择性固定化以期保留活性[22],但固定化体系必需Ni2+等重金属离子,而这些重金属离子可能影响固定化酶的活性。羧基磁珠也是固定化蛋白的常用载体,此固定化体系基本不会有重金属离子残留干扰酶活性。本研究经重组表达获得MtDHFR,比较Ni2+-NTA磁珠和活化羧基磁珠固定化对MtDHFR活性、稳定性及抑制剂响应的影响,以探索适合磁分离筛选配体混合物库的MtDHFR固定化方案。
1 材料与方法
1.1 试剂与器材
Ni2+-NTA磁珠 (批号20170714,100 g/L)、羧基磁珠 (Magnetic submicron particles carboxyl subtype F1,MSP-COOH-F1,批号20171121,120 g/L) 购自重庆博蓝鹰生物技术有限公司;三乙醇胺 (Trolamine,TEA)、甲氨蝶呤 (Methotrexate,MTX)、还原型烟酰胺腺嘌呤二核苷酸磷酸(β-NADPH)、β-巯基乙醇购自Aladdin;六水合氯化镍、硫酸铁、异丙基-β-D-硫代半乳糖吡喃糖苷(Isopropyl-beta-D-thiogalactopyranoside,IPTG)、硫酸卡那霉素、2-吗啉乙磺酸 (4- Morpholineethanesulfonic acid,MES) 购自北京鼎国昌盛生物技术有限公司;4-羟乙基哌嗪乙磺酸 (4-(2-hydroxyerhyl)piperazine-1-erhaesulfonic acid,HEPES) 购自北京索莱宝科技有限公司;E.coliBL21 (DE3) 购自成都擎科梓熙生物技术有限公司;pET28a购自中美泰和生物技术有限公司;Ni2+-NTA层析柱购自南京金斯瑞生物科技有限公司;二氢叶酸(Dihydrofolic acid,DHF) 购自Sigma公司;N-羟基琥珀酸亚胺 (N-Hydroxysuccinimide,NHS)、1-(3-二甲基氨基丙基)-3-乙基碳二亚胺(1-(3-Dimethylaminopropyl) -3-ethylcarbodiimide,EDC) 购自东京化成工业株式会社,其他试剂均为国产分析纯。日本岛津UV-2550紫外可见分光光度计 (带恒温系统);其林贝尔QB-9001快速振荡器;Promega 12孔磁分离架;Millipore 8050型超滤杯及再生纤维素超滤膜 (截留蛋白分子量>10 kDa)。
1.2 MtDHFR重组表达纯化及表征
1.2.1 MtDHFR重组表达纯化
含N端携带6×His标签的pET28a(+):dfrA表达质粒[23]委托中美泰和生物技术有限公司合成。质粒转化至感受态E.coliBL21 (DE3)培养, 经单克隆测序鉴定后,于含有100 mg/L卡那霉素LB液体培养基中,参照文献[23]进行6×His-MtDHFR表达和纯化。用含50 mmol/L KCl的20 mmol/L磷酸钾缓冲液 (pH 7.0)氮气正压(0.15–0.20 Mpa) 超滤浓缩收集蛋白,Bradford法测蛋白浓度[24],15% SDS-PAGE分析蛋白纯度;所得酶蛋白溶液于-80 ℃保存。
1.2.2 MtDHFR的酶学性质表征
MtDHFR活性测定:DHF用含10 mmol/L β-巯基乙醇的50 mmol/L磷酸钾缓冲液 (pH 7.0)溶解至1.0 mmol/L溶液,β-NADPH用去离子水溶解至1.0 mmol/L溶液;反应缓冲液为含50 mmol/L KCl的100 mmol/L HEPES (pH 7.0)[25]。MtDHFR用反应缓冲液稀释至40 mg/L。紫外分光光度计恒温至25 ℃,反应缓冲液调零,反应总体积为1.0 mL,加终浓度均为50 μmol/L的β-NADPH和DHF,400 ngMtDHFR,混匀后延迟10 s用光度计连续监测340 nm处3 min内的消光变化;取消光变化线性范围内的速度 (ΔA/min) 作为初始反应速度 (V),按设定的底物消耗消光系数 (ε=11 800 L/(mol·cm)[26]计算酶活力,1.0 min内转化1.0 μmol底物所需酶量为一个活力单位。
MtDHFR米氏常数:文献报道β-NADPH对MtDHFR的米氏常数KmNADPH和DHF的米氏常数KmDHF均约4 μmol/L[27]。对于双底物酶,使其中一个底物浓度大于10Km时改变另一底物浓度测定酶活,双倒数分析确定表观Km[28]。在1.0 mL含400 ng酶测定体系中,固定DHF终浓度为50 μmol/L,在2–10 μmol/L间改变β-NADPH终浓度 (S),测定初始反应速度 (V),回归分析1/V对β-NADPH浓度倒数1/S响应得KmNADPH;固定β-NADPH终浓度50 μmol/L,在 (0.5–10) μmol/L间改变DHF浓度,同法测定KmDHF。
MtDHFR热稳定性:室温筛选配体操作过程不超过4 h[20–21]。用酶反应缓冲液将MtDHFR稀释到0.1 g/L,于25 ℃和0 ℃保存,不同时刻取MtDHFR溶液10 μL,25 ℃测定酶活分析其变化。
1.3 Ni2+-NTA磁珠固定MtDHFR及表征
1.3.1 Ni2+-NTA磁珠固定MtDHFR
取Ni2+-NTA磁珠悬液 (100 g/L),磁力回收磁珠后用固定缓冲液 (pH 7.0,20 mmol/LTris-HCl) 洗3次并重悬为7.5 g/L。取不同浓度MtDHFR溶液40 μL预冷到0 ℃,200 r/min缓慢加入10 μL Ni2+-NTA磁珠 (约75 μg),冰水浴中200 r/min振摇30 min;磁力分离取上清备测剩余蛋白,磁珠用固定缓冲液小心洗涤3次,每次200 μL,再重悬为3 g/L,于0 ℃保存待用。
1.3.2 Ni2+-NTA磁珠固定MtDHFR的容量及固定酶活性
用Bradford法测酶蛋白量[24]。固定时所用酶蛋白总量与上清酶蛋白量之差为固定化酶量。取饱和固载时单位量Ni2+-NTA磁珠固定酶量为固定化容量。用终点法测定固定化MtDHFR活性;在25 ℃恒温的1.0 mL酶反应体系中,加30 μg固定化MtDHFR的磁珠,反应3 min后分离全部磁珠测定上清消光,以不加固定酶磁珠为对照计算消光之差及其变化速度 (ΔA/min)。
1.3.3 Ni2+、Fe3+及EDTA对MtDHFR活性的影响
将NiCl2、Fe2(SO4)3、EDTA用酶反应缓冲液配成5 mmol/L溶液。在1.0 mL酶反应缓冲液中,加不同终浓度的Ni2+、EDTA、Fe3+,分别与400 ngMtDHFR在冰上200 r/min作用不同时间;Ni2+与EDTA作用20 min后再加MtDHFR 400 ng冰上作用不同时间;然后恒温25 ℃加底物测定酶活性。
1.4 羧基磁珠固定MtDHFR及表征
1.4.1 活化羧基固定MtDHFR
取MSP-COOH-F1悬液 (120 g/L),用10 mmol/L MES缓冲液 (pH 6.0) 的洗3次并重悬至3 g/L。NHS和EDC分别用预冷10 mmol/L MES (pH 6.0)配成75 mmol/L、50 mmol/L溶液。取200 μL磁珠悬液 (约600 μg),磁力分离去上清后加NHS和EDC各100 μL (摩尔比1.5∶1.0)[29],或各50 μL再补充缓冲液至总体积200 μL,室温200 r/min振摇反应30 min后磁力回收磁珠,用预冷到0 ℃的固定缓冲液 (pH 7.0 的10 mmol/L MES) 洗3次并重悬至15 g/L,于0 ℃保存 (尽快使用)。在预冷到0 ℃含一定量MtDHFR的210 μL固定缓冲液中,分批加入预冷的活化羧基磁珠40 μL(600 μg);在0 ℃固定反应30 min,每隔3 min混匀一次。磁力回收磁珠,用酶反应缓冲液洗涤并重悬至3 g/L,于0 ℃保存备用。参照Ni2+-NTA磁珠固定化酶方法测定固定酶量。
1.4.2 光度法连续跟踪磁珠固定酶反应过程测定MtDHFR活性
于1.0 mL酶反应体系中,分别在含底物50 μmol/L DHF、50 μmol/L β-NADPH的反应缓冲液中加240 μg MSP-COOH-F1及1.0 μg酶,25 ℃下比较底物加磁珠前后340 nm消光值A340及其在酶作用下变化速度 (ΔA/min),以消除磁珠对测定消光变化速度的影响。测定磁珠固定化酶活性时,在25 ℃的1.0 mL酶反应体系中加75 μg固定酶磁珠,以10 s间隔连续监测3 min内340 nm处消光变化,并计算消光变化速度 (ΔA/min)及对应酶活性。
1.4.3 羧基磁珠固定化 MtDHFR 和游离MtDHFR对MTX的响应
于1.0 mL酶反应体系中,加75 μg固定酶磁珠或0.5 μg游离酶,及不同终浓度MTX (1.0–10.0 nmol/L),25 ℃混匀3 min后加底物测定酶活。用OriginPro 9.1拟合抑制率对MTX浓度对数响应确定甲氨蝶呤对MtDHFR的IC50。
1.4.4 羧基磁珠固定MtDHFR储存稳定性
将固定酶磁珠 (3.0 g/L) 于25 ℃水浴和冰水浴0 ℃中静置保存,于不同时刻取75 μg磁珠测定酶活性;分析活性随保存时间的变化。
1.5 数据处理方法
每个实验重复3次,实验结果表示为平均值 ±标准偏差 (±s);采用OriginPro 9.1进行数据处理;统计学处理采用SPSS 20.0,t检验分析,P<0.05为具有显著性差异。
2 结果与分析
2.1 MtDHFR表达和纯化
6×His-MtDHFR诱导表达后,粗酶液经Ni2+-NTA亲和层析单次纯化,蛋白收率约为12%,比活提高到15倍;超滤浓缩3次,蛋白收率约为30%,但比活提高近30%。纯化总倍数约21倍 (表1)。可见,高纯度MtDHFR易于获得。SDS-PAGE显示较纯的目的蛋白条带 (图1),分子量约为20 kDa,符合预期。
2.2 MtDHFR米氏常数及其受pH的影响
2.2.1 MtDHFR米氏常数
双倒数分析得KmDHF为 (4.4±0.2) μmol/L (n=3)(图2A),KmNADPH为 (4.7±0.5) μmol/L (n=3) (图2B),都与文献报道[27]接近。
2.2.2 pH对MtDHFR活性影响
在pH 4.0–8.0的50 mmol/L磷酸盐缓冲液中,MtDHFR活性随pH增大而降低,到pH 8.0时几乎无活性 (图3)。MtDHFR活性在pH 7.0的100 mmol/LHEPES和pH 7.0的50 mmol/L磷酸盐中无差异,故用pH 7.0的HEPES测定酶活性[25]。
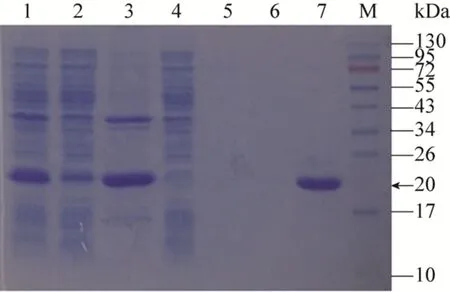
图1 SDS-PAGE检测6×His-MtDHFR的纯化Fig.1 SDS-PAGE analysis of 6×His-MtDHFR after purification by Ni2+-NTA.Lane 1: lysate; lane 2:supernatant; lane 3: sediment; lane 4: flow through fractions;lane 5: fractions eluted with 10 mmol/L imidazole; lane 6:fractions eluted with 20 mmol/L imidazole; lane 7: fractions of target eluted with 500 mmol/L imidazole; M: marker.
表1 MtDHFR表达纯化效果 (±s, n=3)Table 1 Expression and purification of MtDHFR (±s, n=3)
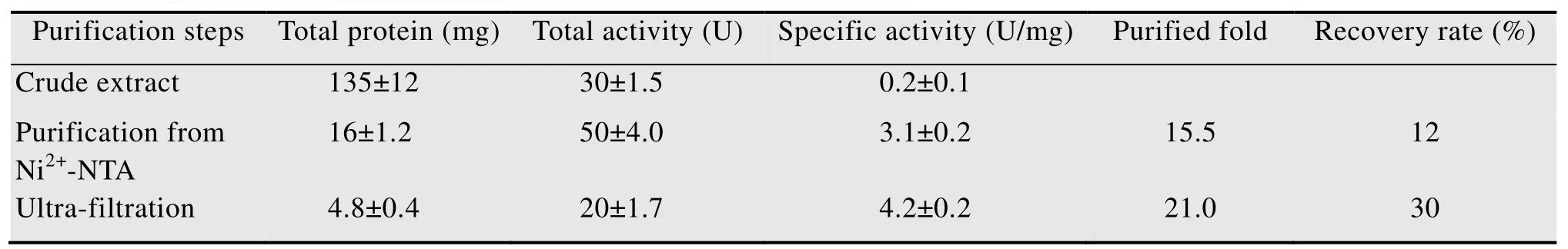
表1 MtDHFR表达纯化效果 (±s, n=3)Table 1 Expression and purification of MtDHFR (±s, n=3)
Purification steps Total protein (mg)Total activity (U)Specific activity (U/mg)Purified fold Recovery rate (%)Crude extract 135±12 30±1.5 0.2±0.1 Purification from Ni2+-NTA 16±1.2 50±4.0 3.1±0.2 15.5 12 Ultra-filtration 4.8±0.4 20±1.7 4.2±0.2 21.0 30

图2 DHF (A) 和β-NADPH (B) 的表观KmFig.2 Km of DHF (A) and β-NADPH (B).
2.3 Ni2+-NTA磁珠固定MtDHFR及其表征
2.3.1 Ni2+-NTA磁珠固定MtDHFR容量及保留活性
用75 μg Ni2+-NTA磁珠,随MtDHFR用量增加,固定化酶量逐渐增加直至饱和 (图4),固定化容量为 (93±12) mg/g磁珠 (n=3)。固定化酶比活随MtDHFR用量增加而缓慢增加至稳定,但最大比活保留仅约为游离酶的32%。
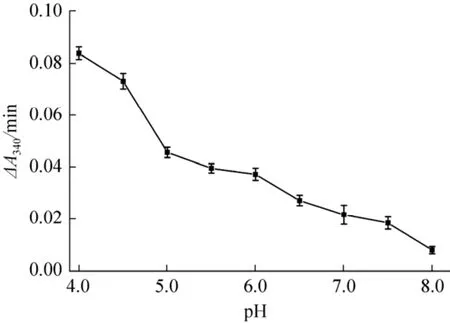
图3 MtDHFR活性的pH效应Fig.3 pH effect on MtDHFR activity.
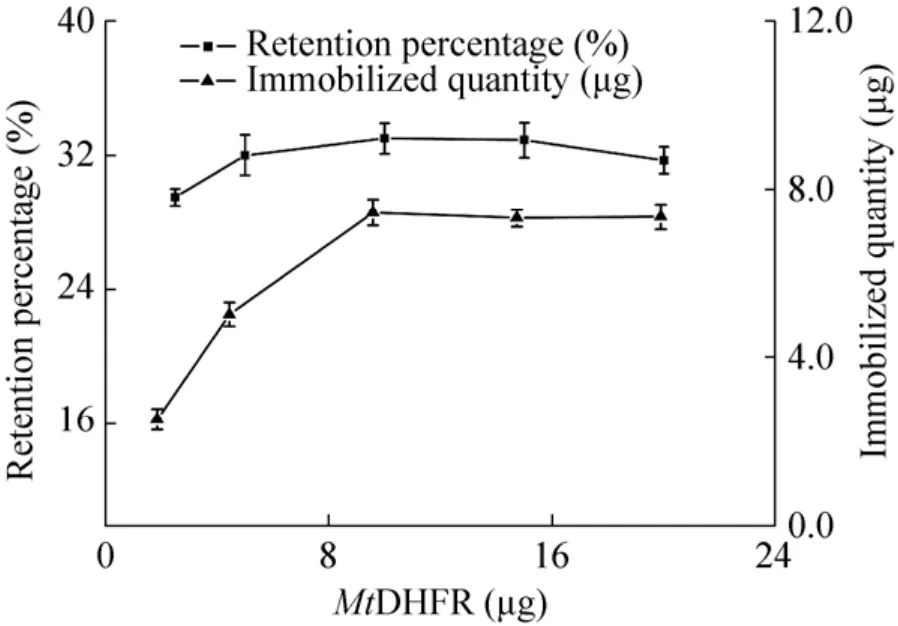
图4 75 μg Ni2+-NTA磁珠基于6×His固定MtDHFR的固定化量和表观比活保留比Fig.4 Immobilization capacity and residual activity percentage of 6×His-MtDHFR on Ni2+-NTA MSPs of 75 μg.
2.3.2 Ni2+、Fe3+及EDTA对酶活的影响
Ni2+在5–20 nmol/L之间对MtDHFR活性产生浓度和时间依赖性抑制,20 nmol/L Ni2+抑制大于50% (图5A)。Fe3+对MtDHFR活性没有明显影响 (图5B)。单独EDTA对MtDHFR活性可抑制大于30%且依赖其浓度;Ni2+与MtDHFR作用前后加EDTA对MtDHFR活性抑制大于60%,有协同抑制效应 (图5C)。Ni2+-NTA磁珠中含游离Ni2+,其可能降低固定酶活力且EDTA不能逆转。
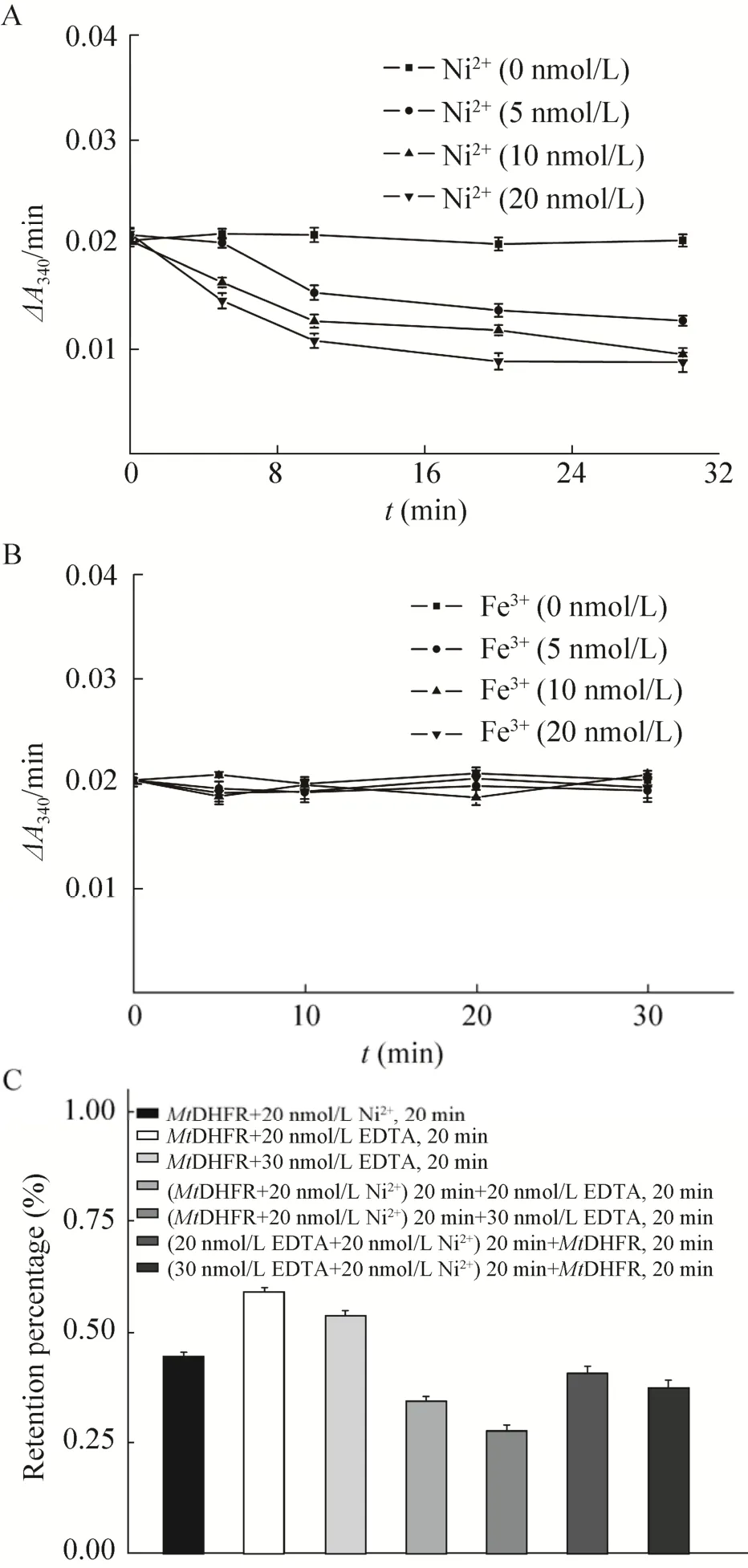
图5 Ni2+(A)、Fe3+(B)、EDTA (C) 对酶活性的影响Fig.5 Effects of Ni2+, Fe3+and EDTA on MtDHFR activity.(A) Ni2+.(B) Fe3+.(C) EDTA alone and it plus Ni2+ in 100 mmol/L HEPES buffer at pH 7.0.
2.4 羧基磁珠固定MtDHFR及其表征
2.4.1 羧基磁珠对酶活测定的干扰
常规方法测定磁珠固定化酶活,需在固定化酶初速度反应阶段终止反应并分离磁珠,再测定反应液的吸收变化计算固定化酶活。由于反应终点的确定易产生误差并干扰反应液吸收的测定,使固定化酶活测定重现性较低,故需考察不分离磁珠连续监测反应测定酶活的可行性。所用磁珠悬浮稳定性好,其在有限时段内对340 nm消光变化速度影响应该很小。在1.0 mL酶反应体系中,150 mg/L羧基磁珠、50 μmol/L β-NADPH和50 μmol/L DHF及其混合物,在340 nm的消光A340构成恒定本底;在游离酶存在时,外加终浓度75、150、240 mg/L羧基磁珠,对光度法跟踪酶反应过程测定游离酶活性无影响。因此,磁珠对固定酶活测定无显著干扰。本实验限制固定酶磁珠用量,用光度法连续跟踪测定固定化酶活性。
2.4.2 羧基磁珠固定MtDHFR容量及保留活性
活化羧基磁珠约600 μg,MtDHFR用量在5–200 μg之间,固定化容量基本不变 (图6);最大固定化蛋白量约5.2 μg,对应固定化容量为(8.6±0.6) mg/g磁珠 (n=3)。不分离磁珠,连续跟踪固定化酶反应过程并测定固定化酶活性,所得固定化酶表观比活保留比例变化如图6所示。在约600 μg活化羧基磁珠中,加入MtDHFR量从5–200 μg进行固定时,磁珠固定化酶的表观比活保留比例先增加后逐渐降低至稳定,在酶用量10 μg时其表观比活保留87%,而酶用量20–200 μg时磁珠固定化酶表观比活保留比例稳定在75%。为保留固定酶活性,选择酶量∶磁珠量比为1∶60。

图6 羧基磁珠固定酶活保留比例及固定化量对加入酶量的响应Fig.6 Immobilized quantity and retention percentages of apparent specific activities in response to amounts of enzyme added for immobilization on MSP-COOH-F1.
2.4.3 游离和羧基磁珠固定MtDHFR的储存稳定性
游离和羧基磁珠固定化MtDHFR在反应缓冲液0 ℃保存16 h活性均无显著改变 (图7);游离MtDHFR在25 ℃下反应缓冲液中保存2 h后活性持续降低,4 h下降超过10%,16 h降低近60%;固定化酶25 ℃保存4 h活力仅下降4%,16 h下降仅35%。在混合物库筛选中,从配体竞争结合固定化酶到磁分离洗涤的全流程,操作时间不超过4 h,故此固定化MtDHFR稳定性满足混合物筛选要求。
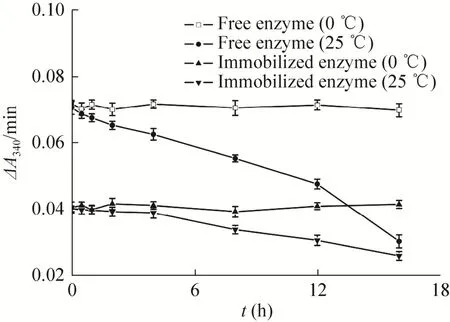
图7 游离酶和羧基磁珠固定MtDHFR的稳定性Fig.7 Stability of the free and MSP-COOH-F1 immobilized MtDHFR.
2.4.4 MtDHFR羧基磁珠固定前后对MTX的IC50
MtDHFR在羧基磁珠上固定前后对MTX的IC50无显著差异 (P>0.05) (图8),且都与文献报道结果接近[25,27]。可见,用MSP-COOH-F1固定化MtDHFR适合筛选其高亲和力抑制剂。
3 讨论
本研究构建N端带6×His标签的MtDHFR表达载体pET28a,在E.coliBL21 (DE3) 中成功重组表达并纯化。比较发现,不同磁珠固定化重组MtDHFR有显著差异。6×His-MtDHFR通过其6×His标签与Ni2+-NTA磁珠螯合,属于位点选择性固定化,但不适合用于磁分离筛选MtDHFR的高亲和力配体。首先,Ni2+-NTA磁珠固定化酶保留活性很低。其次,Ni2+-NTA鳌合带6×His标签酶复合物稳定性对pH敏感,在pH 8.0及以上鳌合酶才能维持固定化状态。但是,6×His-MtDHFR在pH 8.0时保留的活性很低而不适合筛选其抑制剂。相反,MtDHFR氨基酸序列仅有1个赖氨酸(Lys-53) 及N端伯氨基,三维结构 (PDB code:4KNE) 中,此赖氨酸及其N端伯氨基都远离活性位点[23],可通过伯氨基与磁珠表面羧基生成酰胺固定化;这种固定化实际上也属于位点选择性固定化。MSP-COOH-F1表面为兼性离子对修饰层并带长连接臂的羧基适合固定蛋白,而磁珠对疏水小分子的非特异吸附弱。优化条件后,此羧基磁珠固定MtDHFR达到 (8.6±0.6) mg/g磁珠,特别是固定化酶保留 (87±4)%活性,固定前后其对MTX的IC50无显著差异,而固定化酶在4 h内稳定。所以,用此羧基磁珠固定化MtDHFR有望用于配体混合物库中高亲和力配体的选择性富集与筛选。
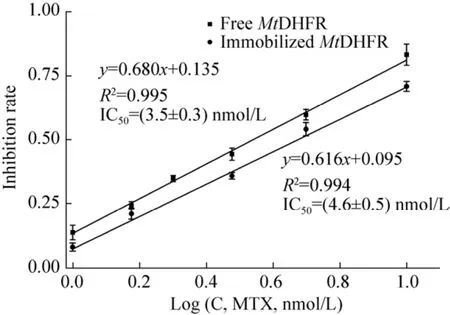
图8 MTX对游离酶和羧基磁珠固定MtDHFR的IC50Fig.8 IC50 of MTX against free and MSP-COOH-F1 immobilized MtDHFR.
用MSP-COOH-F1羧基磁珠固定化MtDHFR时,磁珠表面羧基活化程度不宜太高,对设定量磁珠存在最优酶蛋白用量。可能磁珠固定蛋白量少而使位阻小,有利于固定化酶结合底物。对MSPCOOH-F1,酶蛋白量对磁珠量比例接近1∶60,有利于获得高保留活性固定化酶。MSP-COOH-F1羧基固定化MtDHFR后悬浮稳定性好,光度法连续监测反应混合物消光 (考虑磁珠对光的散射故称为消光) 适合测定酶活性。
总体而言,6×His-MtDHFR适合在大肠杆菌大量表达,通过成酰胺键固定在MSP-COOH-F1上适用于磁分离筛选其抑制剂混合物库。后续工作正在进行中。

