齐墩果酸1脱氧野尻霉素衍生物的合成及其对α葡萄糖苷酶活性的抑制
, ,,,*, ,,,
(1.江西农业大学食品科学与工程学院,江西省天然产物与功能食品重点实验室,江西南昌 330045;2.江西特色林木资源培育与利用2011协同创新中心,江西南昌 330045;3.江西农业大学理学院,江西南昌 330045)
α-葡萄糖苷酶是一类糖类外切酶,位于小肠的刷状边缘上,在体内碳水化合物的消化和吸收中起着重要作用[1],是影响餐后血糖的关键酶,而α-葡萄糖苷酶抑制剂可以延缓肠道碳水化合物吸收而控制餐后血糖升高,因此,α-葡萄糖苷酶抑制剂被广泛地应用于Ⅱ型糖尿病的防治[2-3]。目前临床上常用的α-葡萄糖苷酶抑制剂有阿卡波糖、伏格列波糖、米格列醇等。这些抑制剂能较好地控制餐后血糖升高,但长期服用会引起腹泻、腹胀等副作用,因而限制了其使用[4],开发新型的α-葡萄糖苷酶抑制剂具有重要的研究意义和应用价值。
齐墩果酸(OA)是一种五环三萜类化合物,广泛存在于人参、甘草、三七等植物中,具有多种生物活性,如抗HIV[5]、抗癌[6-7]、抗菌[8]、降血糖[9-10]、抗炎[11]等。赵昱等[12]的研究表明,天然的和经过结构修饰的五环三萜类化合物有一定的抑制α-葡萄糖苷酶活性的作用。天然产物结构修饰是发掘新型α-葡萄糖苷酶抑制剂的重要途径,OA是一个很好的先导化合物,其能抑制小肠上皮的α-葡萄糖苷酶,但由于其水溶性差影响了作用效果[13],对其进行结构修饰有望获得活性更好的α-葡萄糖苷酶抑制剂。目前,针对OA抑制α-葡萄糖苷酶活性的结构修饰主要是对C-28、C-3和双键进行的,其中对C-28位的修饰主要形成是酯键和酰胺键[14],Nie等[15]在C-3和C-28位同时引入肉桂酰胺衍生物,得到了数个活性较强的衍生物,但在C-28位引入哌嗪进行修饰,活性却降低了;李文良等[16]在氨基酸和齐墩果酸之间引入一定长度的碳链,活性测试表明,当氨基酸连接较多亲水基团时,抑制α-葡萄糖苷酶的活性有明显提高。
陈玉华等[17]的研究结果表明,1-DNJ对α-葡萄糖苷酶具有很好的抑制作用,其水溶性高,但结构上与葡萄糖非常相似,在体内吸收速度快,很快地被代谢,因此体内抑制餐后血糖升高的效果一般[18]。为提高OA对α-葡萄糖苷酶的抑制效果,本文在其分子结构中引进了另一个活性基团——1-DNJ。针对OA和1-DNJ的特点,基于拼接原理,通过2~6个碳长的连接桥,在OA的C-28上引入了1-DNJ活性基团,合成了OA系列衍生物(OADs),研究了不同长度的碳链连接桥对其抑制活性的影响,并据此探讨了此类化合物结构与α-葡萄糖苷酶之间的构效关系,以期为新型α-葡萄糖苷酶抑制剂的研发提供思路和方法。
1 材料和方法
1.1 材料与仪器
α-葡萄糖苷酶(α-Glucosidase,EC3.2.1.20)、4-硝苯-α-D-吡喃葡萄糖苷(4-Nortiphenyl-α-D-gluocpynoaside,PNPG)、对硝基苯酚(4-Nitrophenol) Sigma公司;阿卡波糖(Acarbose) 索莱宝公司;1,2-二溴乙烷、1,3-二溴丙烷、1,4-二溴丁烷、1,5-二溴戊烷、1,6-二溴己烷 天津希恩斯奥普德科技有限公司;N,N-二甲基甲酰胺(DMF) 西陇化工股份有限公司;其它药品和试剂 均为分析纯或化学纯,所有分离用有机溶剂均为国产分析纯。
YM-10型Microcon超滤管 美国Millipore公司;Varian VNMR 500 MHz核磁共振仪 布鲁克科技有限公司(TMS为内标,氘代DMSO为溶剂);Finnigan Trace Ms质谱仪 日本岛津公司;Electrothermal数字熔点仪 北京泰克仪器有限公司;SpectraMax M2型酶标仪 美国Thermo Fisher Scientific。
1.2 实验方法
1.2.1 OADs的合成 合成路线图如图1所示。
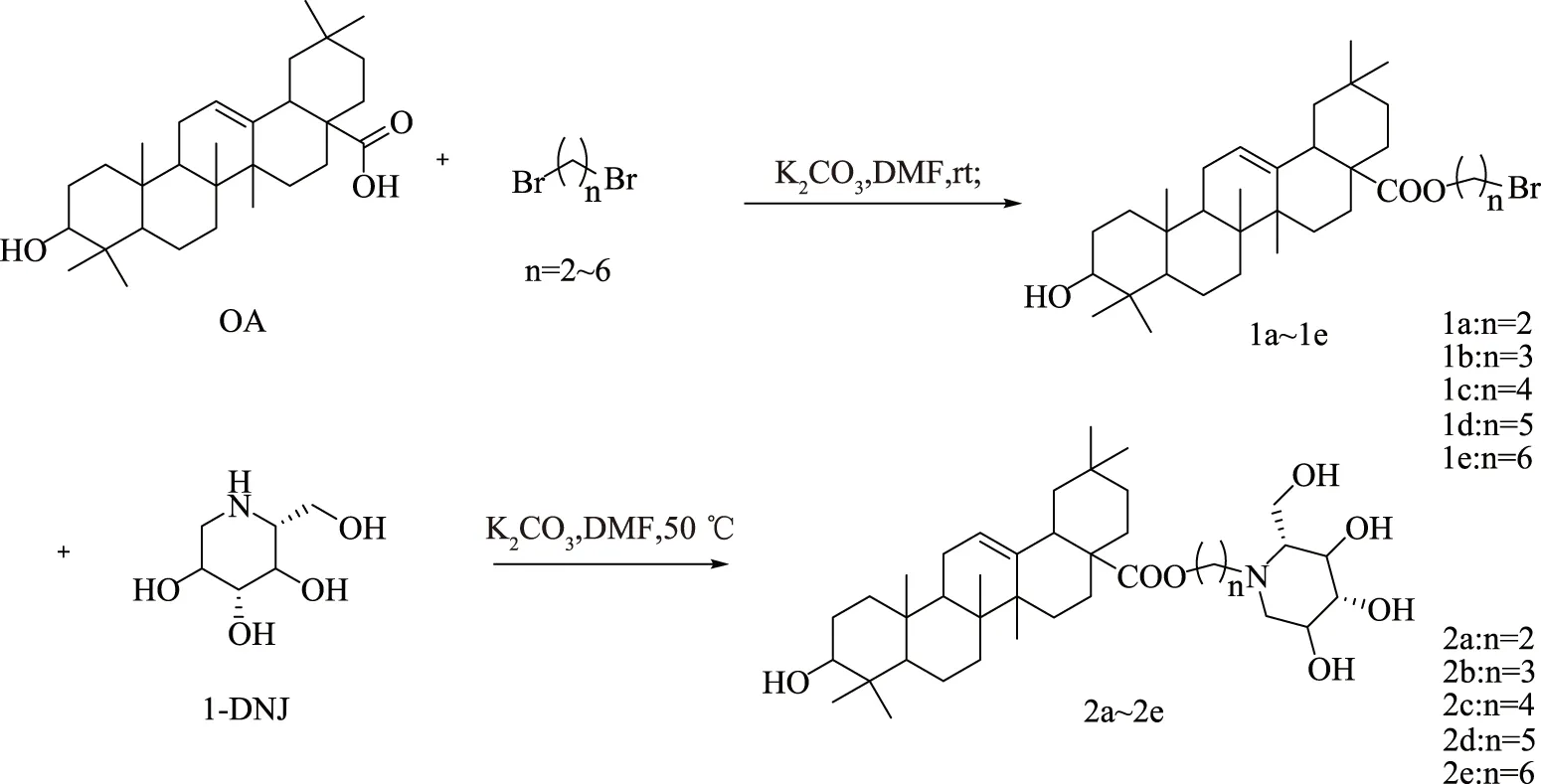
图1 齐墩果酸衍生物的合成路线Fig.1 Synthesis procedure of OADs
1.2.1.1 OADs中间产物1a~1e的合成 1a利用Cheng等[19]和Liu等[20]的方法合成,在100 mL的圆底烧瓶中加入2.28 g(5 mmol)齐墩果酸、1.38 g(10 mmol)碳酸钾和50 mL N,N-二甲基甲酰胺(DMF),在室温下搅拌30 min,再加入1.87 g(10 mmol)1,2-二溴乙烷,反应液在室温下搅拌12 h,反应结束后,将反应液倒入水中,用乙酸乙酯(3×20 mL)萃取,合并有机相,无水硫酸钠干燥,脱溶拌样,硅胶柱层析分离(洗脱剂为石油醚/乙酸乙酯=20∶1)得到化合物1a。
在化合物1b~1e的合成中,将1,2-二溴乙烷分别换成 1,3-二溴丙烷、1,4-二溴丁烷、1,5-二溴戊烷、1,6-二溴己烷,其他步骤与1a相同。
1.2.1.2 OADs目标化合物2a~2e的合成 在100 mL的圆底烧瓶中加入2.82 g(5 mmol)中间体1a、1.38 g(10 mmol)碳酸钾、0.978 g(6 mmol)1-DNJ和50 mL N,N-二甲基甲酰胺,反应液在50 ℃条件下搅拌12 h,反应结束后,将反应液倒入水中,用二氯甲烷(3×20 mL)萃取,合并有机相,无水硫酸钠干燥,脱溶拌样,硅胶柱层析分离(洗脱剂二氯甲烷/甲醇=20∶1)得到化合物2a。
在化合物2b~2e的合成中,将中间体1a分别换成1b、1c、1d、1e,其他步骤与2a相同。
1.2.2 OADs的结构表征 所合成的所有中间化合物及目标化合物均通过1H NMR、13C NMR和HRMS波普技术进行结构鉴定与表征,其中HRMS以甲醇为溶剂,1H NMR、13C NMR以TMS为内标,氘代DMSO为溶剂。
1.2.3 目标化合物体外对α-葡萄糖苷酶抑制活性及抑制动力学检测方法
1.2.3.1 PNP标准测定曲线的制作 以磷酸缓冲液(PB)(pH6.8)配制一定浓度的对硝基苯酚(PNP)标准溶液,取不同体积加入到96孔板中,随后每孔加入β-巯基乙醇溶液(1.5 μL,1.4 mol/L),再用PB补足至200 μL,得0、0.15、0.03、0.06、0.15、0.3、0.6、1.5、0.8、3、6、12、24、48、96(×10-6mmol)系列标准浓度,每一浓度设置3个平行,于λ=405 nm下测定吸光度值[21]。以OD值Aλ=405 nm为横坐标,PNP物质的量n(×10-6mmol)为纵坐标,绘制测定标准曲线,线性方程为:y=77.218x,决定系数为:R2=0.9998。
1.2.3.2 目标化合物对α-葡萄糖苷酶体外抑制活性检测 采用微量α-葡萄糖苷酶-PNPG反应体系检测模型[21],对系列目标化合物进行活性筛选,以OA和阿卡波糖为对照。具体操作如下:依次往各反应孔中加入PB(158.5 μL,0.1 mmol/L,pH6.8)、β-巯基乙醇溶液(1.5 μL,1.4 mol/L)、α-葡萄糖苷酶(10 μL,1 U/mL),所需测定活性的样品10 μL,混匀后置于37 ℃水浴中孵育20 min,随后加入PNPG(20 μL,10 mmol/L),37 ℃水浴加热5 min,在405 nm波长下测定吸光度值,每个样品浓度重复3次。待测样品浓度设置0.75、0.5、0.25、0.1、0.05 mmol/L 5个水平,同时设置空白组(不添加抑制剂,用PB替代)。
1.2.3.3 目标化合物对α-葡萄糖苷酶的抑制动力学测定 采用微量α-葡萄糖苷酶-PNPG检测模型进行测定,将底物浓度设置为0.1、0.2、0.8、1、1.2、1.6、1.8、2、2.5、5 mmol/L,反应时间为5 min,抑制剂浓度为0.25 mmol/L,测定α-葡萄糖苷酶的反应速度(每分钟生成PNP的量)。采用Origin 8.4软件,以S(底物浓度)为自变量、V(反应速度)为因变量进行非线性拟合,计算表观Vmax和表观Km。
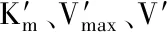
1.2.4 分子对接方法 在PDB数据库中,搜索来源于酵母的α-葡萄糖苷酶(PDB ID:2f6d),以Sybyl 2.0软件来生成2b和阿卡波糖的初始结构,并运用tripos力场和Gasteiger-marsili电荷优化分子的几何结构。以AutoDock 4.2软件对模建的α-葡萄糖苷酶与2b和阿卡波糖进行分子对接。
根据ΔG=ΔH-TΔS公式进行计算,其中ΔG表示结合自由能,用来评估配体-受体间的结合强度[22];ΔS表示在形成复合物过程中体系的熵变;ΔH表示配体-受体间的相互作用能,包括氢键作用、静电作用、范德华力。
2 结果与分析
2.1 OADs中间产物与目标产物的合成及表征
本文尝试以K2CO3为碱,DMF为溶剂,通过溴取代反应拟在C-3号位引入不同长度碳链合成目标物,但经1H NMR分析,发现C-3位的羟基还在,后又对反应的碱和溶剂两个重要条件进行了改变,分别选择了Na、NaH、Cs2CO3,和DMF、THF、丙酮、1,4-二氧六环四种溶剂进行反应,经1H NMR分析,均未能在C-3位羟基引入不同长度的碳链,却发现在C-28位羧基引入了碳链,可能是由于C-28位的羧基比C-3位的羟基更活泼,随后,用苄基对羧基进行保护,以K2CO3为碱,DMF为溶剂,还是未能在C-3引入碳链,最后,选择K2CO3为碱,DMF为溶剂,在C-28位引入碳链。在中间体1a~1e合成目标产物的过程中,开始最初以80 ℃的条件进行反应,发现无新产物生成,后尝试室温下反应,也未发现有新产物生成,最后以50 ℃为反应温度,得到目标产物,推测,可能是在碱性条件下,温度过低使得原料不反应,温度过高导致酯键水解断裂。
分别采用1H NMR、13C NMR 和HRMS对5个OADs中间体和5个OADs目标化合物进行表征,目标化合物结构如图2,经高分辨质谱数据分析,所有化合物的分子量均能匹配到,以化合物2a为例,在正离子模式下,所测相对分子量与计算值相差1,可以确定分子式正确,与齐墩果酸的氢谱数据相比较[23],δ4.3左右的羟基峰、δ5.20处峰对应的双键、1.09(3H,s,CH3-23),0.90(3H,s,H-27),0.88(6H,s,H-30,H-26),0.85(3H,s,H-29),0.68(3H,s,H-24),0.66(3H,s,H-25)处峰对应的7个甲基峰均未消失,而δ 11.94左右的羧基峰消失,且δ 3.96(2H,s)、δ 2.85-2.73(2H,m)多出两个-CH2-峰,说明,碳链连接到了羧基上,在δ 4.75(2H,br s)处多了一个宽峰,说明有活泼氢原子出现,可能是1-DNJ上的活泼氢,证实化合物结构正确,结果如下。
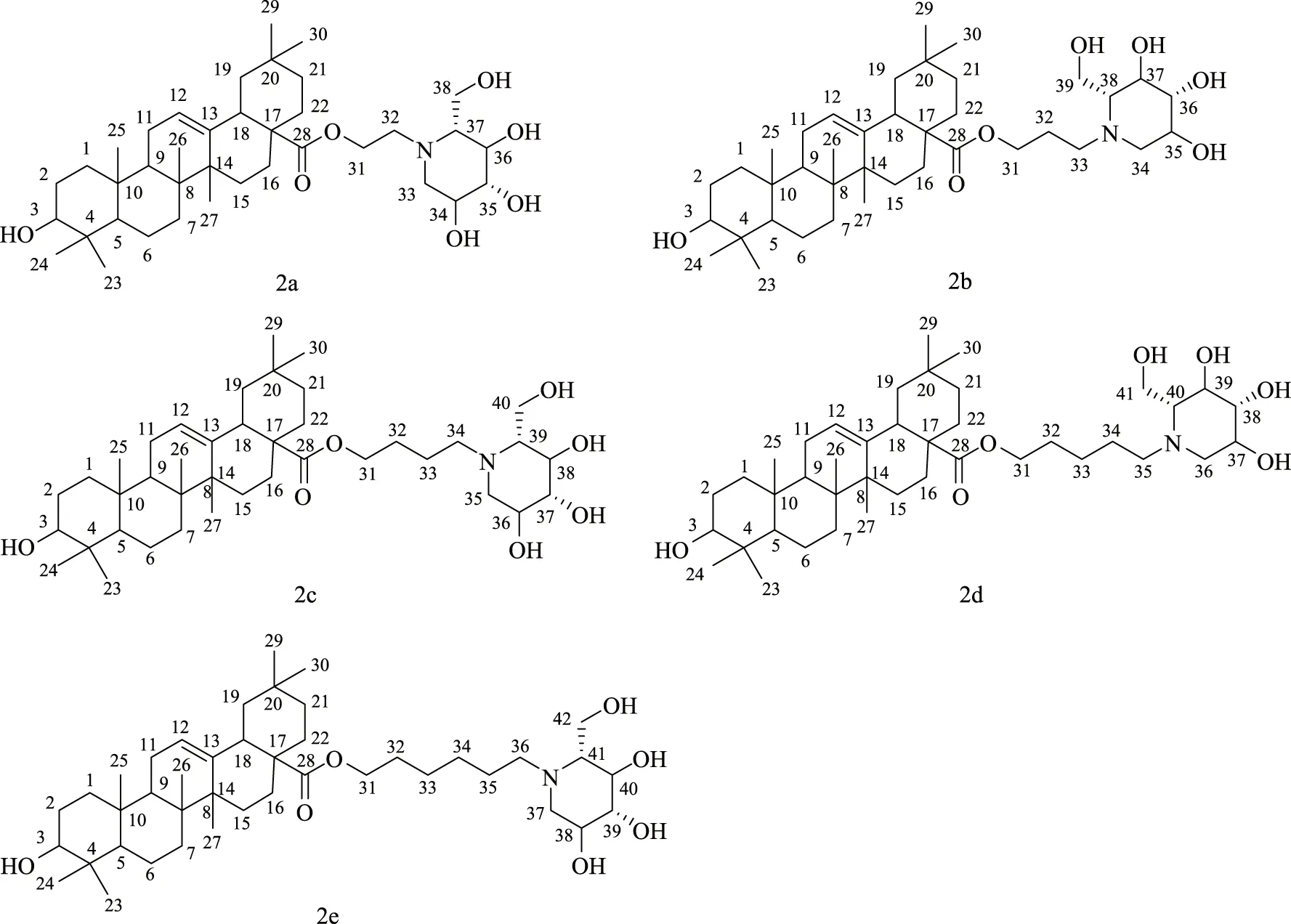
图2 OADs目标化合物结构图Fig.2 The structures of target OADs
1a:白色固体,得率为90%,熔点为161~163 ℃。HRMS(ESI)m/z:563.3090[M+H]+;1H NMR(500 MHz,DMSO)δ 5.20(1H,s,H-12),4.75(2H,br s,H-34,H-36),4.65(1H,s,H-38),4.29(1H,s,-OH),4.10(1H,s,H-35)3.81(2H,d,J=9.5 Hz,H-31),2.77(2H,d,J=10.3 Hz,H-32),1.09(3H,s,CH3-23),0.90(3H,s,H-27),0.88(6H,s,H-30,H-26),0.85(3H,s,H-29),0.68(3H,s,H-24),0.66(3H,s,H-25);13C NMR(125 MHz,DMSO)δ 176.75(C-28),143.63(C-13),122.57(C-12),77.28(C-3),64.19(C-31),55.26(C-5),47.52(C-9),46.65(C-17),45.81(C-19),41.70(C-14),41.34(C-18),39.40(C-8),38.85(C-1),38.57(C-4),37.03(C-10),33.64(C-21),33.21(C-29),32.84(C-7),32.52(C-22),30.84(C-20),28.69(C-23),27.76(C-15),27.64(C-32),27.43(C-2),26.07(C-27),23.81(C-30),23.41(C-16),22.96(C-11),18.47(C-6),17.18(C-26),16.49(C-25),15.57(C-24)。
1b:白色固体,得率为88%,熔点为146~148 ℃。HRMS(ESI)m/z:577.3235[M+H]+;1H NMR(500 MHz,DMSO)δ 5.20(1H,t,J=3.3 Hz,H-12),4.28(1H,s,-OH),4.13-3.95(2H,m,H-31),3.62-3.46(2H,m,H-33),3.00(1H,dd,J=10.0,5.6 Hz,H-3),1.10(3H,s,CH3-23),0.90(3H,s,CH3-27),0.89(6H,s,CH3-30,CH3-26),0.85(3H,s,CH3-29),0.68(3H,s,CH3-24),0.68(3H,s,CH3-25).13C NMR(125 MHz,DMSO)δ 176.90(C-28),143.90(C-13),122.43(C-12),77.27(C-3),62.10(C-31),55.25(C-5),47.53(C-9),46.61(C-17),45.80(C-19),41.74(C-14),41.46(C-18),39.35(C-8),38.85(C-1),38.56(C-4),37.03(C-10),33.63(C-21),33.22(C-29),32.84(C-7),32.51(C-22),31.70(C-33),30.84(C-20),28.69(C-23),27.76(C-15),27.57(C-32),27.43(C-2),26.08(C-27),23.82(C-30),23.45(C-16),23.02(C-11),18.47(C-6),17.29(C-26),16.48(C-25),15.56(C-24)。
1c:白色固体,得率为85%,熔点为132~134 ℃。HRMS(ESI)m/z:591.3393[M+H]+;1H NMR(500 MHz,DMSO)δ 5.20(1H,t,J=3.3 Hz,H-12),4.28(1H,s,-OH),3.98(2H,t,J=6.2 Hz,H-31),3.54(2H,t,J=6.8 Hz,H-34),3.00(1H,dd,J=9.4,5.5 Hz,H-3),1.10(3H,s,CH3-23),0.90(3H,s,CH3-27),0.89(6H,s,CH3-30,CH3-26),0.86(3H. s,CH3-29),0.68(3H,s,CH3-24),0.67(3H,s,CH3-25).13C NMR(125 MHz,DMSO)δ 176.99(C-28),143.91(C-13),122.42(C-12),77.28(C-3),63.45(C-31),55.25(C-5),47.53(C-9),46.53(C-17),45.88(C-19),41.72(C-14),41.39(C-18),39.37(C-8),38.85(C-1),38.55(C-4),37.05(C-10),34.88(C-34),33.65(C-21),33.22(C-29),32.84(C-7),32.58(C-22),30.84(C-20),29.72(C-33),28.69(C-23),27.77(C-15),27.56(C-32),27.39(C-2),26.09(C-27),23.82(C-30),23.40(C-16),23.04(C-11),18.46(C-6),17.23(C-26),16.49(C-25),15.55(C-24)。
1d:白色固体,得率为83%,熔点为123~125 ℃。HRMS(ESI)m/z:605.3549[M+H]+;1H NMR(500 MHz,DMSO)δ 5.20(1H,s,H-12),4.29(1H,s,-OH),4.06-3.86(2H,m,H-31),3.53(2H,t,J=6.6 Hz,H-33),3.09-2.93(1H,m,H-3),1.10(3H,s,CH3-23),0.90(3H,s,CH3-27),0.89(6H,s,CH3-30,CH3-26),0.85(3H,s,CH3-29),0.68(3H,s,CH3-24),0.67(3H,s,CH3-25).13C NMR(125 MHz,DMSO)δ 177.06(C-28),143.93(C-13),122.38(C-12),77.28(C-3),63.95(C-31),55.25(C-5),47.52(C-9),46.53(C-17),45.89(C-19),41.72(C-14),41.38(C-18),39.37(C-8),38.85(C-1),38.54(C-4),37.04(C-10),35.46(C-34),33.66(C-21),33.22(C-29),32.84(C-7),32.59(C-22),32.20(C-35),30.85(C-20),28.69(C-23),27.70(C-15),27.57(C-32),27.42(C-2),26.08(C-27),24.74(C-33),23.83(C-30),23.42(C-16),23.03(C-11),18.46(C-6),17.19(C-26),16.49(C-25),15.55(C-24)。
1e:白色固体,得率为80%,熔点为118~119 ℃。HRMS(ESI)m/z:619.3707[M+H]+;1H NMR(500 MHz,DMSO)δ 5.29(1H,s,H-12),4.03(2H,t,J=6.3 Hz,H-31),3.42(2H,t,J=6.8 Hz,H-36),3.22(1H,d,J=9.6 Hz,-OH),2.93-2.81(1H,m,H-3),1.15(3H,s,CH3-23),1.00(3H,s,CH3-27),0.94(3H,s,CH3-29),0.91(6H,s,CH3-30,CH3-26),0.79(3H,s,CH3-24),0.75(3H,s,CH3-25).13C NMR(125 MHz,DMSO)δ 177.07(C-28),143.97(C-13),122.33(C-12),77.27(C-3),64.02(C-31),55.24(C-5),47.50(C-9),46.52(C-17),45.89(C-19),41.73(C-14),41.40(C-18),39.36(C-8),38.85(C-1),38.53(C-4),37.04(C-10),35.40(C-35),33.65(C-21),33.21(C-29),32.85(C-7),32.67(C-22),30.85(C-20),28.70(C-23),28.40(C-32),27.75(C-15),27.56(C-34),27.42(C-2),26.06(C-27),25.17(C-33),23.81(C-30),23.41(C-16),23.03(C-11),18.45(C-6),17.23(C-26),16.50(C-25),15.54(C-24)。
2a:白色固体,得率为67%,熔点为215~217 ℃。HRMS(ESI)m/z:646.4602[M+H]+;1H NMR(500 MHz,DMSO)δ 5.20(1H,s,H-12),4.75(2H,s,H-34,H-36),4.65(1H,s,H-38),4.31(1H,d,J=5.0 Hz,-OH),4.09(1H,s,H-35),3.96(2H,s,H-31),3.59(1H,s,H-3),2.78(2H dd,J=21.1,11.0 Hz,H-32),1.10(3H,s,CH3-23),0.90(3H,s,H-27),0.89(6H,s,H-30,H-26),0.85(3H,s,H-29),0.68(3H,s,H-24),0.66(3H,s,H-25).13C NMR(125 MHz,DMSO)δ 177.15(C-28),143.83(C-13),122.48(C-12),79.62(C-35),77.29(C-3),71.18(C-37),69.83(C-34),66.84(C-36),61.87(C-31),59.92(C-33),58.12(C-38),55.26(C-5),50.64(C-32),47.55(C-9),46.39(C-17),45.94(C-19),41.64(C-14),41.24(C-18),39.36(C-8),38.85(C-1),38.52(C-4),37.05(C-10),33.65(C-21),33.26(C-29),32.75(C-7),32.46(C-22),30.85(C-20),28.70(C-23),27.61(C-15),27.41(C-2),26.16(C-27),23.88(C-30),23.37(C-16),23.01(C-11),18.47(C-6),17.15(C-26),16.51(C-25),15.57(C-24)。
2b:白色固体,得率为78%,熔点为204~207 ℃。HRMS(ESI)m/z:660.4758[M+H]+;1H NMR(500 MHz,DMSO)δ 5.21(1H,s,H-12),4.71(2H,br s,H-35,H-37),4.68(1H,s,H-39),4.30(1H,d,J=5.1 Hz,-OH),4.11(1H,s,H-36)3.81(2H,d,J=9.5 Hz,H-31),3.25(1H,s,H-3),2.77(2H,d,J=10.3 Hz,H-33),1.09(3H,s,CH3-23),0.90(3H,s,H-27),0.88(6H,s,H-30,H-26),0.85(3H,s,H-29),0.68(3H,s,H-24),0.66(3H,s,H-25).13C NMR(125 MHz,DMSO)δ 177.03(C-28),143.92(C-13),122.34(C-12),77.28(C-3),76.5(C-36),76.43(C-38),70.71(C-35),70.69(C-37),63.82(C-31),59.58(C-39),58.36(C-34),55.25(C-5),51.56(C-33),47.53(C-9),46.50(C-17),45.89(C-19),41.72(C-14),41.37(C-18),39.35(C-8),38.85(C-1),38.54(C-4),37.04(C-10),33.68(C-21),33.25(C-29),32.81(C-7),32.50(C-22),30.85(C-20),28.70(C-23),27.61(C-15),27.56(C-32)27.42(C-2),26.07(C-27),23.83(C-30),23.40(C-16),23.05(C-11),18.46(C-6),17.19(C-26),16.51(C-25),15.58(C-24)。
2c:白色固体,得率70%,熔点为116~117 ℃。HRMS(ESI)m/z:674.4913[M+H]+;1H NMR(500 MHz,DMSO)δ 5.18(1H,d,J=3.5 Hz,H-12),4.77(2H,br s,H-36,H-38),4.63(1H,s,H-40),4.32(1H,s,-OH),4.10(1H,s,H-37),4.03-3.86(2H,m,H-31),3.72(1H,d,J=11.1 Hz,H-3),3.07(2H,dd,J=17.9,10.8 Hz,H-34),1.10(3H,s,CH3-23),0.90(3H,s,CH3-27),0.88(6H,s,CH3-30,CH3-26),0.85(3H,s,CH3-29),0.68(3H,s,CH3-24),0.66(3H,s,CH3-25);13C NMR(125 MHz,DMSO)δ 177.07(C-28),143.92(C-13),122.37(C-12),77.53(C-39),77.29(C-3),73.71(C-38),70.02(C-36),69.20(C-37),64.13(C-31),63.18(C-40),58.09(C-35),55.25(C-5),52.09(C-34),47.53(C-9),46.50(C-17),45.89(C-19),41.72(C-14),41.38(C-18),39.36(C-8),38.85(C-1),38.53(C-4),37.03(C-10),33.66(C-21),33.22(C-29),32.84(C-7),32.59(C-22),30.85(C-20),28.70(C-23),28.56(C-15),27.57(C-32),27.43(C-2),26.62(C-33),26.07(C-27),23.81(C-30),23.40(C-16),23.04(C-11),18.44(C-6),17.20(C-26),16.51(C-25),15.58(C-24)。
2d:白色固体,得率75%,熔点为75~76 ℃。HRMS(ESI)m/z:688.5069[M+H]+;1H NMR(500 MHz,DMSO)δ 5.19(1H,s,H-12),4.71(2H,br s,H-37,H-39),4.65(1H,s,H-41),4.30(1H,d,J=4.7 Hz,-OH),4.13(1H,s,H-38),3.94(2H,dd,J=12.1,5.9 Hz,H-31),3.20(1H,s,H-3),3.04-2.98(2H,m,H-35),1.10(3H,s,CH3-23),0.90(3H,s,CH3-27),0.89(6H,s,CH3-30,CH3-26),0.85(3H,s,CH3-29),0.68(3H,s,CH3-24),0.67(3H,s,CH3-25);13C NMR(125 MHz,DMSO)δ 177.06(C-28),143.90(C-13),122.38(C-12),79.67(C-40),77.29(C-3),71.22(C-39),69.86(C-37),67.26(C-38),64.15(C-31),59.66(C-41),57.36(C-36),55.26(C-5),52.52(C-35),47.52(C-9),46.50(C-17),45.88(C-19),41.71(C-14),41.40(C-18),39.36(C-8),38.85(C-1),38.54(C-4),37.03(C-10),33.66(C-21),33.24(C-29),32.86(C-7),32.59(C-22),30.85(C-20),28.70(C-23),28.56(C-15),27.54(C-32),27.43(C-2),26.07(C-27),24.62(C-33),24.07(C-34),23.82(C-30),23.41(C-16),23.03(C-11),18.45(C-6),17.22(C-26),16.50(C-25),15.58(C-24)。
2e:白色固体,得率75%,熔点为61~63 ℃。HRMS(ESI)m/z:702.5226[M+H]+;1H NMR(500 MHz,DMSO)δ 5.19(1H,s,H-12),4.77(3H,br s,H-38,H-40,H-42),4.30(1H,d,J=4.7 Hz,-OH),4.03(1H,dd,J=14.2,7.1 Hz,H-39),3.94(2H,s,H-31),3.58(1H,s,H-3),2.98(2H,dd,J=19.3,14.3 Hz,H-36),1.10(3H,s,CH3-23),0.90(3H,s,CH3-27),0.88(6H,s,CH3-30,CH3-26),0.85(3H,s,CH3-29),0.68(3H,s,CH3-24),0.66(3H,s,CH3-25);13C NMR(125 MHz,DMSO)δ 177.07(C-28),143.93(C-13),122.36(C-12),79.54(C-41),77.29(C-3),72.09(C-40),66.97(C-38),67.33(C-39),64.11(C-31),60.23(C-42),58.40(C-37),55.26(C-5),52.52(C-36),47.51(C-9),46.51(C-17),45.88(C-19),41.71(C-14),41.39(C-18),39.36(C-8),38.85(C-1),38.53(C-4),37.03(C-10),33.65(C-21),33.22(C-29),32.86(C-7),32.59(C-22),30.85(C-20),28.98(C-35),28.70(C-23),28.57(C-15),27.54(C-32),27.42(C-2),27.00(C-33),26.06(C-27),25.42,(C-34)23.80(C-30),23.41(C-16),23.02(C-11),18.46(C-6),17.20(C-26),16.50(C-25),15.58(C-24)。
2.2 OADs目标产物对α-葡萄糖苷酶的体外抑制活性
本文以微量α-葡萄糖苷酶-PNPG检测模型对所合成的系列化合物的活性进行了检测和评价,并采用Spss Statistics 17.0 软件计算了其对α-葡萄糖苷酶的IC50值,结果如表1所示。所合成的5个OADs的IC50较OA均有下降,推测可能是因为所连接的1-DNJ本身具有较好的抑制活性,且其分子中含有多个羟基,使得 OADs 的亲水性提高,因而提高了抑制α-葡萄糖苷酶的能力。本文的结果与李文良等[16]的报导相似,当连接亲水基团时,活性有明显提高。在所合成的五个衍生物中,2b(OA与1-DNJ连接桥的碳链长度为3)的活性明显优于OA,IC50值为0.786 mmol/L(OA的IC50=2.387 mmol/L);2a、2c、2d、2e的活性相对于OA也有一定的提高,但是提高程度不明显,说明连接桥碳链的长短对衍生物的抑制活性影响较大。这可能是由于当碳链长度为3时,化合物的结构与酶的活性中心能更好地相匹配,使得1-DNJ上的羟基能与酶的活性中心的氨基酸形成较多的化学键。
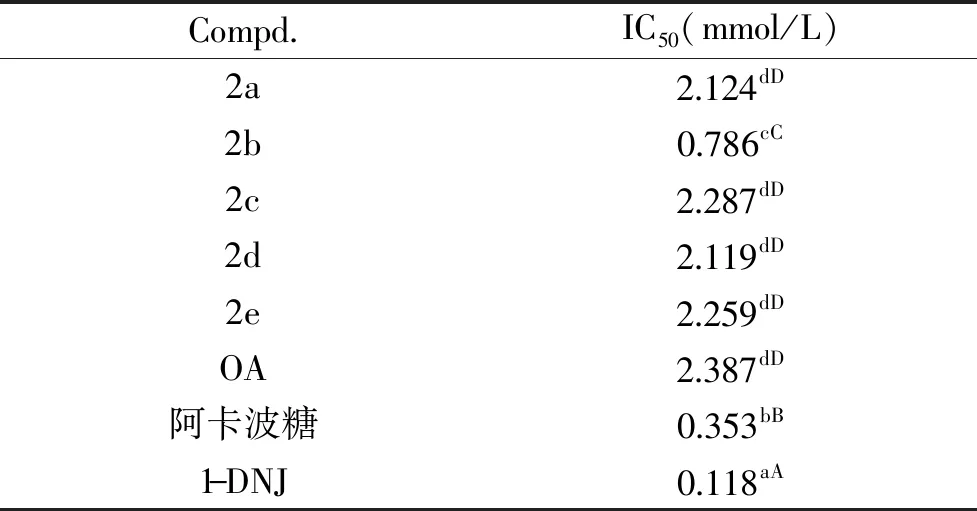
表1 OADs对α-葡萄糖苷酶的抑制活性Table 1 Inhibitory activity of OADs on α-glucosidase
2.3 OADs目标化合物对α-葡萄糖苷酶的抑制动力学分析
本文采用非线性拟合方法,获得了在α-葡萄糖苷酶-PNPG反应体系中活性较好的衍生物2b,OA和阿卡波糖作用下的表观Vmax和表观Km值,并与空白模型进行了比较,结果如表2和图3所示。动力学分析数据显示,与空白组相比在阿卡波糖的作用下,模型的表观Vmax没有显著变化,表观Km值极显著增大(p<0.01),因此属于α-葡萄糖苷酶竞争型抑制剂,而在2b作用下,体系的表观Km值极显著增大(p<0.01),即该化合物使酶与底物的亲和力变弱了,同时表观Vmax也极显著降低(p<0.01),表明2b为混合型抑制类型;在OA作用下,表观Km值无明显变化,而表观Vmax极显著降低(p<0.01),表明OA为非竞争型抑制,与Ding等[24]的分析结果相同。

表2 2b、OA、阿卡波糖的抑制动力学参数Table 2 Enzyme reaction kinetic parameters of compounds 2b,OA and acarbose
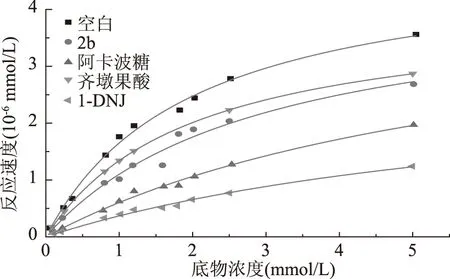
图3 化合物2b、OA和阿卡波糖的体外非线性拟合图Fig.3 Fitting results of kinetic parameters of α-glucosidase-PNPG reaction in vitro under the inhibition of compound 2b,OA,and acarbose by Nonlinear Curve fit
2.4 OADs目标化合物对α-葡萄糖苷酶的抑制机制
为了深入探索OADs与α-葡萄糖苷酶在分子水平上的作用机制,本文通过AutoDock 4.2软件对模建的α-葡萄糖苷酶与活性较好的2b、活性一般的2e、OA与阿卡波糖进行分子对接。由表3可知,ΔG<0说明化合物与酶的结合是自发的,ΔH和ΔS均为负数,表明化合物与酶的之间的作用力为氢键和范德华力,从图 4中可知,OA中的一个羧基和一个羟基与R69、G140、E210形成了4个氢键,2e中三个羟基和羧基与G140、E210、E456形成了4个氢键,2b中四个羟基和一个氨基与R69、D70、L208、E210、R345形成7了个氢键;桥碳链长短对化合物抑制活性有很大的影响,2b活性优于2e和OA的主要原因可能是与酶形成氢键个数多于2e和OA。阿卡波糖与α-葡萄糖苷酶的相互作用主要通过与R69、D70、G140、L208、W209、E210、E211、R345形成8个氢键,与W139、Y351形成Π-Π相互作用,其形成氢键的主要作用部位是连接氨基的糖环,而1-DNJ的结构与阿卡波糖的主要作用部位结构相似[25],因此引入1-DNJ活性基团合成OADs类抑制剂是合理的。结合自由能大小:OA(-12.78 kJ/mol)>2b(-17.19 kJ/mol)>阿卡波糖(-21.01 kJ/mol),结合自由能越低,表明该对接位点的对接越紧密,抑制剂对位点的抑制作用越强,活性越好,也可以解释2b的活性高于OA。
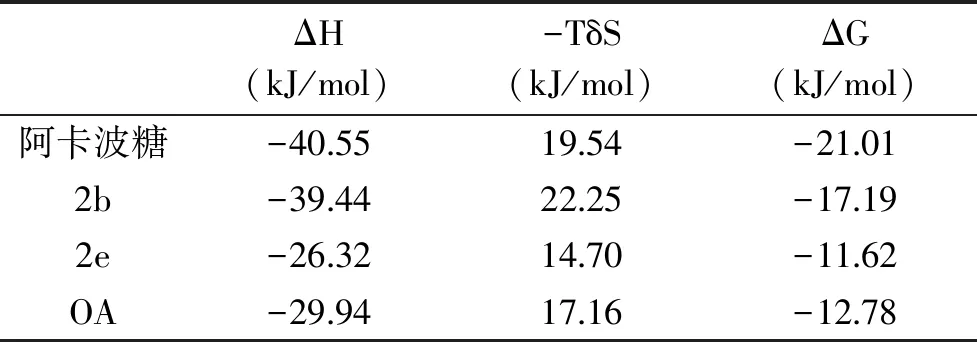
表3 化合物2b、2e、OA和阿卡波糖与α-葡萄糖苷酶模拟对接过程的热力学参数Table 3 Thermodynamic parameters of the molecular docking between compound2b,2e,OA,acarbose and α-glucosidase
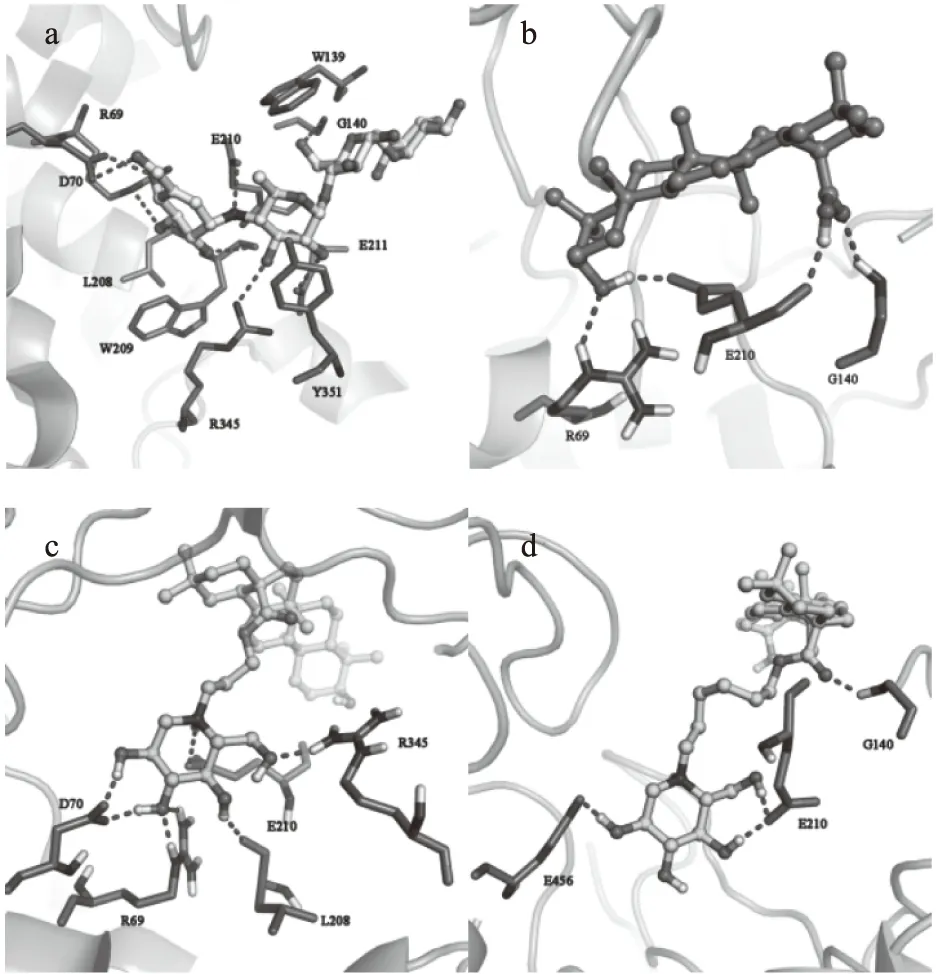
图4 化合物阿卡波糖、OA、2b、2e与α-葡萄糖苷酶分子对接图Fig.4 Diagrammatic sketch of molecular docking between the compound acarbose,OA,2b,2e and α-glucosidase注:(a)阿卡波糖与α-葡萄糖苷酶的分子对接图;(b)OA与α-葡萄糖苷酶的分子对接图;(c)2b与α-葡萄糖苷酶的分子对接图;(d)2e与α-葡萄糖苷酶的分子对接图;虚线表示氢键。
3 结论
根据拼接原理,以OA为先导物,对C-28号位的羧基进行修饰,通过溴代、氮代,引入了一个活性基团—1-DNJ,设计合成了不同碳链长度的OA-1-DNJ杂合体得到了5个新型的化合物,其对α-葡萄糖苷酶活性的抑制作用均高于先导物OA;碳链长短对衍生物的抑制活性影响较大,碳链长度为3时(化合物2b)活性最好,其IC50值为0.786 mmol/L,显著优于OA(IC50=2.387 mmol/L);氢键和范德华力是该类化合物与酶结合的主要作用力,氢键个数越多,抑制效果越好。
——以高中化学“氢键”的教学为例

