高强度超声作用下鲢鱼肌球蛋白的结构及流变学特性变化
谢亚如,刘 庆,熊善柏,2,尤 娟,2,刘 茹,2,*
(1.华中农业大学食品科学技术学院,湖北 武汉 430070;2.国家大宗淡水鱼加工技术研发分中心(武汉),湖北 武汉 430070)
由于超声波技术具有环保、安全、无毒等优点,故其在食品加工方面越来越受到重视,特别是高强度超声在改善食品蛋白质的溶解性[1-4]、凝胶性[5-6]、乳化性[7-8]和起泡性[5,9]等方面,目前研究主要关注的是大豆蛋白、乳清蛋白、牛血清白蛋白、黑豆蛋白等水溶性蛋白质[5]。鱼糜制品营养丰富、口味多样、食用方便,深受消费者欢迎;鲢鱼因其色白、质优、价廉而成为我国鱼糜制品的主要原料,有研究报道超声处理可显著提高鱼糜的凝胶强度[10-12]。肌球蛋白是鱼肉中含量最多,且对鱼糜凝胶性能影响最大的功能性成分[13],本课题组前期研究发现超声处理可降低肌球蛋白聚集体的缔合度,提高其分布的均匀性,并改变其理化特性[1]。在凝胶形成过程中,蛋白质结构将发生转变,暴露出更多的活性基团,分子间相互作用增强,形成三维凝胶网络结构,因而肌球蛋白的凝胶性能与其结构和流变学特性密切相关。也有研究报道超声处理会改变鹅胸肉肌动球蛋白的构象,促进其解离[14];超声处理使鸡肉肌原纤维蛋白溶液稠度系数降低、流动指数增加[15],且适当的超声处理可提高鸡胸肉的储能模量(G′)和持水能力[16]。然而关于超声对鲢鱼肌球蛋白的结构及流变学特性的影响鲜见报道。
本研究将提取的鲢鱼肌球蛋白于不同超声条件(100、150、200、250 W)下处理,研究肌球蛋白的链构象、二级结构及静态流变学特性的变化,在此基础上测定肌球蛋白热胶凝过程中的黏弹性,分析各指标之间的内在联系,探讨超声处理对肌球蛋白凝胶性能的影响,以期为高强度超声在鱼糜凝胶制品中的应用提供理论指导。
1 材料与方法
1.1 材料与试剂
鲢鱼(Hypophthalmichthys molitrix)每尾约1 500 g,购于华中农业大学菜市场,将鲜活鲢鱼迅速送回实验室宰杀,取其背部肌肉,所有实验用鱼肉均是当天的新鲜鱼肉。
ATP二钠盐(ATP-Na2) 生工生物工程(上海)股份有限公司;β-巯基乙醇(β-mercaptoethanol,β-ME)、NaN3美国Amresco公司;其他试剂均为国产分析纯。
1.2 仪器与设备
1750型紫外-可见分光光度计 日本岛津公司;AR2000ex流变仪 美国TA公司;JY92-IIN超声波细胞粉碎机 宁波新芝生物科技股份有限公司;J-1500型圆二色光谱仪 日本JASCO公司。
1.3 方法
1.3.1 肌球蛋白提取
参考刘茹[13]的方法提取肌球蛋白,将尸僵前的鲢鱼背部肌肉用食品调理机破碎,向破碎后的鱼肉中加入10 倍体积20 mmol/L pH 7.5 Tris-HCl缓冲液(含0.1 mol/L KCl溶液和质量分数0.02% NaN3溶液),并用高速分散均质机于9 000 r/min下均质1~2 min。均质液于4 ℃下放置15 min,8 000 r/min离心5 min后去除上清液,将沉淀于5 倍体积0.45 mol/L KCl溶液-20 mmol/L pH 6.8 Tris-HCl缓冲液(含5 mmol/L β-ME、0.2 mol/L Mg2CO3、1 mmol/L乙二醇二乙醚二胺四乙酸)中悬浮,同时加入5 mmol/L ATP-Na2溶液使肌球蛋白与肌动蛋白解离。于4 ℃下放置60 min后10 000 r/min离心10 min,上清液用6 倍体积1 mmol/L KHCO3溶液稀释,于4 ℃下放置60 min后12 000 r/min离心10 min。沉淀重新用2.5 倍体积含0.5 mol/L KCl、5 mmol/L β-ME的20 mmol/L pH 7.5 Tris-HCl缓冲液悬浮,于4 ℃下放置15 min,再用2.5 倍体积的1 mmol/L KHCO3溶液稀释并加入MgCl2溶液至终浓度为10 mmol/L,于4 ℃下放置过夜。12 000 r/min离心15 min,收集沉淀得到纯化的肌球蛋白。肌球蛋白溶解度测定参考Lowry等[17]的方法,用牛血清白蛋白作标准品。蛋白纯度采用十二烷基硫酸钠-聚丙烯酰氨凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)法[18]测定,所得电泳图采用Gel-Pro Analyzer 4.0凝胶定量分析软件分析。
1.3.2 超声处理样品
用20 mmol/L pH 7.5 Tris-HCl缓冲液(含0.5 mol/L NaCl溶液)调节肌球蛋白至相应质量浓度,分别取25 mL肌球蛋白溶液于50 mL离心管中,用直径为0.6 cm的超声探头插入蛋白溶液下1 cm处理肌球蛋白溶液,整个超声过程中将离心管置于冰水浴中以避免样品过热。用超声频率为20 kHz,功率分别为100、150、200、250 W超声分别处理3、6、9、12 min(为避免探头伤害,每超声2 s停止2 s,总作用时间包含2 s的间隔时间)。研究超声处理对鲢鱼肌球蛋白流变学特性的影响时,用超声频率为20 kHz,功率分别为100、150、200、250 W超声处理12 min。超声结束后,将蛋白放置在4 ℃冰箱中,静置12 h后测定其链构象和流变学特性变化。超声时,采用量热法[19]记录温度随时间的变化,采用式(1)估计超声强度(P)。
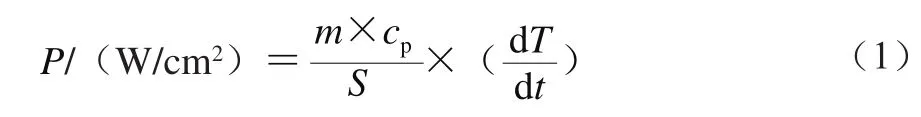
式中:m为被超声溶液质量/kg;cp为被超声溶液的比热容/(J/(kg·K));dT/dt为温度随时间变化的斜率/(K/s),S为超声发射面的表面积/cm2。
本实验中,100、150、200 W和250 W超声所产生的超声强度分别为22.81~24.66、31.14~35.76、40.39~45.63、49.94~55.50 W/cm2。
1.3.3 紫外吸收光谱及其二阶导数图谱测定
紫外吸收光谱测定的肌球蛋白质量浓度为1.0 mg/mL,以相应缓冲液为参比空白,采用1750型紫外-可见分光光度计在230~350 nm波长范围内进行中速扫描,采样间隔1 nm。利用Origin 8.0软件的Differentiate模式对紫外吸收光谱数据进行二阶导数计算,并绘制二阶导数图谱。
1.3.4 圆二色光谱测定
用J-1500型圆二色光谱仪测定肌球蛋白的圆二色性。将质量浓度为0.05 mg/mL的肌球蛋白样品放入0.1 cm光径的石英样品池中,在远紫外区(198~250 cm)进行扫描,扫描速率为50 nm/min,响应时间为5 s。每个样品做3 次平行,结果取平均值,氨基酸残基平均分子质量取110 g/mol。α-螺旋、β-折叠、β-转角和无规卷曲的含量用圆二色光谱仪程序中杨氏模量程序计算得出。
1.3.5 静态流变学特性测定
肌球蛋白质量浓度为10 mg/mL,采用AR2000ex型动态流变仪在Flow模式下扫描,测试条件为:温度4 ℃,锥板倾斜角2°、直径40 mm,载物台与锥板间距为54 μm。采用Steady state flow step模式,以剪切速率(γ)为变量,变量范围为0.01~1 000 s-1,得到剪切应力(τ)随γ变化曲线,采用幂律定律(式(2))进行拟合。

式中:K是稠度系数/(Pa·sn);γ是剪切速率/s-1;τ是剪切应力/Pa;n是流动指数。
表观黏度(ηα)由式(3)计算。

采用Cross模型拟合可得零剪切黏度η0(式(4))。
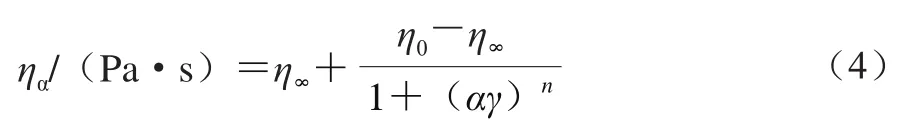
式中:η0是零剪切黏度/(Pa·s);η∞是无穷剪切黏度/(Pa·s);α是Cross参数。
1.3.6 动态流变学特性测定
将25 mg/mL样品于初始温度4 ℃下置于AR2000ex型动态流变仪的平台上,几何测头是直径为40 mm的平板,平板与载物台间距为1 mm,用涂了液体石蜡油的密封盖封住样品以免水分蒸发。在振动模式下进行温度扫描,以2 ℃/min由4 ℃升至90 ℃,然后以10 ℃/min快速降温至20 ℃,并于20 ℃进行频率扫描,频率扫描范围为0.1~100 Hz,τ为1.0 Pa,记录升温、频率扫描过程中G′、损耗模量(G″)和相位角(δ)的变化。
1.4 数据处理与分析
实验重复3 次,每次做3 个平行。采用Excel软件进行数据统计,应用Origin 8.6软件作图,结果以±s表示。采用SAS 8.0软件Duncan法进行显著性分析,P<0.05表示差异显著。
2 结果与分析
2.1 鲢鱼肌球蛋白纯度鉴定结果
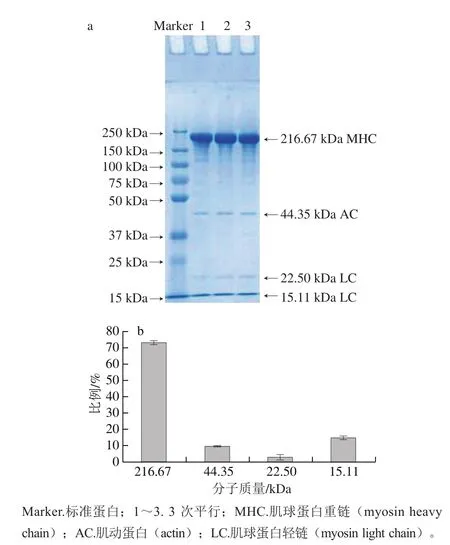
图 1 鲢鱼肌球蛋白的SDS-PAGE图(a)和各条带的比例(b)Fig. 1 SDS-PAGE patterns of the extracted myosin (a) and percentages of each band (b)
肌球蛋白由2 条MHC和4 条LC组成[20],如图1a所示,电泳时亚基解离,得到的MHC、LC的分子质量分别为216.67 kDa和22.50、15.11 kDa。由图1b可知,本研究提取的肌球蛋白样品中杂蛋白是actin,其比例为9.42%,因此肌球蛋白的纯度为90.58%,说明所得肌球蛋白的纯度高,可作为本实验的原料使用。
2.2 肌球蛋白紫外吸收光谱及其二阶导数图谱分析
如图2a所示,随着超声功率的增加和超声时间的延长,表征色氨酸、酪氨酸和苯丙氨酸残基的276 nm波长处吸光度上升,根据邱春江[21]的研究结果,推测超声处理改变了肌球蛋白构象,使包埋在分子内部的色氨酸和酪氨酸等芳香族氨基酸残基暴露出来。
蛋白质侧链中色氨酸吲哚环和酪氨酸、苯丙氨酸的苯环等共轭体系在276 nm波长处均有吸收,为分辨重叠峰和放大谱带的精细结构。对紫外吸收光谱进行二阶导数分析,如图2b所示,所有样品的二阶导数图谱均有3 个正特征吸收峰,分别在282、289、298 nm波长附近,两个负吸收峰在284 nm和292 nm波长附近。其中289 nm波长处的吸收峰归属于色氨酸和酪氨酸残基共同作用,282 nm和298 nm波长处的吸收峰归属于色氨酸残基。
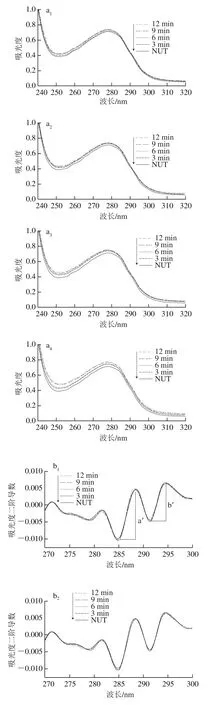
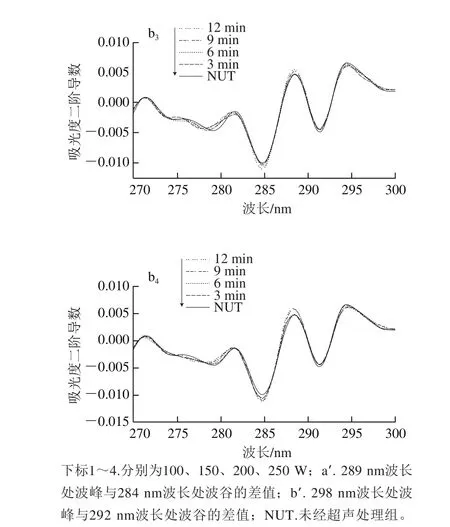
图 2 高强度超声处理条件下鲢鱼肌球蛋白溶液的紫外吸收(a)及其二阶导数图谱(b)Fig. 2 UV absorption spectra (a) and second derivative (b) spectra of silver carp myosin treated by high intensity ultrasound
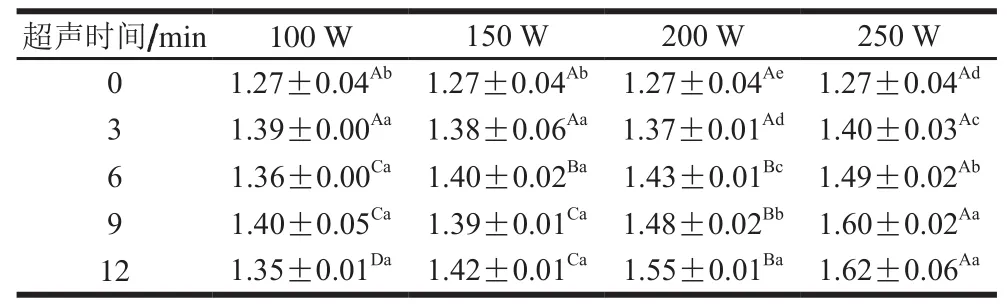
表 1 高强度超声条件下鲢鱼肌球蛋白二阶导数图谱r值Table 1 r values from second derivative spectra of silver carp myosin treated by high intensity ultrasound
根据Lange等[22]的方法计算出r值(r=a′/b′),r值与色氨酸和酪氨酸的相对数量和平均极性有关[22-23]。由表1可以看出,在实验条件下,超声处理均显著增加肌球蛋白分子r值,且200 W和250 W超声处理时,r值随着超声时间延长显著增大,进一步证明了超声处理使得肌球蛋白分子暴露出更多的色氨酸和酪氨酸残基,尤其是在超声强度较高的条件下。高强度超声作用于液体体系时会引发空穴效应,空穴气泡存在时间短,经过几个正负压强交替循环后,气泡尺寸增大到临界值,变得不稳定,最终剧烈崩溃,产生超高温(大于5 000 K)和超高压(大于1×109Pa),并形成湍流作用和剪切波[5,21,24-25],推测该机械作用促使肌球蛋白结构伸展,暴露出更多的基团。
2.3 超声处理对肌球蛋白二级结构的影响
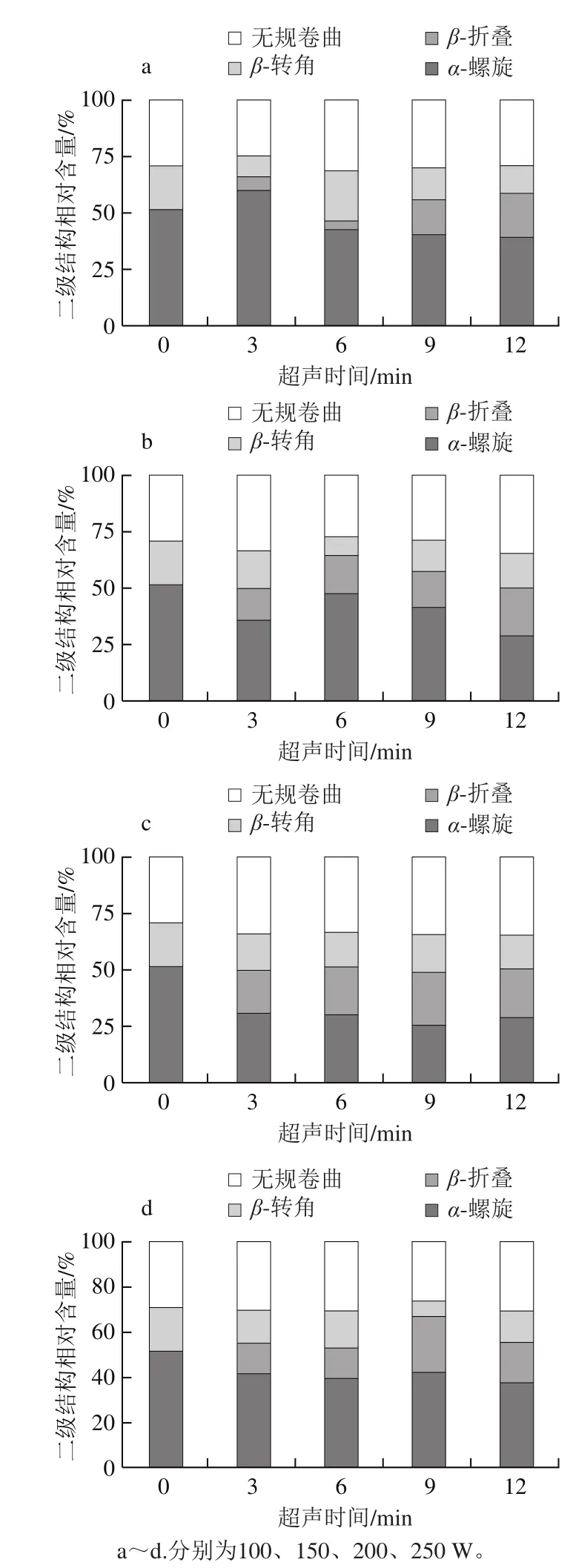
图 3 高强度超声处理条件下鲢鱼肌球蛋白二级结构含量的变化Fig. 3 Changes in secondary structure of silver carp myosin treated by high intensity ultrasound
如图3所示,经过超声处理(除100 W超声处理3 min)后,肌球蛋白的α-螺旋含量整体呈下降趋势,β-折叠和无规卷曲含量整体呈上升趋势。高强度超声的空穴效应和机械效应可使聚集体发生解离,提高其溶解性[1],该作用有利于肌球蛋白更好地分散,这可能是100 W超声3 min处理促使肌球蛋白α-螺旋含量上升的原因。随着超声强度的提高,空穴效应和机械效应进一步加强,破坏了维持蛋白质二级结构的主要作用力(氢键),使比较紧密的α-螺旋向更为松散的β-折叠和无规卷曲结构转变。紫外光谱结果显示超声处理后有更多的色氨酸、酪氨酸等氨基酸残基暴露(图2、表1),也说明超声促使肌球蛋白结构变得更为松散。
2.4 超声处理对肌球蛋白静态流变学特性的影响

图 4 高强度超声处理对鲢鱼肌球蛋白溶液τ-γ曲线的影响Fig. 4 Relationship between shear stress (τ) of silver carp myosin and shear rate (γ) treated by high intensity ultrasound

表 2 高强度超声处理下鲢鱼肌球蛋白样品的幂律模型参数Table 2 Power law model parameters of silver carp myosin treated by high intensity ultrasound
由图4可知,在低剪切速率下,肌球蛋白溶液的τ随γ的升高几乎呈线性上升的趋势,表现出牛顿流体特性,此阶段流体的黏性与剪切速率无关,称为η0。η0常用于判断分子之间的相互作用强度,若分子之间相互缠绕紧密,则η0升高;若聚合物之间的相互作用力减弱,则η0降低[26]。如表2所示,Cross模型具有较高的拟合精度。随着超声强度的增加,肌球蛋白溶液的η0均小于未超声处理组,这可能是由于超声处理使肌球蛋白分子间氢键、离子键等非共价键发生了一定的解缠绕作用。
由图4可知,所有样品在纵坐标上的截距(即屈服应力)均为零,τ随着γ的增加而增大,且增大的速率逐渐变缓。采用幂律定律对τ-γ曲线进行拟合,所得模型P值均小于0.05,说明模型具有很高的拟合精度。如表2所示,所有肌球蛋白溶液的n值均小于1,表现为假塑性流体。超声处理降低了肌球蛋白样品的K值,而n值均高于未超声处理组,说明超声处理增加了样品的流动性,并使其更接近于牛顿流体。
由图5可知,所有样品的ηα都随着γ的增加先迅速下降后缓慢下降至趋于稳定,这是因为γ较低时,尽管有轻微的剪切取向效应,但分子的无规则布朗运动使分子或分子的聚集体处于无序状态,表现为具有较高的黏度。随着γ的增大,相互作用的肌球蛋白分子将沿着剪切驱动力的方向流动,分子链逐渐解缠绕、拉伸和取向,排列后的分子或分子聚集体更容易相互滑移,溶液的ηα急剧下降。当γ增大到一定程度时,ηα趋于稳定,再次表现出类似牛顿流体的性质。在同一剪切速率下,ηα随超声功率的增加而下降,进一步证明了肌球蛋白溶液流动性随超声功率增加而增大。前期研究发现,超声产生的空穴效应会降低肌球蛋白组装体粒径,且粒径随超声功率的增加而下降[27],因而推测K值和ηα下降与超声导致的肌球蛋白组装体粒径减小有关,粒径下降会减少流动阻力,进而降低其K值,使其流动性增大。这与Hu Hao[28]和Karki[29]等对大豆分离蛋白的研究结果相似。
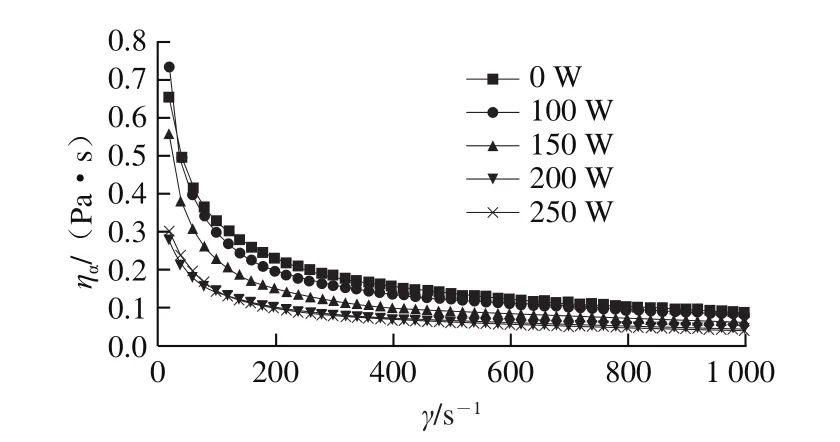
图 5 高强度超声处理下鲢鱼肌球蛋白溶液的ηα-γ曲线Fig. 5 Relationship between apparent viscosity (ηα) and shear rate (γ)of silver carp myosin treated by high intensity ultrasound
2.5 超声处理对肌球蛋白动态流变学特性的影响
如图6所示,样品加热前(4 ℃),未超声样品的G′和G″明显高于超声处理组,而δ明显小于超声处理组,说明超声处理减小了肌球蛋白自组装程度,这与图5超声处理使肌球蛋白的流动性增加的结果吻合。温度由4 ℃升至34 ℃过程中,未超声样品的G′、G″和δ均呈下降趋势,这是由于低温下肌球蛋白组装体主要由氢键、离子键稳定,升温会减弱这些作用力,使部分组装体解聚,降低了G′和G″,同时暴露出更多的活性基团,使分子间疏水相互作用增强[30],进而降低δ,使其固体性能进一步增大。超声处理后样品在4~34 ℃范围内黏弹性的变化趋势与未超声样品相似,G′和G″的下降幅度明显低于未超声样品,而δ下降幅度明显高于未超声组,说明超声处理提高了肌球蛋白分子的交联速度,这可能是由于超声预处理已使肌球蛋白分子暴露出更多的活性基团,而未超声样品在升温过程中活性基团才慢慢暴露出来。在34~40 ℃范围内,所有样品的G′与G″均随温度的增加迅速上升,而δ快速下降,说明肌球蛋白发生了凝胶化;且超声处理后肌球蛋白凝胶化温度不同程度地降低,结合紫外吸收光谱(图2),推测超声诱导了更多活性基团的暴露,有利于分子间相互作用,促进蛋白质凝胶化。40~45 ℃升温过程中,下降的G′、G″和上升的δ说明样品发生了凝胶劣化,根据刘海梅等[31]的报道,凝胶劣化可能是肌球蛋白尾部α-螺旋解旋,同时有大量氢键断裂,但新的化学键来不及生成所致。随着温度的进一步升高,G′迅速上升,随后略有下降,对应的δ减小至3°左右,说明样品由弱凝胶转变为典型的凝胶体。
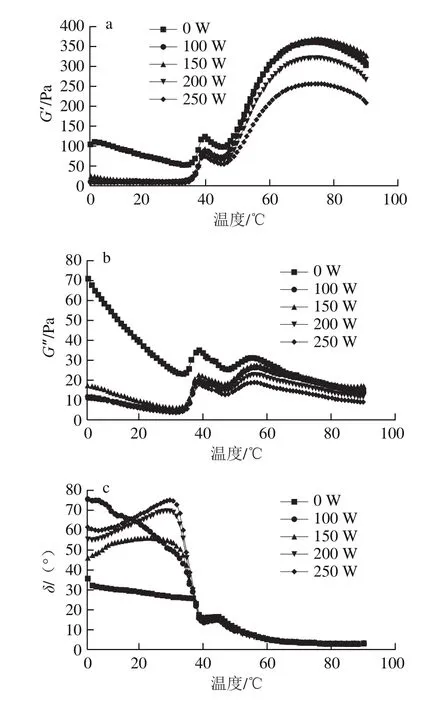
图 6 高强度超声处理条件下鲢肌球蛋白在升温过程中的G′(a)、G″(b)、δ(c)变化Fig. 6 Changes in G′ (a), G″ (b) and δ (c) of silver carp myosin treated by high intensity ultrasound during heating

表 3 高强度超声处理条件下鲢鱼肌球蛋白样品流变学特性参数的关键变化点Table 3 Critical points of rheological parameters of silver carp myosin treated by high intensity ultrasound
由表3中最终G′可以看出,升温结束(90 ℃)时,G′由高到低的顺序为:150 W和100 W超声处理样品组、未超声处理组、200 W和250 W超声处理组,说明适当的超声(150 W和100 W)处理可提高肌球蛋白的凝胶形成能力,而超声功率过大(200 W和250 W)会降低肌球蛋白的凝胶形成能力。根据本课题组前期研究结果[1]推测这是适当的超声处理使部分活性基团暴露、分子间作用力增强,而超声强度过大(200 W和250 W)导致部分肌球蛋白降解所致。

图 7 高强度超声处理条件下鲢鱼肌球蛋白凝胶在频率变化过程中的G′(a)、G″(b)、δ(c)变化Fig. 7 Changes in G′ (a), G″ (b) and δ (c) of silver carp myosin treated by high intensity ultrasound during frequency sweeping
图7显示了频率扫描过程中肌球蛋白凝胶黏弹性变化,可以看出G′明显高于G″,且均随频率的增加缓慢上升,而δ在9°左右,说明所有样品加热后均形成了较好的凝胶体。随着超声功率的提高,G′与G″有所降低,而δ无明显变化。本课题组前期研究发现,超声处理使肌球蛋白伸展,提高了其亲水性和溶解性,同时使其分散均匀性增加[1],推测超声处理的肌球蛋白形成的凝胶网络结构更为均匀,持水性更强。
3 结 论
与未超声组相比,高强度超声处理会降低肌球蛋白的低温自组装程度,使肌球蛋白样品的η0逐渐降低、K值减小、n值增大,提高其流动性。高强度超声处理还会诱导肌球蛋白α-螺旋向较为松散的β-折叠和无规卷曲结构转变,促使原本包埋在分子内部的部分活性基团暴露出来,有利于升温过程中分子间的交联,并降低凝胶化温度。适当的超声条件(100 W和150 W处理12 min)可提高肌球蛋白的凝胶形成能力,而超声功率过大(200 W和250 W处理12 min)则会降低其凝胶形成能力。综上所述,适当的高强度超声处理可用于肌球蛋白改性以改善其凝胶性质。

