构建三阴性乳腺癌的三维体外培养模型用于抗肿瘤药物的活性评价
王 杰,李婷婷,李瑞红,陈志强,周元园,王韫芳,柳 娟,张宏艳
乳腺癌是严重威胁女性生命健康的恶性肿瘤,在发达城市地区,其发病率逐年升高,据国家癌症中心最新统计显示,全国每年新发乳腺癌例数超过27万,死亡例数超过7万,位居女性恶性肿瘤发病率之首。其中,三阴性乳腺癌(triple-negative breast cancer,TNBC)的雌激素受体(estrogen receptor,ER),孕激素受体(progesterone receptor,PR)和人表皮生长因子受体2(human epidermal growth factor receptor-2,HER-2)均为阴性,具有恶性程度高、易复发转移、生存率低的特点[1]。三阴性乳腺癌因其特殊生物学特征,易产生耐药导致预后较差,因此研发能降低肿瘤耐药性和预防肿瘤转移复发的更为高效的抗肿瘤药物就变得尤为重要。
通过组织工程技术的不断发展,组织化培养的的肿瘤微组织已经被用于肿瘤生物学及分子机制研究,相较于二维(two dimensional,2D)培养,三维(three dimensional,3D)培养模型可以模拟肿瘤细胞在体生长状态,并取得了大量的研究进展[2-3]。3D细胞培养支架为细胞培养提供了类似体内生长环境,因此选择好的3D细胞培养支架材料也是成功进行3D培养的一个关键因素[4]。基质胶(Matrigel)是一种孔径为20~50 nm的水凝胶基质,其主要成分为细胞外基质蛋白[5]。MDA-MB-231是一种ER、PR、HER-2均为阴性的乳腺癌细胞系,恶性程度高。该研究拟采用 Matrigel模拟肿瘤细胞外基质微环境,促进MDA-MB-231细胞形成3D类组织结构,采用液滴重叠法构建体外肿瘤细胞3D培养体系,对临床常用抗肿瘤药物进行药物药效学评价,旨在构建一种能够真实模拟反映体内抗肿瘤药物敏感性的基于Matrigel的3D肿瘤微组织培养模型(3D-M);使用流式细胞仪在2D、3D及3D-M培养条件下肿瘤细胞对药物的内吞情况,探索不同模型所检测的药物敏感性差异的机制。
1 材料与方法
1.1药物、试剂与仪器多西紫杉醇注射液(docetaxel injection,DTX,英国安万特医药有限公司);盐酸表柔比星注射液(epirubicin hydrochloride for injection,EPI,海正辉瑞制药有限公司);酒石酸长春瑞滨注射液(vinorelbine bitartrate injection,NVB,江苏豪森药业股份有限公司);氟尿嘧啶注射液(fluorouracil injection,5-Fu,天津金耀药业);注射用环磷酰胺(cyclophosphamide for injection,CTX,百特国际有限公司);顺铂注射液(cisplatin injection,DDP,江苏豪森药业股份有限公司);注射用盐酸吉西他滨(gemcitabine hydrochloride for injection,GEM,江苏豪森药业股份有限公司);紫杉醇注射液(paclitaxel injection,Tax,海口奇力制药有限公司);依托泊苷注射液(etoposide injection,VP-16,齐鲁制药有限公司);DMEM培养基(美国Gibco公司);胎牛血清 (以色列bioligical industries公司);Matrigel基质胶(美国BD公司);Alamar Blue(美国Invitrogen 公司);96孔板(美国Costar公司);Attune NxT流式细胞仪、CO2培养箱(美国Thermo Scientific公司);Vectra荧光显微镜、Ensight微孔板检测仪(美国PerkinElmer 公司)。
1.2方法
1.2.1细胞培养 MDA-MB-231细胞培养于含 10% 胎牛血清、100 μg/ml 青霉素、100 μg/ml链霉素的DMEM培养基中,于37 ℃、5% CO2饱和湿度培养箱中培养,隔天换液,待其汇合度达到90% 左右,用含0.02% EDTA的0.25%的胰蛋白酶消化传代。
1.2.23D与3D-M肿瘤微组织的构建 将Matrigel基质胶用4 ℃ DMEM培养基稀释成10 μg/ml,低吸附的96孔U型孔板每孔50 μl包被,静置10 min 左右,将50 μl MDA-MB-231细胞悬液分别以50、100、200、400、600、800、1 200、1 600、2 000个/孔加入孔板混合均匀,于37 ℃、5% CO2饱和湿度培养箱中培养5 d,期间镜下观察细胞形态并拍照记录3D微组织的变化。确定MDA-MB-231肿瘤微组织构建的最适细胞数,将MDA-MB-231以最适细胞数接种于无Matrigel包被的低吸附的96孔U型孔板中,并定期观察。将MDA-MB-231细胞在3D、3D-M条件下培养5 d的肿瘤微组织,收集后4%多聚甲醛固定,依次经70%酒精20 min,95%酒精20 min,100%酒精2×20 min,二甲苯2×20 min梯度脱水;石蜡包埋切片,脱蜡后经蒸馏水洗3次,Harris苏木精-酸化伊红染色,再经脱水透明后封片拍照。
1.2.3Alamar blue法检测细胞增殖 取对数生长期的MDA-MB-231细胞接种,2D培养的细胞以3×103个/孔接种于96孔板中,3D及3D-M培养的细胞以600个/孔分别接种于无基质培养基和Matrigel(10 μg/ml)包被的低吸附的96孔板培养,在0、1、2、3、4、5 d时分别检测12个孔,每孔加入10 μl的Alamar blue试剂,混匀后置于37 ℃、5% CO2饱和湿度培养箱2 h,Ensight微孔板检测仪检测Ex 570 nm、Em 585 nm的荧光值,用于评测细胞活性。
1.2.4抗肿瘤药物活性检测 取对数生长期的MDA-MB-231细胞接种,2D培养的细胞以8×103个/孔接种于96孔中,24 h过夜贴壁后加化疗药进行细胞毒性测试。3D及3D-M培养的细胞以600个/孔分别接种于无基质和10 μg/ml Matrigel包被的低吸附的96孔板培养,5 d后加化疗药进行细胞毒性测试,DTX、EPI、NVB、5-Fu、DDP、Tax、VP-16浓度分别为0.01、0.1、1、10、100 μg/ml,CTX、GEM浓度分别为0.1、1、10、100、1 000 μg/ml。2D、3D及3D-M培养的MDA-MB-231细胞在给药24 h后,每孔分别加入10 μl 的Alamar blue试剂,混匀后置于37 ℃、5% CO2饱和湿度培养箱2 h,Ensight微孔板检测仪检测Ex 570 nm、Em 585 nm的荧光值,用于评测细胞活性。
1.2.5流式细胞仪检测化疗药物进入肿瘤微组织的情况 将MDA-MB-231细胞在2D、3D及3D-M 条件下培养5 d,弃培养基,各加入含有10 μg/ml EPI的DMEM培养基,加药作用时间为0、10、30、60 min时,弃培养基,预冷的PBS洗3遍,将2D、3D和3D-M培养的细胞消化为细胞悬液分别收集于1.5 ml离心管中,使用流式细胞仪检测MDA-MB-231细胞内吞EPI的量。

2 结果
2.13D培养乳腺癌微组织的形态表征镜下观察表明Matrigel可以促进MDA-MB-231细胞成球,细胞数偏低和偏高均不能和基质相契合,仅在400~800 个细胞/孔时,MDA-MB-231细胞可以和Matrigel充分结合,形成致密立体结构,故确定以MDA-MB-231细胞(600/孔)与50 μl Matrigel(10 μg/ml)共培养时可以形成3D微组织,见图1。在2D单层培养条件下,镜下乳腺癌 MDA-MB-231细胞贴壁生长,癌细胞大小不等成巢状汇集,癌细胞呈现多边形、梭形、椭圆形。在用低吸附U型底96孔板3D培养乳腺癌MDA-MB-231细胞时,加Matrigel共培养时可以聚集成紧密的球形,而未加Matrigel培养的微组织镜下较为松散。在3D和3D-M培养的肿瘤微组织石蜡切片HE染色时,3D培养的微组织细胞呈现类圆形,3D-M共培养的肿瘤微组织更为紧密,见图2。
2.2MDA-MB-231细胞在不同培养条件下增殖情况比较将MDA-MB-231细胞在2D、3D和3D-M培养条件下1~5 d的细胞计数做增殖曲线时,可以发现2D培养较3D培养增殖快,呈指数型增长;3D培养时生长速度较慢,加Matrigel时细胞增殖较不加Matrigel时快,表明Matrigel能够促进MDA-MB-231的细胞增殖,见图3。
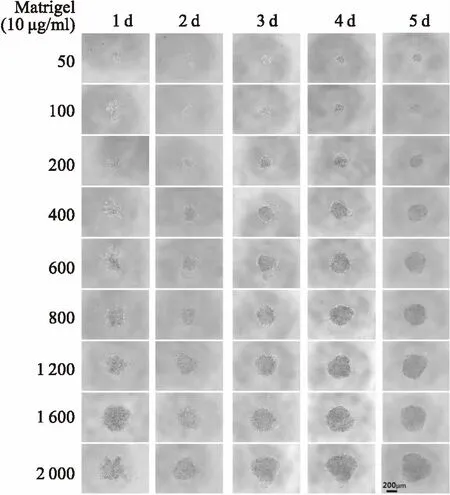
图1 MDA-MB-231细胞三维培养的形态表征

图2 MDA-MB-231细胞培养条件下的生长情况及染色
2.3使用不同培养条件下的MDA-MB-231细胞进行抗肿瘤药物活性检测结果MDA-MB-231细胞在2D、3D和3D-M培养条件下,使用临床常用一线化疗药物DTX、EPI、NVB、5-Fu、CTX、GEM、DDP、Tax、VP-16,在多浓度条件下分别做药物敏感性实验,通过比较药物20%抑制浓度(IC20)值,3D培养条件下的IC20值大于2D培养,3D-M培养条件下的IC20值大于3D培养,测试DTX、EPI、NVB、5-Fu、CTX、GEM、DDP、Tax、VP-16的 IC20,3D分别为2D的11.7、2.3、46.5、12.7、769.2、8.1、1.7、11.7、0.7倍;3D-M分别为3D的4.4、7.6、1.9、1.6、1、1.4、416.7、0.8、5.9倍,可以发现3D-M培养条件下的细胞对化疗药物毒性反应的敏感性较差,耐受性高,反映出较强的耐药性,见表1、图4。
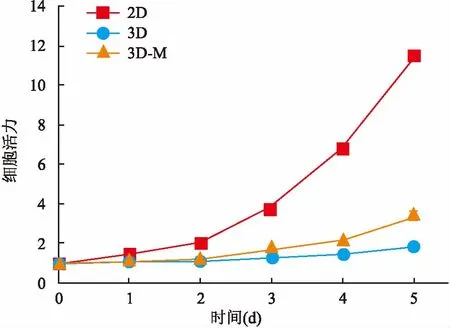
图3 MDA-MB-231细胞在2D、3D和3D-M 培养条件下
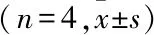
表1 MDA-MB-231细胞体外24 h药物毒性
2.4药物在不同培养条件下的MDA-MB-231细胞的含量分析EPI是一个带自发荧光的临床一线化疗药,能够在488 nm的激发光下,发射红色荧光。通过观察MDA-MB-231细胞在不同培养条件下不同作用时间时对EPI的内吞,可以直观地比较MDA-MB-231细胞中药物含量的变化。在流式细胞仪检测MDA-MB-231细胞内吞EPI实验中,药物作用时间分别为0、10、30、60 min,作用时间越长,内吞药物的MDA-MB-231细胞的阳性细胞率越高,中位荧光强度越强;3D培养条件下细胞内吞药物的阳性细胞率和中位荧光强度较2D培养低,3D-M相较3D培养条件下的阳性细胞率和中位荧光强度偏低,在药物作用10 min时,3D-M的阳性细胞率和中位荧光强度较低,分别为3D的71%和54%,30 min时,3D-M的阳性细胞率和中位荧光强度较低,分别为3D的80%和25%,60 min时,3D-M的阳性细胞率和中位荧光强度较低,分别为3D的93%和27%,见图5。
3 讨论
传统的细胞培养法多采用2D单层平面培养,实际上许多细胞从组织中分离并进行2D培养后,会贴壁生长逐渐失去极性,导致异常分化甚至失去分化表型[6]。2D培养的MDA- MB-231细胞生长速度较快,培养箱过夜24 h内便可以贴壁,生长2~3 d细胞汇合度便可达到80%以上。其无论以何种细胞密度进行无基质介导的3D培养,自身均难以进行微组织化培养。MDA-MB-231细胞600/孔和50 μl 的Matrigel(10 μg/ml)在U型低吸附96孔板共培养5 d可以形成3D肿瘤微组织。3D培养条件下,肿瘤细胞的增殖速率较2D减慢,细胞生长周期延长,可以进行长时间、动态的细胞观察和检测。
2D细胞培养是现在研究肿瘤细胞生物学的主要方法,但在2D培养体系下建立的2D细胞培养体外模型,不能很好地模拟体内肿瘤细胞与微环境之间的相互作用,研究的耐药机制也不能完全说明体内实际的耐药机制[7]。与传统2D培养相比,3D细胞培养既可模拟体内细胞生长的微环境,又有更直观性和条件可控的优势。David et al[8]在对2D和3D培养条件下的肺癌细胞研究时发现,肺癌细胞2D培养时细胞间相互作用较难实现,而3D培养的细胞间紧密连接,更利于传递生物信息,更接近体内细胞的分化程度、超微结构等生物特征。
以往研究表明,3D细胞培养技术能更好的模拟在人体内细胞的生长微环境。3D培养的体外肿瘤微组织细胞具有与体内肿瘤细胞相似的耐药性,但当肿瘤微组织被消化为单细胞后,肿瘤细胞对药物的耐受性大幅降低。Graham et al[9]研究证实乳腺癌细胞EMT6经过3D培养后具有耐药性,但改为2D培养后其药物耐受性显著降低。Matrigel是一种细胞外基质蛋白的提取物,可以为细胞提供物理支撑,还能使细胞快速黏附,并充分接触到细胞外基质,为细胞提供近似于体内的立体微环境[10]。Matrigel可以为MDA-MB-231细胞构建一个生长的微环境,并可以促进MDA-MB-231细胞的增殖,能够真实模拟肿瘤细胞体内的生长状态。Wang et al[11]在 Matrigel中培养人乳腺上皮细胞(MCF10 A)以及成纤维细胞和脂肪细胞等乳腺间充质细胞,经过3D培养,促使组织形成类似体内的乳腺腺泡状结构,乳腺间充质细胞表现出与体内相似的生物学特性,如极性的维持及上皮细胞功能性分化等,说明3D培养比2D培养更能模拟体内微环境。大量研究[12-13]也表明,3D培养模型优于2D细胞培养模型。
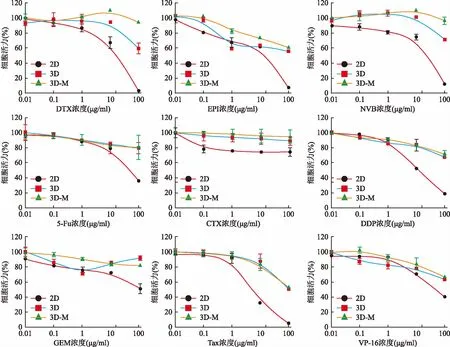
图4 MDA-MB-231细胞在2D、3D和3D-M培养条件下的抗肿瘤药物活性检测
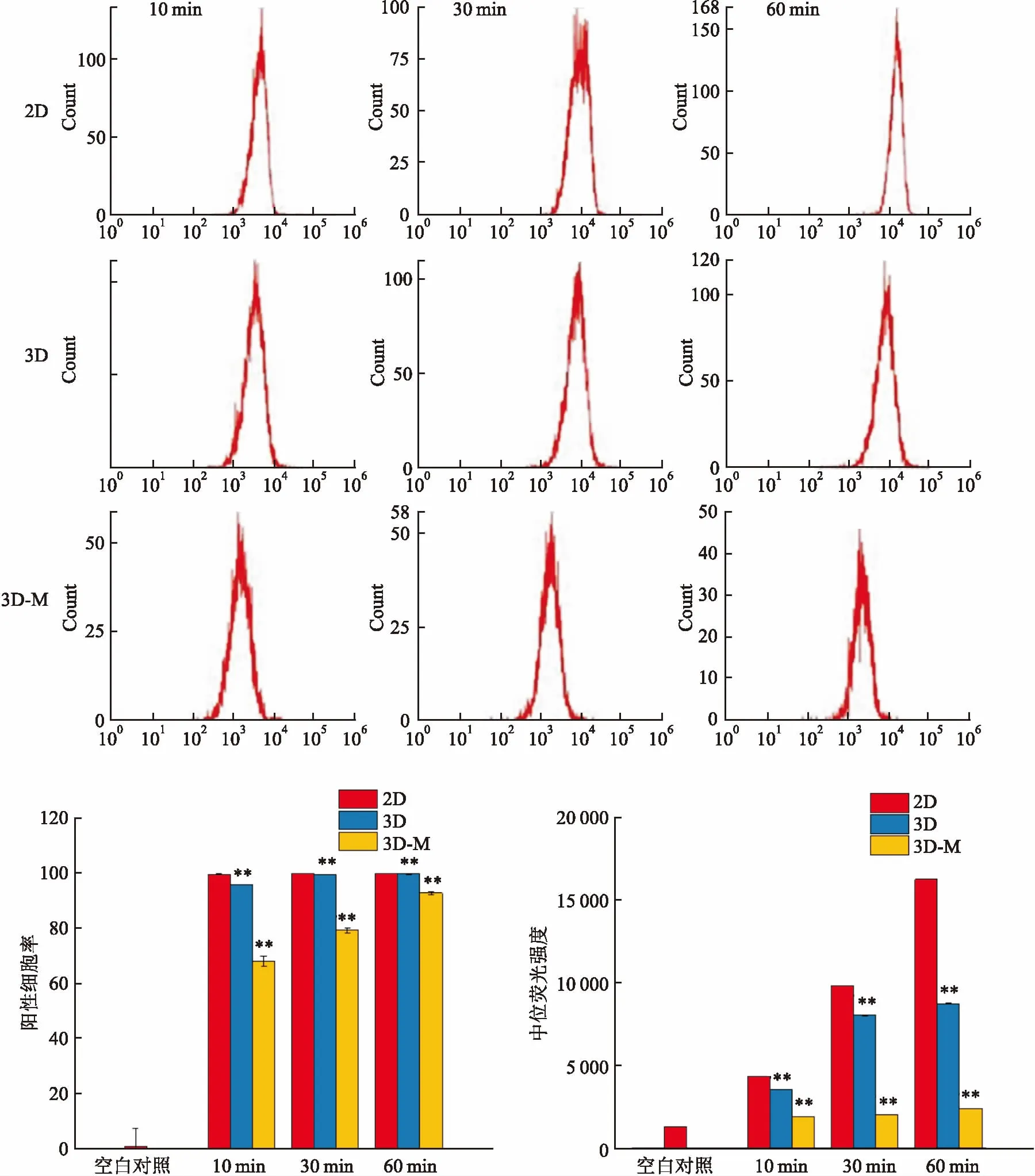
图5 流式细胞仪检测化疗药物进入不同培养条件下肿瘤微组织的情况
据文献报道,TC-71 EW肿瘤细胞经3D支架培养后,对阿霉素有较强的耐药性,其IC50为2.738 mmol/L,而经2D贴壁单层培养的 TC-71 EW肿瘤细胞对阿霉素的敏感性显著增高,其IC50为0.012 2 mmol/L[14]。本研究采用 Alamar blue法进行乳腺癌细胞药物敏感性检测,通过比较多种药物IC20值,3D培养条件下的IC20值远大于2D培养,3D-M培养条件下的IC20值远大于3D培养,差异有统计学意义,可以发现在3D-M培养条件下的细胞对化疗药物毒性反应的敏感性较差,表明3D-M条件下培养肿瘤细胞对化疗药物有较强的耐受性。Matrigel 3D培养时MDA-MB-231细胞可形成致密的立体球形结构,在进行测试抗肿瘤药物活性时,2D培养的细胞可以和药物充分接触,进入细胞内的药物浓度较高,药物更容易起效;Matrigel 3D细胞球能够模拟实体瘤独特的ECM微环境,降低药物扩散速度,细胞间相互作用增强,所形成的致密结构使药物不能大量进入球体内部,导致3D肿瘤微组织总体内吞药物较2D培养少,差异有统计学意义,因此3D培养时IC20值远大于2D培养,此时肿瘤细胞产生了耐药性。蒋乔 等[15]在构建肿瘤微组织细胞球的模型时,也发现致密结构可以降低药物扩散,促进细胞存活产生耐药。
综上所述,基于Matrigel和乳腺癌MDA-MB-231细胞共培养体外模型,可真实模拟肿瘤细胞体内生长,可作为抗肿瘤药物体外筛药模型,为药物研发和临床用药提供理论指导。使用Matrigel 3D培养MDA-MB-231体外肿瘤微组织模型,也可以为体外乳腺癌耐药性研究和信号通路机制研究提供研究模型。
(致谢:感谢刘端祺教授在论文的撰写与修改方面提出的宝贵建议。)

