四溴双酚A对日本虎斑猛水蚤生殖的影响❋
王 超, 朱丽岩, 卜亚谦, 董辉辉, 王 腾, 陈 香
(中国海洋大学海洋生命学院,山东 青岛 266003)
四溴双酚A(TBBPA)是产量最高的溴系阻燃剂,约占据了全球阻燃剂市场的60%,被广泛用于各类型工业品和消费品生产中[1-3]。四溴双酚A及其衍生物可通过正常的生产、使用和处置等途径进入环境中[1]。目前在世界各地(包括北极地区[4])的空气、灰尘、土壤、水、沉积物和生物样本,甚至是人体组织样本中均检测到TBBPA的存在[5],国际癌症研究机构已将其划为2A级可能致癌物[6]。已有研究表明:TBBPA具有生殖毒性,浓度高于1.5 mol/L便能导致斑马鱼早熟卵母细胞增多,产卵率、孵化率和仔鱼成活率下降[7];TBBPA具有甲状腺干扰效应,能引起大鼠甲状腺动态失衡对其内分泌产生干扰[8];TBBPA具有细胞毒性,能干扰哺乳动物细胞信号转导通路,使细胞存活率显著降低[9],甚至能通过诱导组织产生活性氧而引起水生生物的氧化胁迫[10]。此外,TBBPA还具有神经毒性、免疫毒性、雌激素干扰效应等[11]。TBBPA作为一种持久性的环境内分泌干扰物,将会对长期暴露其中的有机体造成不可忽视的危害。
桡足类是海洋浮游动物类群的重要组成部分,对海洋生态系统的物质循环和能量流动起着承上启下的关键作用。桡足类体型小、生活史短、繁殖能力强,是理想的实验模式生物。其中日本虎斑猛水蚤在我国近海及潮间带分布广泛,性别差异明显,为杂食性动物,且对环境波动耐受性较强,比其他桡足类更易于在实验室存活,利于进行实验室驯化培养[12]。
当前的TBBPA毒性研究主要集中于鱼类或啮齿类动物,对桡足类的生殖毒性报道相对较少,因此本研究选取日本虎斑猛水蚤为实验对象,运用实验生态学方法、组织切片技术和透射电子显微镜技术,观察了TBBPA暴露下其生殖指标、卵巢组织结构和卵母细胞超微结构的变化,旨在个体、组织和细胞三个层面探讨TBBPA对日本虎斑猛水蚤生殖的影响,为进一步了解TBBPA的生殖毒性提供了参考数据。
1 材料与方法
1.1 实验材料
日本虎斑猛水蚤采自青岛汇泉湾附近海域,已在实验室经驯化培养3 a以上,培养条件:温度20 ℃、盐度30、光照12 h (L) : 12 h (D)。海水经 0.45 μm的微孔滤膜过滤并充分曝气后使用。实验饵料为5 × 104cells/ml青岛大扁藻(Platymonashelgolandica)、5×104cells/ml三角褐指藻(PhaeodactylumtricornutumBohlin)和酵母(Saccharomycescerevisiae;Anqi®,hina)2∶2∶1 的混合液。
TBBPA固体购自J&K化学试剂有限公司,以二甲亚砜(DMSO)作为助溶剂,配制浓度为10 g/L的母液,并用过滤海水将其稀释至50 mg/L备用。各实验组中DMSO所占比例均不超过0.005%[13]。
1.2 实验方法[12-14]
本实验室的急性毒性实验测得TBBPA对日本虎斑猛水蚤48h-LC50为4.423 mg/L,急性实验培养条件同上述驯化培养条件。
实验设计:根据48h-LC50值,设定4个TBBPA浓度组(分别为55.29、110.58、221.15、442.30 μg/L)和溶剂对照组(DMSO含量与最高浓度组助溶剂含量一致,为44 μL/L),每实验组设3个平行。将孵化24 h内的无节幼虫置于24孔板中,每板为一个平行组,实验条件同上。待其发育至桡足类幼体挑至6孔板中待雌体抱卵,各平行随机挑选4只抱卵雌体,进行自首次抱卵时间开始计数10 d内的生殖情况观察,记录各项生殖指标。每12 h观察一次,24 h投饵并换水50%。
组织结构观察:经TBBPA暴露20 d,在每个浓度组中随机挑选首次抱卵的正常雌体各5只,于Bouin氏液固定24 h后,常规石蜡包埋,切片厚度5 μm,H-E染色,Olympus BX53型显微镜拍照观察。
超微结构观察:经TBBPA暴露20 d,在每个浓度组中随机挑选首次抱卵的正常雌体各5只,于1.5 mL离心管中,立即加入3%戊二醛,4 ℃条件下固定24 h后,用1%锇酸进行双重固定,梯度丙酮脱水,Epon812环氧树脂包埋。包埋后的样品于LKBV超薄切片机在桡足类体长1/2处切片,醋酸铀和柠檬酸铅双重染色,日立H-700型透射电镜观察并拍照。
1.3 数据分析
采用SPSS 17.0对实验数据进行单因素方差分析(one-way ANOVA)和LSD多重比较分析。
2 实验结果
2.1 TBBPA对日本虎斑猛水蚤生殖指标的影响
2.1.1 TBBPA暴露下日本虎斑猛水蚤的首次抱卵时间 由图1知:对照组首次抱卵时间为17.16 d,由低浓度到高浓度,各组抱卵时间分别为17.99、18.28、18.84和19.23 d,与对照组相比,首次抱卵时间均受到一定程度延迟,其中221.15 μg·L-1TBBPA组差异显著(P<0.05),442.30 μg·L-1TBBPA组差异极显著(P<0.01)。与对照相比,各浓度组变态时间均延迟,且442.30 μg·L-1TBBPA组差异显著(P<0.05);而各浓度组成熟时间均无显著差异(P>0.05)。
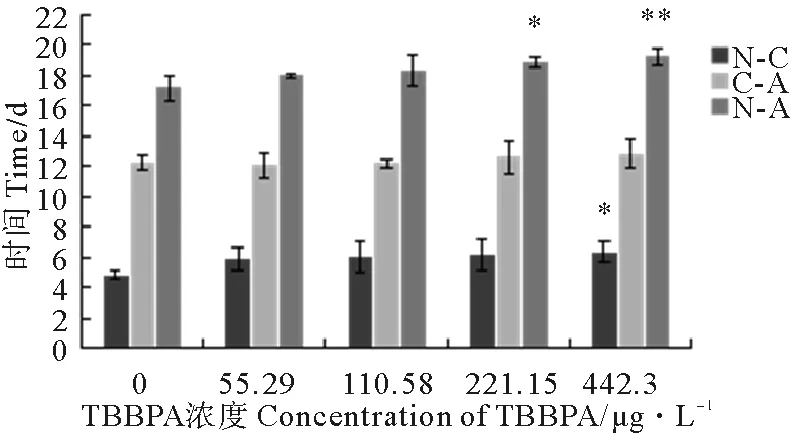
(N-A:首次抱卵时间;N-C:无节幼虫至桡足幼体的发育时间;C-A:桡足幼体至成体抱卵的成熟时间。N-A: the first spawning time, N-C: the nauplius phase, C-A: the copepodids phase.Note: *P<0.05 ,**P<0.01. )
图1 不同浓度TBBPA暴露下日本虎斑猛水蚤的首次抱卵时间
Fig.1 The first spawning time ofT.japonicusexposed to TBBPA
2.1.2 TBBPA暴露下日本虎斑猛水蚤的性别比 对照组日本虎斑猛水蚤性别比(雌/雄)为0.73,雄性个体占优势,而各TBBPA浓度组性别比分别为0.59、1.32、1.29、1.23。与对照组相比,中高浓组日本虎斑猛水蚤性别比升高,差异显著(见图2)。
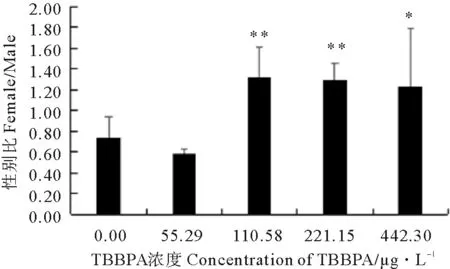
(* P<0.05 , ** P<0.01)图2 不同浓度TBBPA暴露下日本虎斑猛水蚤的性别比Fig.2 The sex ratio of T. japonicus exposed to TBBPA
2.1.3 TBBPA暴露下日本虎斑猛水蚤的卵囊发育时间,抱卵次数和产卵量 不同浓度TBBPA暴露下,自日本虎斑猛水蚤首次抱卵时间开始计数10天内,各浓度组抱卵次数和卵囊发育时间,与对照组相比均无统计学上的显著差异。就生殖力而言,对照组日本虎斑猛水蚤产卵量为74.44 eggs·female-1,而55.29 μg·L-1TBBPA组雌体生殖力显著升高(P<0.05),为98.67 eggs·female-1,其余各组生殖力均无显著性差异(P>0.05)(见表1)。
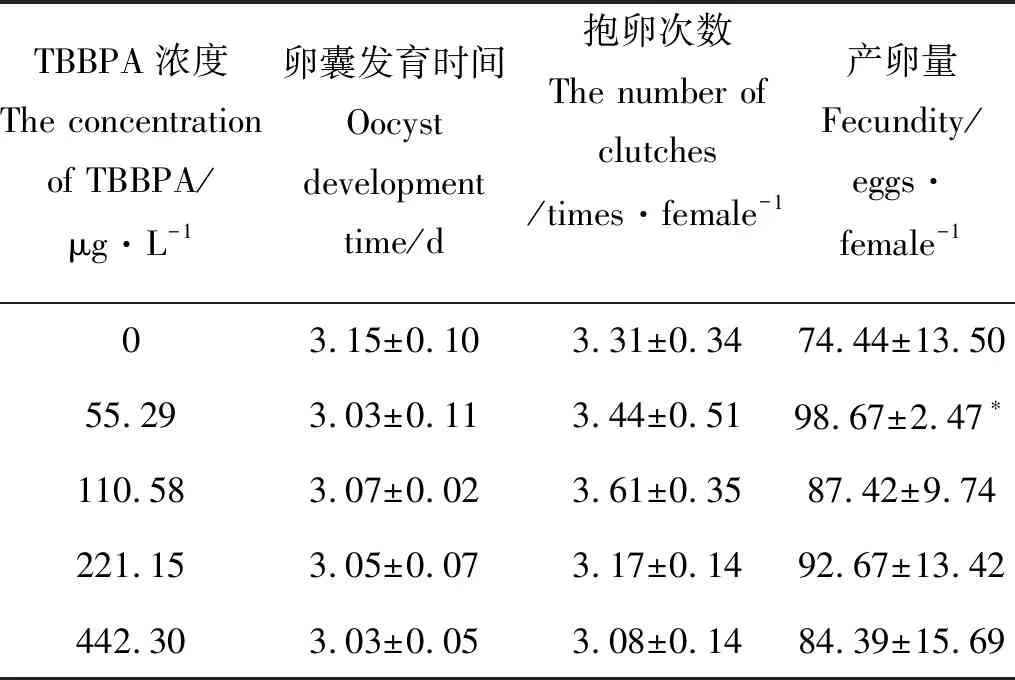
表1 不同浓度TBBPA暴露下日本虎斑猛水蚤的 卵囊发育时间、抱卵次数及产卵量Table1 The oocyst development time, number of clutches and fecundity of T. japonicus measured over 10 days
Note: *P<0.05.
2.2 TBBPA对日本虎斑猛水蚤卵巢组织结构和卵母细胞超微结构的影响
2.2.1 TBBPA暴露下日本虎斑猛水蚤的卵巢组织结构 对日本虎斑猛水蚤卵巢的组织切片观察发现:对照组日本虎斑猛水蚤卵巢中,卵母细胞形态完整,细胞排列紧密;细胞质分布均匀;细胞核位于细胞中央,核膜清晰,卵黄合成位点围绕细胞核分布、清晰可见。与对照相比,各TBBPA组中卵巢组织结构良好,未见显著异常现象(见图3)。
2.2.2 TBBPA暴露下日本虎斑猛水蚤卵母细胞的超微结构 日本虎斑猛水蚤卵母细胞超微结构如图4所示。对照组中,卵母细胞内线粒体和卵黄颗粒结构完整,且数量较多。与对照组相比,55.29 μg·L-1组中,日本虎斑猛水蚤卵母细胞超微结构完整,无显著差异。110.58 μg·L-1组中,卵母细胞内线粒体和卵黄结构基本完整,较少部分线粒体內嵴断裂。221.15 μg·L-1组中,线粒体内嵴断裂溶解增加,个别线粒体囊泡化;少部分卵黄膜溶解、卵黄颗粒皱缩变形。442.30 μg·L-1组中,卵母细胞内囊泡化线粒体比例增加,少数线粒体膜溶解导致线粒体解体;部分卵黄颗粒的卵黄膜溶解,此外卵黄数量较少且多为未发育完全的初级卵黄。
3 讨论
3.1 TBBPA对日本虎斑猛水蚤生殖指标的影响
桡足类从无节幼虫发育至成体首次抱卵的时间段称为首次抱卵时间。TBBPA暴露条件下,日本虎斑猛水蚤的首次抱卵时间显著延长,这可能是桡足类个体在应对不良环境时,自身能量收支失衡,用于生长发育的生物能减少造成的。有研究表明,TBBPA会影响桡足类的摄食、耗氧和排氨等生命活动,导致能量收支失衡[13-14]。桡足类雌体在首次抱卵前需经历变态发育(N-C)和性成熟发育(C-A)两个阶段。Marcial等[15]发现,日本虎斑猛水蚤的变态期和成熟期对双酚A等雌激素干扰物的影响最敏感。由结果可知,本研究中日本虎斑猛水蚤变态期发育比成熟期发育更容易受到TBBPA影响而显著延迟。Lee等[16]测定了9种污染物对日本虎斑猛水蚤不同生命指标的影响,亦发现变态时间和成熟时间敏感性较高,且变态时间更为敏感。因此推测,日本虎斑猛水蚤首次抱卵时间的延长,主要是无节幼虫变态发育期受到胁迫延长,使桡足类个体性成熟同步性降低影响交配所致。
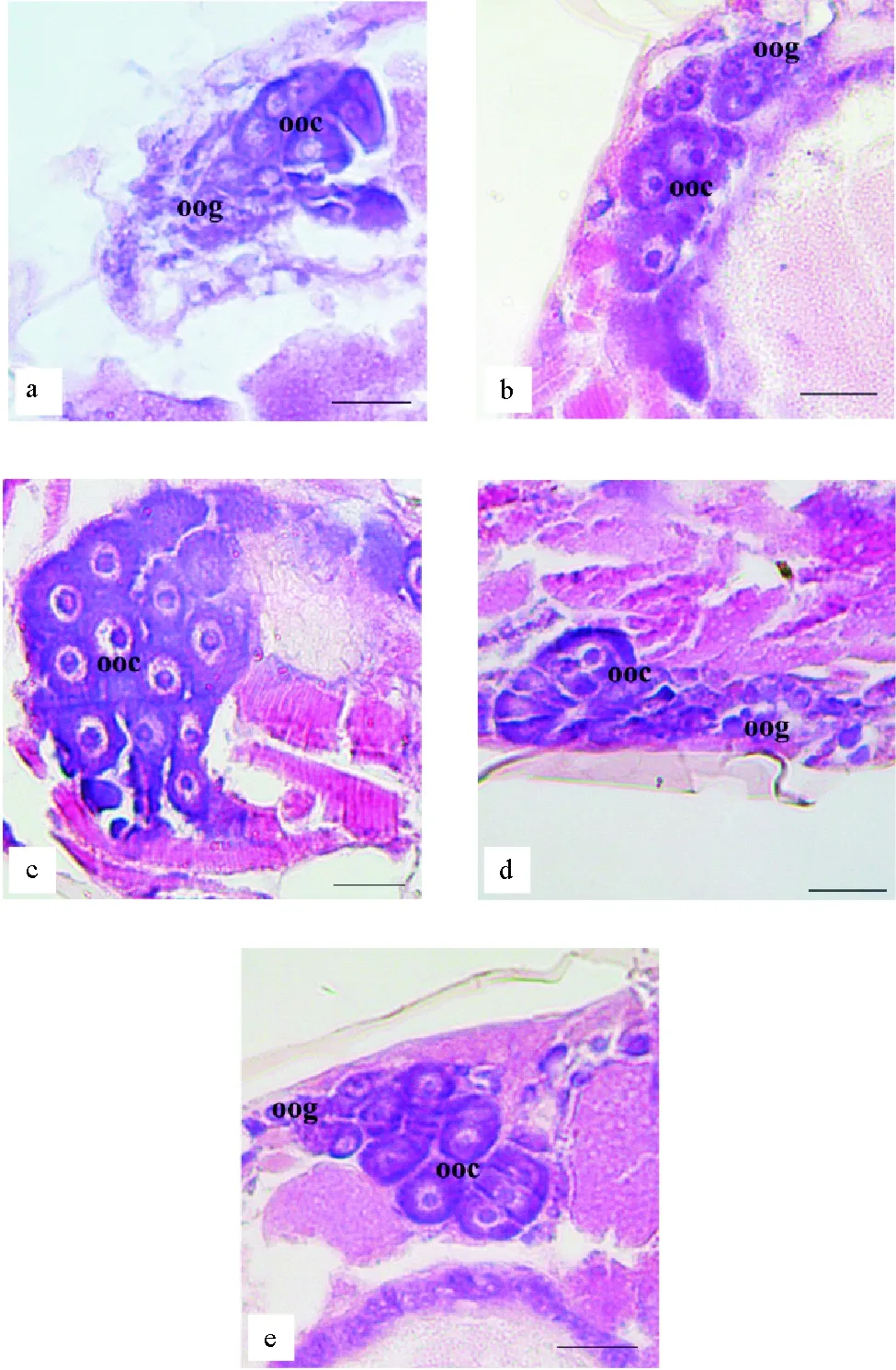
(a. 对照;b.55.29 μg·L-1;c.110.58 μg·L-1;d.221.15 μg·L-1;e.442.30 μg·L-1;oog. 卵原细胞;ooc. 卵母细胞;比例尺=50 μm。 a. control;b.cTBBPA55.29 μg·L-1;c.cTBBPA110.58 μg·L-1;d.cTBBPA221.15 μg·L-1;e.cTBBPA442.30 μg·L-1;oog. Oognium;ooc. Oocyte;Bar =50 μm.)
图3 不同浓度TBBPA暴露下日本虎斑猛水蚤的卵巢组织结构
Fig.3 The histological structure of ovary inT.japonicusexposed to TBBPA
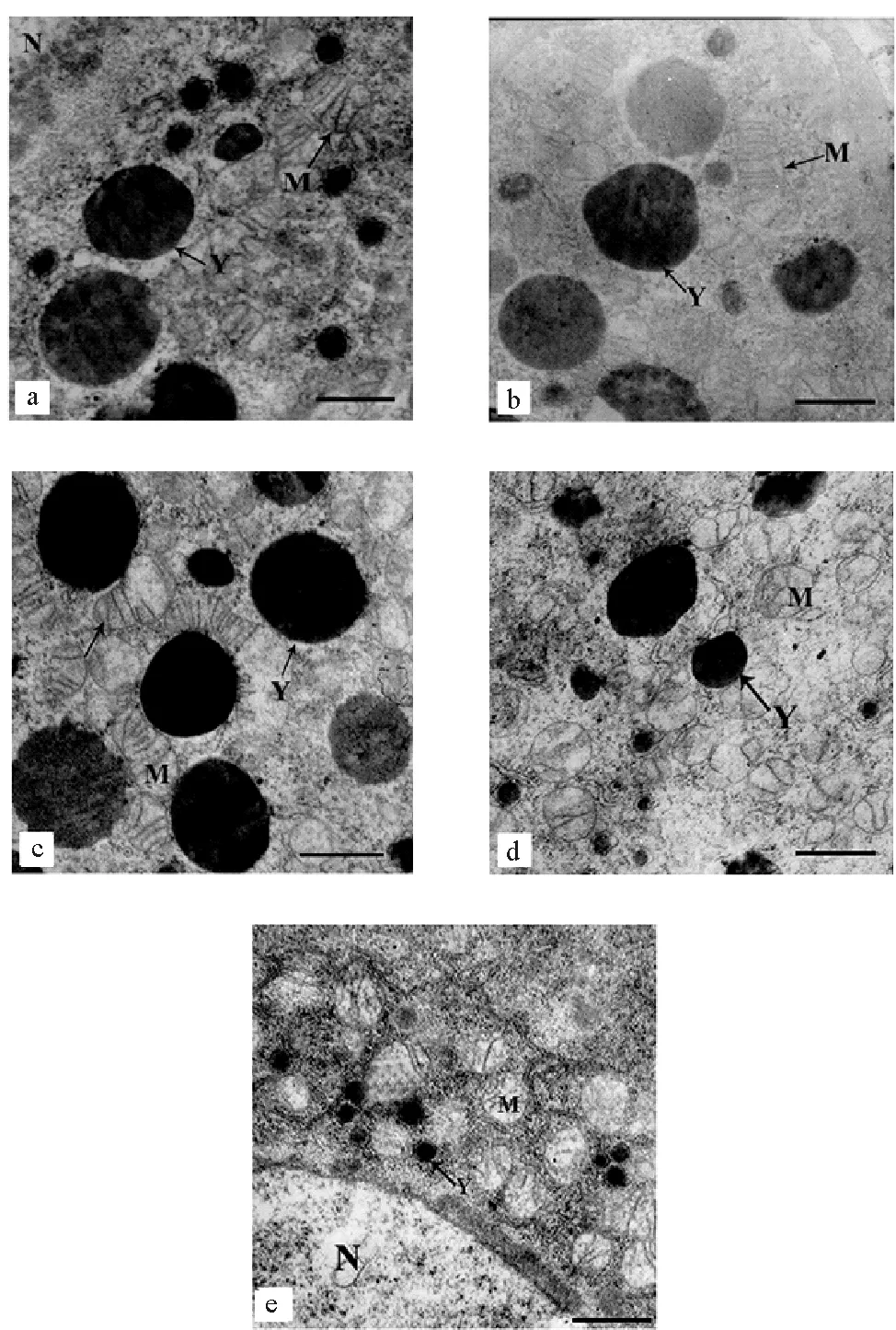
(a.对照;b.55.29 μg·L-1;c.110.58 μg·L-1;d.221.15 μg·L-1;e. 442.30 μg·L-1;M. 线粒体;Y. 卵黄颗粒;N. 细胞核;比例尺=1 μm。a. control; b.cTBBPA=55.29 μg·L-1; c.cTBBPA=110.58 μg·L-1; d.cTBBPA=221.15 μg·L-1;e.cTBBPA=442.30 μg·L-1; M. Mitochondrion; Y. Yolk granule; N. Nucleus; Bar =1 μm. )
图4 不同浓度TBBPA暴露下日本 虎斑猛水蚤卵母细胞的超微结构
Fig.4 The oocyte ultrastructure ofT.japonicusexposed to TBBPA
经不同浓度TBBPA暴露后,中高浓度组日本虎斑猛水蚤性别比显著升高,倾向雌性化。这可能有两个原因:一方面,大量研究表明暴露于胁迫条件中的桡足类,由于雌体承担了繁殖后代的责任,其耐受力高于雄性[17-19]。因此,日本虎斑猛水蚤雄性个体可能对TBBPA的毒性更敏感,更容易受到胁迫死亡,死亡率的性别差异导致性别比例失调[19]。另一方面,甲壳动物在孵化期间无法鉴定其幼虫性别,只有经过幼虫的连续蜕皮后,性别特征才能发育。Ylenia C等[20]也曾指出,一些哲水蚤种在CⅠ期间就已经出现性腺,但其性别分化直到CⅣ期才开始,且雄性第二特征只受雄性激素的控制[21],任何干扰雄性激素的因素都能阻碍雄性的分化。TBBPA具有弱的雌激素作用,因此可能在一定程度上扰乱了性别分化。随着暴露时间的延长,TBBPA终会也对桡足类雌体造成不可逆的伤害,从而不利于种群的发展。
TBBPA作用下,日本虎斑猛水蚤的卵囊发育时间有缩短的趋势。巩文静[13]的研究中也发现,18μg/L浓度的TBBPA便能显著促进指状伪镖水蚤卵囊成熟,缩短卵囊发育时间。Feng G[22]等研究了PCB126对日本虎斑猛水蚤的慢性毒性影响,发现F0代雌体超过12 d的抱卵次数均无显著差异。本研究中,各浓度组抱卵次数亦无显著差异。而经TBBPA暴露后,各浓度组日本虎斑猛水蚤的生殖力均不同程度升高,55.29 μg·L-1TBBPA组差异显著。有研究表明,生物体为了适应逆境,会对能量进行收支权衡[23],增加生殖量以掩盖死亡率,维持种群稳定[24]。由此推测,日本虎斑猛水蚤分配了更多的能量用于生殖来抵抗不良环境的胁迫,维持种群稳定,生殖力的升高弥补了发育的延迟。此外,较低浓度污染物可刺激桡足类摄食增加、代谢速度加快[25],引起产卵率增高[26],因此低浓度组生殖力显著升高。目前,TBBPA对桡足类生殖的慢性毒性研究还相对较少,尤其是低剂量长期暴露条件下的影响,可通过多世代暴露研究TBBPA的生殖毒性机制及生物蓄积毒性。
3.2 TBBPA暴露条件下日本虎斑猛水蚤卵巢组织结构的变化
性腺的质量对生物体的繁殖至关重要[27],然而环境中的多种内分泌干扰物均能对桡足类的卵巢组织造成影响,如甲基睾丸素、来曲唑和氯化三苯基锡均能使汤氏纺锤水蚤的卵巢发生卵黄合成紊乱、卵细胞退化等组织学病变[28]。TBBPA同样能对动物的性腺造成影响,例如,经TBBPA暴露后斑马鱼卵巢中的卵泡发育受到抑制,精巢损伤严重[29]。不同的是,本研究中,各浓度组日本虎斑猛水蚤的卵巢组织结构与对照组相比无显著差异,这可能是取材时间较早导致。因为用于组织切片的样本均为首次抱卵24 h内的雌体,该暴露时间或许还不足以使得TBBPA的负面影响在组织层面呈现,但推测日本虎斑猛水蚤卵细胞的超微结构已有显著变化。另外,杨苏文等[30]指出相同浓度的TBBPA在组织层次上对鲫鱼的卵巢无显著影响,而雄性个体更容易受到毒害,精巢明显受损。本研究未对雄性个体的性腺进行组织切片观察,因此有必要进一步研究相同浓度TBBPA对雄性日本虎斑猛水蚤精巢组织的影响。
3.3 TBBPA暴露条件下日本虎斑猛水蚤卵母细胞超微结构的变化
结果显示,卵母细胞中出现线粒体和卵黄膜结构的溶解,卵黄颗粒发育滞后等变化,这表明TBBPA能对日本虎斑猛水蚤卵母细胞的超微结构造成损伤,阻碍卵细胞的发育。
对甲壳动物而言,卵母细胞中的线粒体主要功能是维持呼吸代谢,为卵黄发生等生理过程提供所需的能量,还直接参与内源性卵黄的形成[31-32 ]。TBBPA暴露下,部分线粒体膜结构断裂溶解、出现囊泡化、甚至解体,这可能会阻断卵母细胞的能量供应,阻碍卵黄发生过程。卵黄颗粒是卵母细胞中营养物质储备的场所,为胚胎的发育提供物质和能源,其数量、分布及组分等不仅直接影响卵子的成熟和质量,还会对后续胚胎发育造成影响[32-33]。TBBPA暴露下,较高浓度组卵黄颗粒数量略微减少且部分卵黄处于初级阶段,这说明TBBPA在一定程度上抑制了卵黄合成,卵黄发育滞后。此外个别卵黄颗粒皱缩变形、卵黄膜溶解,这将直接导致卵黄质量下降,进而阻碍卵母细胞的发育,甚至造成子代胚胎发育滞后或停止。但在卵巢组织和个体生殖层次并未表现出相应的胁迫效应,这可能因为卵母细胞中受损超微结构所占比例相对较小,不足以引起整体的显著变化。
TBBPA会诱导细胞凋亡的发生[34-37],日本虎斑猛水蚤卵母细胞内膜结构的溶解,卵黄颗粒畸形等,均是细胞凋亡的表现。研究表明,一方面,TBBPA可通过线粒体去极化及Ca2+信号失调使细胞凋亡[34],另一方面,胁迫条件可造成桡足类个体氧化损伤,体内的活性氧也可诱导细胞凋亡[31]。因此,研究TBBPA作用下线粒体、Ca2+和活性氧如何协作诱导细胞凋亡,对了解TBBPA的细胞毒性及生殖毒性具有重要意义。
综上可知,经TBBPA单世代暴露,日本虎斑猛水蚤的个体繁殖指标(首次抱卵时间、性别比和生殖力)和卵母细胞的超微结构均受到了显著影响,本研究为评估TBBPA对海洋生物的毒性效应提供了基础数据。为了更全面的了解TBBPA的生殖毒性,需进一步在分子层面研究TBBPA的作用机制。

