Wnt/β-Catenin信号通路对氧化应激损伤促进食管癌细胞凋亡的调控研究
刘振宇,黄秀婷,田晓娟,邹兵,徐龙*
(1.深圳大学总医院消化内科, 深圳 518033,2.北京大学深圳医院消化内科, 深圳 518036)
病理状态下,活性氧(ROS)可以在组织中大量产生并累积[1],积累的ROS可导致蛋白质功能障碍和DNA损伤[2,3],进而导致基因突变和细胞凋亡并形成氧化应激损伤[4]。ROS还可以作为化学信使激活信号通路,从而影响细胞增殖,分化和凋亡。Wnt信号通路是一种进化上高度保守的信号通路,在动物胚胎生长、发育及组织再生等生理过程中发挥重要作用[5]。在肿瘤的形成过程中,Wnt信号通路参与多种肿瘤的发生发展,与肿瘤细胞的运动、增殖、凋亡、分化关系密切[6]。目前已有研究表明氧化应激与Wnt信号通路相关[7,8],但是在食管癌中Wnt/β-Catenin信号通路参与氧化应激损伤的分子机制尚未明确。本研究主要通过H2O2构建食管癌细胞氧化应激模型,并对其Wnt/β-Catenin信号通路的影响和机制进行探讨。
1 材料和方法
1.1 材料
人食管癌细胞株TE-1购自中国科学院上海生命科学研究院细胞资源中心。RPMI 1640培养基(美国Hyclone),胎牛血清(美国Hyclone),HBSS缓冲液(美国Gibco),青链霉素混合液(美国Gibco),胰蛋白酶消化液(美国Gibco),H2O2(国药集团),台盼蓝染液(英潍捷基),过氧化氢酶试剂盒(CAT,南京建成),丙二醛试剂盒(MDA,南京建成),全蛋白提取试剂盒(南京凯基),蛋白上样缓冲液(碧云天),SDS-PAGE凝胶配制试剂盒(碧云天),BCA法蛋白定量试剂盒(赛默飞世尔),抗Bcl-2抗体(武汉三鹰),抗BAX抗体(武汉三鹰),抗Caspase-3抗体(Abcam),抗β-Catenin抗体(Abcam),抗Wnt5a抗体(CST),抗c-Myc抗体(CST),抗GAPDH抗体(武汉三鹰),HRP标记山羊抗兔(中杉金桥),HRP标记山羊抗小鼠(中杉金桥),蛋白Marker(赛默飞世尔)。
1.2 仪器
电热恒温水浴锅(上海菁华),二氧化碳培养箱(赛默飞世尔),台式离心机(太仓华利达),Countess II(赛默飞世尔),超声波细胞破碎仪(宁波新芝),电泳仪与转印系统(美国伯乐),分光光度计(上海精宏),酶标仪(赛默飞世尔)。
1.3 方法
1.3.1细胞培养及传代 人食管癌细胞株TE-1培养于37℃,5% CO2的培养箱中,用含有10%胎牛血清的RPMI 1640培养基培养,培养基中加入适当比例100×青链霉素混合液,使青霉素、链霉素终浓度均为100 U/mL,根据细胞的生长情况更换培养液。细胞长至85%~95%汇合度时,用0.25%的胰蛋白酶消化细胞,待细胞将脱落时,全培养基终止消化反应,1 000 rpm离心5min,弃上清液,培养基重悬细胞。
1.3.2氧化应激模型建立 75 cm2培养皿中接种5×107个细胞,细胞贴壁后分别加入终浓度为1、10、100 μmol/L H2O2处理TE-1细胞4h,构建氧化应激模型。空白组中加入等量的无菌水作为对照。
1.3.3细胞凋亡检测 分别取对照组、氧化应激模型细胞和台盼蓝染液各10 μL,混合均匀,加入到细胞计数板小室中,插入Countess II,待系统稳定后分别记录细胞总数和凋亡细胞数。取3次独立重复试验结果进行统计学分析。细胞凋亡率=(100×凋亡细胞数/细胞总数)%
1.3.4MDA和CAT检测 将对照组细胞和氧化应激模型细胞用HBSS洗3遍,细胞刮刀刮下细胞,收集到离心管中。1 000 rpm离心5 min收集细胞,并于冰水浴中超声裂解。按照试剂盒所提供的说明书,利用分光光度计检测吸光度,计算细胞内MDA和CAT的含量。
1.3.5Western blotting检测相关蛋白的表达 采用Western blotting的方法检测对照组和100 μmol/L组细胞中Bcl-2,Caspase-3,BAX,Wnt5a,β-Catenin,c-Myc的表达。HBSS缓冲液洗去多余培养基后,细胞刮刀刮下细胞,收集到EP管中。5 000 rpm离心去除多余缓冲液。按照蛋白提取试剂盒说明,加入适量蛋白裂解液和蛋白酶抑制剂。冰水浴超声1 min。10 000 rpm离心5 min后吸取上清,上清液为提取的总蛋白。利用BCA检测试剂盒对蛋白定量。按照1:5比例将蛋白样品与蛋白上样缓冲液混合,沸水浴中煮沸10 min,后插入冰中。按照凝胶配制试剂盒说明配置12%的聚丙烯酰胺凝胶。蛋白样品每个泳道上样80 μg。电泳结束后采用湿转方法转印到PVDF膜上。5%脱脂奶粉常温封闭1 h。分别加入抗体,4℃孵育过夜,第2天恢复室温后0.1%TBST摇床洗脱3次,每次10 min。按照1∶5 000比例加入二抗,室温下孵育1 h。0.1%TBST摇床洗脱3次,每次10 min。膜上滴加ECL发光液,暗室中X光片曝光,显影定影后摄片。
1.4 统计学方法
2 结果
2.1 不同浓度H2O2处理对细胞凋亡率影响
随着H2O2浓度的增加,对照组、1 μmol/L组、10 μmol/L组、100 μmol/L组的细胞凋亡率依次提高,分别为1.30%±0.67%、7.53%±1.23%、19.18%±1.91%、43.46%±1.60%,实验组的细胞凋亡率高于对照组,差异有统计学意义(P<0.05)。
2.2 MDA和CAT含量的测定
不同浓度H2O2处理TE-1细胞4 h后,MDA和CAT的含量如表1所示,与对照组相比,细胞经H2O2处理后MDA含量提高,CAT酶活力降低。表明H2O2诱导TE-1细胞氧化损伤。其中100 μmol/L组MDA含量最高,为80.77±8.43(P<0.01);100 μmol/L组CAT酶活力最低,为16.83±3.96(P<0.01);而1 μmol/L组与对照组相比,CAT酶活力无统计学差异(P>0.05)。
2.3 相关蛋白表达的检测
2.3.1氧化应激对凋亡相关蛋白表达的影响 结果见图1所示,100 μmol/L H2O2处理组和对照组相比Bcl-2蛋白表达水平明显降低,而Caspase-3,Bax蛋白表达水平明显提高(P<0.05)。
2.3.2氧化应激对Wnt/β-Catenin信号通路的影响 结果见图2所示,当对TE-1细胞进行 H2O2处理4 h后,Wnt5a,β-Catenin,c-Myc的蛋白表达水平明显降低(P<0.05)。

表1 对照组与实验组 MDA和CAT含量的测定
注:与正常对照组相比,aP<0.05,bP<0.01。
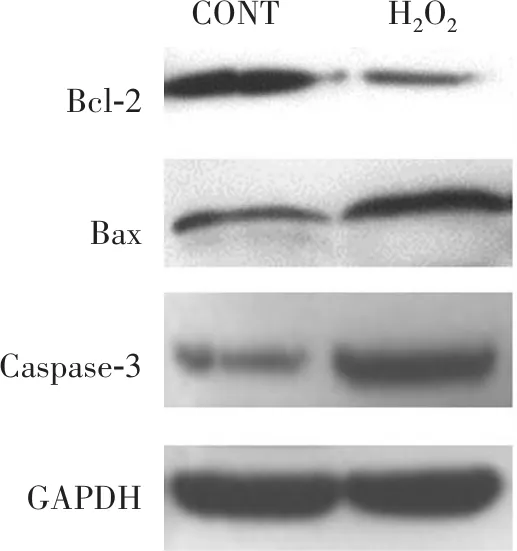
图1 H2O2处理对TE-1细胞凋亡的影响
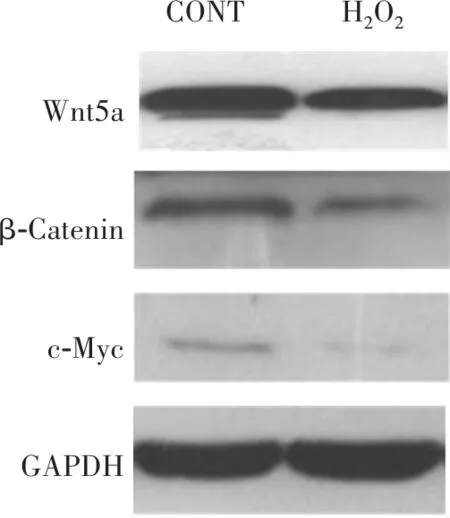
图2 H2O2处理对Wnt/β-Catenin信号通路的影响
3 讨论
现已有报道指出,细胞代谢、辐射、化疗药物等因素均可导致肿瘤细胞产生ROS并造成氧化应激[9]。氧化应激不仅可以引起肿瘤相关信号通路的异常,还会通过影响细胞的代谢活动促进肿瘤的进一步发展,因此了解氧化损伤对肿瘤细胞行为学改变以及相关机制的探讨对肿瘤治疗具有重要的意义。
在多种肿瘤细胞中,ROS水平处于异常状态[9,10]。已有研究表明,食管癌细胞中具有较高的O2-,O2-可以在体内反应生成H2O2,ROS与肿瘤细胞凋亡关系密切[11,12]。我们的研究表明,当使用H2O2诱导氧化损伤模型,食管癌TE-1细胞系的凋亡率与H2O2的浓度相关,且当发生氧化应激时,MDA含量提高。MDA的产生是由于细胞膜中氧自由基对多不饱和脂肪酸的脂质过氧化所致,因此丙二醛水平越高,氧自由基水平越高,机体组织损伤则越严重[13]。CAT酶可以催化H2O2反应生成水和氧。氧化损伤模型中,CAT酶活力降低意味着细胞清除活性氧自由基的能力降低,细胞易发生凋亡[14]。细胞凋亡往往通过Caspase依赖和非依赖途径执行,WB结果证明H2O2可以通过Caspase途径诱导细胞凋亡,并使凋亡相关因子在蛋白水平上的表达发生变化。
Wnt信号通路分为经典通路和非经典通路,其中β-Catenin依赖的Wnt信号通路是研究最深入,也是作用范围最广的。Wnt/β-Catenin信号通路参与肿瘤的增殖、凋亡、分化和细胞周期调控,β-Catenin作为这条通路里重要的转录因子通过调节信号通路下游的多个靶基因而发挥调控作用。结果显示,当食管癌细胞受到氧化损伤时,Wnt5a、β-Catenin、c-Myc蛋白表达均下降。
综上所述,H2O2可诱导食管癌TE-1细胞发生氧化应激,造成细胞凋亡,机制可能与Wnt/β-Catenin信号通路受抑制相关。

