自组装铁蛋白在纳米疫苗领域的应用进展
魏珍珍, 刘兴健, 王 朋, 张志芳, 易咏竹
1.江苏科技大学生物技术学院, 江苏 镇江 212003;2.中国农业科学院生物技术研究所, 北京 100081;3.中国农业科学院蚕业研究所, 江苏 镇江 212018
自组装蛋白在真核细胞及原核细胞中是普遍存在的,蛋白质亚基间会自发组装构成高度有序的结构,这是维持机体正常运转的保证,也是机体进化的推动力[1]。由自组装蛋白形成的纳米材料,不仅具有生物相容性良好以及粒径均一、稳定的特性,还在细胞成像、病灶检测和药物缓释等方面具有广阔的应用前景。
到目前为止,研究最多的自组装蛋白纳米颗粒包括病毒颗粒(virus particles)、血清白蛋白(serum albumin)、丝蛋白(silk protein)及铁蛋白(ferritin)。其中,病毒颗粒侵染宿主细胞并在宿主细胞内的自组装行为,是自然界中典型的生物纳米材料的形成方式,主要用于特异性检测以及病毒侵染宿主细胞的机制和路径的研究[2,3],经基因修饰后还可用于研制借助病毒释放基因的药物等方面的研究[4];血清白蛋白是脊椎动物血浆中含量最高的蛋白质,其分子的弹性良好,结构改变后也极易恢复,不同来源的血清白蛋白的空间构造均十分保守[5],在药物传递系统领域拥有潜在的应用前景[6];丝蛋白是一类线状蛋白的生物高分子材料,可抗紫外线,也可抗蛋白水解酶,其柔韧性好、抗疲劳度高,有着与钢材类似的张力强度,还具有良好的热、酸、碱稳定性和生物相容性,在生物材料[7]和药物载体[8]领域应用广泛。
而铁蛋白是存在于大多数生物体内的天然蛋白,具有独特的理化性质:①铁蛋白对pH不耐受,较为敏感,在酸性条件(pH 2.0)下铁蛋白外壳会解体成亚基,而当pH回升到生理条件(pH 7.4)时,各亚基又重组形成完整的铁蛋白[9,10];②铁蛋白的天然高级结构不受多种变性剂的影响,一般蛋白质在1~4 mol/L的低浓度盐酸胍或者脲溶液中就会发生变性,而铁蛋白在6 mol/L的盐酸胍或8 mol/L的脲溶液中才会发生蛋白质解聚,即铁蛋白对变性剂的耐受性高[11];③铁蛋白对高温具有较高的耐受性,大多数蛋白质在温度高于生理条件后极易变性,但铁蛋白在高温(70℃~80℃)时可维持10 min以上不会发生变性,且其高级结构维持完好[12]。基于铁蛋白独特的理化性质,本文主要对铁蛋白的仿生合成及其在肿瘤的诊断成像及治疗、药物载体和纳米疫苗领域的应用进展进行了综述,阐述了天然铁蛋白的结构及修饰、人工制备重组铁蛋白的研究进程,分析了重组铁蛋白在各领域中的应用,以期为研发对机体无害、适应不同生物体的新型疫苗提供参考。
1 铁蛋白的结构及其修饰
在生命体中,天然的铁蛋白主要由水合氧化铁核和蛋白质外壳2个部分组成,其结构是高度对称的,封闭的笼形结构由24个亚基组成。哺乳动物铁蛋白外壳的分子量约为480 kDa,外直径约为12 nm,可容纳约4 500个铁原子的内腔直径约为8 nm。哺乳动物机体中的铁蛋白外壳是由H亚基和L亚基组成的,但亚铁氧化酶活性中心(ferroxidase center)只存在于H亚基上[13]。许多在机体中发挥重要作用的蛋白质和辅酶的组成成分都含有铁元素;而广泛存在于机体中的铁蛋白在铁离子代谢中起着至关重要的作用,可维持铁的稳态,抵抗氧化应激;此外,铁蛋白还可以捕捉游离二价铁将其氧化并形成稳定的铁核,从而消除过量金属离子的其他毒性作用[14]。
自然界中的铁蛋白都含有铁核,其组分是水铁矿(5Fe2O3·9H2O),也可称之为全铁蛋白(holoferritin),即铁蛋白(ferritin),而不含铁内核的铁蛋白,称为去铁铁蛋白(apoferritin)。铁蛋白的球形中空结构有3个界面:内表面、外表面及亚基间接触面(图1)[15]。在对铁蛋白进行修饰改造时,其内表面可将材料包裹于铁蛋白内核,作为纳米复合材料合成的纳米反应器;外表面可连接配体,赋予铁蛋白特殊功能;亚基间接触面可通过调节溶液pH完成解聚与重组,开发铁蛋白的新功能。
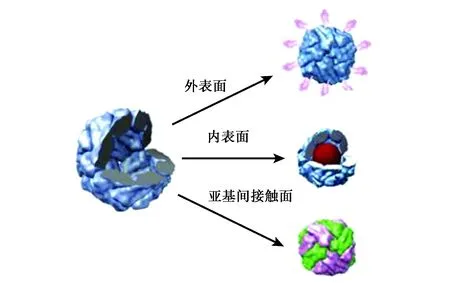
图1 可用于修饰的铁蛋白3个界面[16]Fig.1 Three interfaces of ferritin that can be used for modification[16].
2 重组铁蛋白的人工制备
随着交叉学科的快速发展、生物学与纳米技术的联用,仿生合成铁蛋白技术也逐渐得到改善。1991年,英国巴斯大学首次合成了磁性铁蛋白,他们以天然马脾铁蛋白为模板,人工除去了水铁矿(5Fe2O3·9H2O)的天然内核,并将磁性铁核在马脾铁蛋白的空腔内合成[17],这项工作开辟了一个新领域——仿生合成纳米颗粒。但这同样也存在着问题,在利用天然马脾铁蛋白外壳作为模板合成纳米颗粒前,首先要除去蛋白质内的天然水铁矿内核,而去核的过程需要利用可破坏蛋白质外壳的强还原剂处理铁蛋白,以致亚铁离子不能全部进入蛋白质外壳的内核中,而是吸附到蛋白质外壳的表面被氧化,从而导致合成的铁蛋白聚集[18]。
天然铁蛋白的自组装特性,使得在大肠杆菌中批量表达重组铁蛋白成为可能。利用大肠杆菌表达的铁蛋白亚基可以自组装形成24聚体的铁蛋白外壳,与天然铁蛋白相比,结构一致、分散性好、粒径均一,所以在不破坏铁蛋白外壳完整性的前提下,可将大肠杆菌作为优良的模式生物来仿生合成铁蛋白纳米颗粒。2006年,美国蒙大拿州立大学首次利用大肠杆菌成功获得几乎纯的铁蛋白外壳,并以这些铁蛋白外壳为模板,仿生合成了磁性铁蛋白[19]。这种新技术不仅极大地简化了分离纯化天然铁蛋白外壳的过程,而且避免了强还原剂对蛋白质外壳的破坏,保持了蛋白质外壳良好的完整性,使得整个合成过程高效且快速。值得注意的是,虽然利用大肠杆菌可仿生合成与天然铁蛋白结构相似的铁蛋白,但是二者内核晶型不同,仿生合成铁蛋白的内核为Fe3O4,具有超顺磁性,这也是仿生合成的铁蛋白被称为磁性铁蛋白的原因。
目前,已能够成功构建基于大肠杆菌的铁蛋白原核表达体系,利用IPTG诱导表达后,经过纯化、复性等步骤,即可获得与天然结构相同的铁蛋白纳米颗粒,其在生物医药领域具有广泛的应用前景[20]。
仿生合成的铁蛋白纳米颗粒与其他纳米颗粒相比,具有以下优点:①粒径小,约为12 nm,有利于其在病灶组织(如肿瘤)的渗透和积累[21];②粒径均一,在大肠杆菌中能仿生合成理想的粒径均匀且分散性良好的铁蛋白纳米颗粒;③生物相容性良好,利用大肠杆菌表达的人重组铁蛋白纳米颗粒制成的生物技术药物,应用于机体后,不易引起免疫排斥反应,对机体的毒性有较大程度的降低;④易于靶向性修饰,铁蛋白纳米颗粒在合成时可直接通过基因修饰,在外壳及亚基间接触面上修饰所需肽段等,使其成为纳米载体。
此外,仿生合成的磁性铁蛋白纳米颗粒内核为Fe3O4,具有超顺磁性和过氧化物酶活性的双功能特性。Fe3O4的内核直径在4~7 nm,具有超顺磁性,使其成为潜在的MRI造影剂[22]。而我国科学家于2007年发现,Fe3O4磁性纳米颗粒还具有过氧化物酶的活性[23],即在显色底物中含有H2O2时,Fe3O4磁性纳米颗粒可以将其催化氧化发生颜色反应。已有研究表明,铁蛋白的表达量在病变的脑组织和多种类型的肿瘤细胞中都较正常组织细胞多[24]。目前,检测脑神经退化性疾病及各种肿瘤的无创伤性的手段即为磁共振成像(magnetic resonance imaging,MRI),可以对病变组织内的铁含量进行定量检测[25]。因此,仿生合成的磁性铁蛋白纳米颗粒在病灶诊断及治疗中具有巨大的应用前景(图2)。
3 铁蛋白纳米颗粒的应用
3.1 铁蛋白纳米颗粒在药物载体领域的应用
铁蛋白纳米颗粒在药物载体领域,不仅可作为载体,同时还可作为信号分子。基于铁蛋白纳米颗粒具有的良好的生物相容性和特殊的球形空腔结构,其可成为铁氰化物、荧光素等各类小分子探针的理想载体。英国诺丁汉大学以无内核的铁蛋白外壳作为纳米材料的载体,系统地评估了铁蛋白包装对纳米材料稳定性及生物相容性的影响。实验结果表明,包装有探针的纳米颗粒不仅具有量子点优异的荧光性质,同时,还因为被铁蛋白包裹而降低了相应的毒性;通过进一步对铁蛋白外壳的修饰,包裹有量子点的铁蛋白纳米颗粒还可实现靶向细胞识别,并使得靶向过程可视[28],为后期的临床诊断及病灶组织治疗提供了重要的技术支持。
此外,铁蛋白也可作为信号分子,在生物传感器中利用其纳米材料的特性,双向放大电信号,构建一种电化学免疫检测方法。如利用金纳米颗粒与rGO-AuNPs材料修饰的玻碳电极合成AuNPs-Ab2-Ferritin复合物,通过2次免疫反应可形成AuNPs-Ab2-ferritin/Ag/Ab1/rGO-Au-chi/GC,一种特殊的夹心免疫结构,该结构能实现检测人血浆硝化铜蓝蛋白(nitrated ceruloplasmin)的目的[29]。
3.2 铁蛋白纳米颗粒在纳米疫苗领域的应用
研究人员基于铁蛋白特殊的空间结构,对其进行改造,结果表明,生物基因改造不会影响铁蛋白亚基间的自组装,而且24个亚基的基因均可进行改造,这一发现使得铁蛋白纳米颗粒成为一个疫苗开发和抗原递呈的平台[30]。2006年,美国新世纪医药公司首次利用铁蛋白外壳作为呈递抗原的疫苗研发平台,在铁蛋白L亚基的N端融合表达HIV-1病毒的Tat肽段,利用铁蛋白的自组装特性生成融合蛋白,随后进行动物免疫实验,实验结果表明,该融合蛋白在动物机体内可激起免疫应答反应[30]。2013年,美国国家卫生研究所和过敏与传染病研究所将铁蛋白应用于流感疫苗的研发,将幽门螺杆菌铁蛋白亚基的N端与流感病毒的血凝素蛋白(hemagglutinin,HA)基因融合,当铁蛋白自组装形成融合蛋白时,由蛋白核心向外伸出引入的血凝素HA,由于铁蛋白具有三重对称轴,因而可形成8个HA突起,与流感病毒表面的突起相似(图3)[32]。将该融合蛋白纳米颗粒作为抗原进行动物免疫实验,在动物体内成功诱导了中和性抗体,达到了流感病毒疫苗的作用。同时,与传统灭活病毒疫苗相比,这种流感血凝素融合蛋白纳米颗粒在动物体内产生的中和性抗体水平高10倍以上,而且存在于铁蛋白表面的HA突起能特异性识别流感病毒HA三聚体蛋白的茎部和头部这2个高度保守的位点。此外,这种新型疫苗的免疫范围更广,能中和绝大多数同型病毒。通过基因修饰,铁蛋白自组装纳米颗粒还可以融合表达其他病毒抗原作为抗原递呈的制备疫苗平台,为各类动物病毒病的防治提供了较好的技术支持。

图2 可用于靶向肿瘤并使其可视化的磁性铁蛋白纳米颗粒Fig.2 Magnetic ferritin nanoparticles that can be used to target and visualize tumors.注:A:仿生合成磁性铁蛋白[26];B:磁性铁蛋白的双功能特性;C:常规免疫组化方法;D:磁性铁蛋白检测肿瘤新技术[27]。
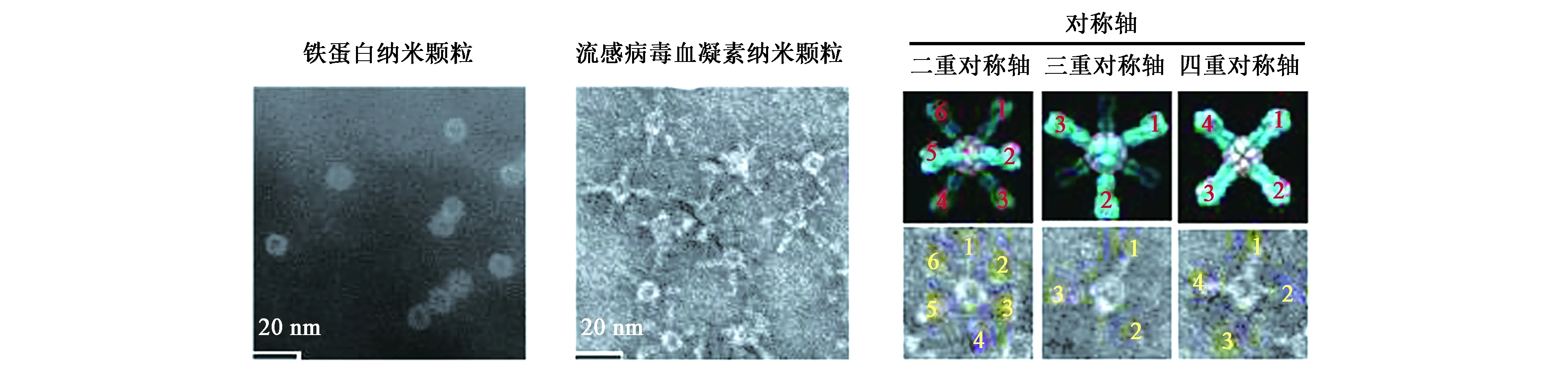
图3 流感病毒HA的铁蛋白纳米颗粒的分子设计和表征[32]Fig.3 The molecular design and characterization of ferritin nanoparticles from influenza virus HA[32].注:纳米粒子的负面染色TEM图像。1~6代表了HA尖峰在图像中的编号。
目前,在制备双组分铁蛋白纳米颗粒,即同时表达多种抗原的铁蛋白纳米颗粒方面也做了尝试(图4),纳米颗粒上的抗原多聚化可以使中和抗体响应得到改善[33]。在此研究中,设计了双组分铁蛋白变体,允许在1个颗粒上以确定的比例和几何图案黏着2种不同的抗原。双组分铁蛋白专门设计用于三聚体抗原,每个抗原接受每个颗粒4个三聚体,并用来自HIV-1包膜(Env)和流感血凝素(HA)的抗原进行测试。用具有不同Env、HA或2种抗原的双组分铁蛋白颗粒对豚鼠进行免疫,引发针对各病毒的中和抗体应答。该结果证明了铁蛋白表面可展示不只1种抗原,也提供了双组分纳米颗粒自组装原理的证据,将来可作为三聚体抗原的多聚体免疫原呈递的一般技术。此研究的成功展开,为后期新型疫苗的制备开拓了新的思路。
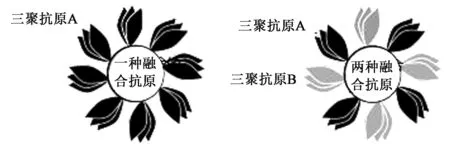
图4 双组分铁蛋白纳米粒子的设计,用于附着不同的三聚体抗原[33]Fig.4 Design of two-component ferritin nanoparticles for attachment of different trimeric antigens[33].注:单组分铁蛋白的示意图。其具有8个拷贝的三聚体抗原A(黑色)和双组分铁蛋白,每个三聚体抗原A具有4个拷贝(黑色)和B(灰色)。
相比于直接在铁蛋白表面表达抗原,也可在铁蛋白表面或者空腔内连接衍生自卵清蛋白的抗原肽OT-1(SIINFEKL)或OT-2(ISQAVHAAHAEINEAGR),然后再将重组铁蛋白作用于树突细胞,其可启动和控制抗原特异性免疫应答。树突细胞在其中起着重要作用,即将抗原内化,再加工和呈递给原始T淋巴细胞并诱导其增殖和分化为效应细胞(图5),导致抗原特异性靶细胞的选择性杀伤[21],同时,IFN-γ/IL-2和IL-10/IL-13细胞因子的产生可证实铁蛋白纳米疫苗会增强机体的免疫反应。基于树突细胞的铁蛋白纳米颗粒疫苗的开发已成为体内直接抗原特异性适应性免疫的非常有前景的一种方法。
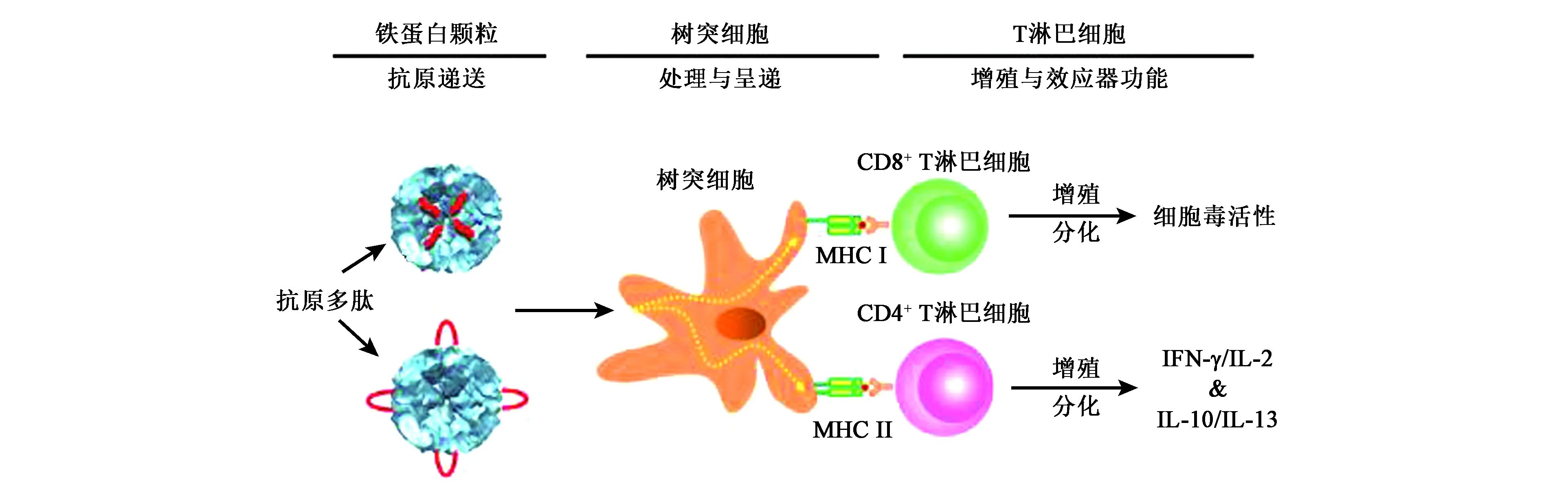
图5 携带OT肽的铁蛋白蛋白笼纳米颗粒诱导的抗原特异性T细胞增殖和随后的免疫应答[34]Fig.5 Ferroprotein protein cage nanoparticles carrying OT peptide induced antigen-specific T cell proliferation and subsequent immune response[34].
4 展望
自组装蛋白广泛存在于机体中,与其他自组装蛋白相比,自组装铁蛋白具有独特的解聚与重组方式,可耐受高热和高浓度变性剂,同时其独特的高级空间结构也便于进行基因定向修饰,可在一定程度上对修饰过程实现精准控制。通过生物手段与化学方法相结合的修饰方法,如在铁蛋白表面共价连接各类大分子,可实现特异性修饰特定位点,还可赋予铁蛋白更多新的性能,铁蛋白的应用范围也被拓宽;而通过将标记蛋白与铁蛋白亚基融合表达,使融合蛋白有序的展示在铁蛋白外壳的外表面,可提高抗体或药物等目标蛋白的载量和效率,从而作为一种潜在的新型疫苗。同时,基于铁蛋白的纳米颗粒特性,其也可作为信号分子在生物传感器中双向放大信号,构建电化学免疫检测方法,在疾病诊治方面具有广阔的应用前景。因而,实现铁蛋白的改造及修饰多功能化是未来研究的重要方向。
不过,有关自组装铁蛋白的研究仍有以下3个方面亟待深入探究:①铁蛋白的磁学性质及生理机制;②铁蛋白表面展示融合蛋白后,其具体的作用机制及通路;③目前作为抗原载体的铁蛋白多为昆虫的铁蛋白及马脾铁蛋白,其他生物体内的铁蛋白的具体分类及差异。使用从机体提取的天然无害蛋白来生产各种疫苗是值得期待的,并且生产纳米级疫苗是近期的研究重点,利用铁蛋白表面表达单种融合抗原甚至可能是多种融合抗原来生产新型疫苗必将成为未来的研究热点。

