橙子果皮诱导抗病组分对意大利青霉的抑菌活性及作用机制
彭 洋,杨书珍,张美红,程运江,彭丽桃,*
(1.华中农业大学食品科技学院,湖北 武汉 430070;2.华中农业大学园艺林学学院,湖北 武汉 430070)
我国柑橘种植面积广、品种多、资源丰富,其果实营养丰富,深受消费者欢迎[1]。但柑橘产地偏远,同时果实成熟期集中,采后极易因感染病原菌腐烂变质而降低品质,造成较大的经济损失和环境污染问题[2],其中意大利青霉(Penicillium italicum)和指状青霉(Penicillium digitatum)引起的侵染性病害最为常见[3]。
目前,柑橘采后病害防治技术主要是通过如苯并咪唑、咪鲜胺、抑霉唑、丙环唑及邻苯基苯酚钠等化学杀菌剂处理果实[4]。但长期使用化学杀菌剂会带来诸如病菌抗药性、环境污染、食用安全风险等问题[5]。因此,各国都在积极探索效果良好且对人类无潜在危害的病害控制措施,包括如采用热烫、覆膜和辐射处理等物理措施;利用通常被认为是安全的药剂如碳酸盐、壳聚糖等处理;采用微生物拮抗菌、生物活性物质和诱导自然抗性等生物防治措施,以及上述技术的综合运用[6]。其中,植物诱导抗病性这种新兴的生物防治方式已成为研究热点,其主要是利用各类诱导因子使植物产生并积累植保素类的抗病物质,从而增强植物抗病性,抵抗病原菌的侵染[7]。
本课题组前期研究发现,接种毛霉(Actinomucor elegan)能刺激脐橙组织在接种部位局部产生红色物质,在该位置再接种意大利青霉后果实不会腐烂,表明红色物质与果实抗病性密切相关[8]。本实验在制备出该物质的基础上评价其对意大利青霉的体外抑菌活性,分析其对意大利青霉细胞壁、细胞膜通透性及细胞膜和细胞质组分的影响,探讨其抑菌作用机制,以期为后续抑菌机理的深入研究及柑橘采后病害的防治提供理论依据。
1 材料与方法
1.1 材料与试剂
脐橙产自赣南,从白沙洲水果批发市场采购后运送至实验室进行相关处理。毛霉(Actinomucor elegan)由华中农业大学食品科技学院实验中心保存,马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基4 ℃保存,备用。意大利青霉购自国家菌种保藏中心,PDA培养基4 ℃保存。
甲醇(色谱纯)、二氯甲烷、石油醚、正庚烷、氯仿、浓硫酸、氢氧化钾、次氯酸钠溶液、无水乙醇国药集团化学试剂有限公司;磷酸香草醛、D-硫酸盐葡糖胺、荧光增白剂(calcofluor white,CFW) 上海甄准生物科技有限公司。
1.2 仪器与设备
旋转蒸发仪 上海爱明仪器有限公司;光学显微镜、免疫荧光显微镜(immunof l urorescence microscopy,IFM) 美国INOVA Diagnostics公司;恒温培养箱武汉德力祥仪器设备有限公司;高效液相色谱仪 日本岛津公司。
1.3 方法
1.3.1 抗病性红色物质的制备、分离及纯化
脐橙用质量分数2%次氯酸钠溶液清洗后再用清水清洗两次,晾干。对每个果实进行造伤,伤口注射20~30 μL 1h107CFU/mL毛霉孢子悬浮液,置于26 ℃生化培养箱观察培养4~5 d。将带有红色物质的果皮组织剥离,液氮研磨,冷冻保存备用。
取样品粉末,加入甲醇,超声浸提,4 ℃离心,收集上清液,重复提取两次。提取液浓缩后用石油醚除去脂溶性成分,再用二氯甲烷萃取,萃取相过C18柱后冷冻干燥得到红色物质,提取及分离纯化过程中采用高效液相色谱检测以确保所提物质为果皮红色物质。
1.3.2 意大利青霉孢子萌发及芽管伸长的测定
参考柳丽梅等[9]的方法,取红色物质溶液(体积分数20%甲醇溶液溶解)与培养基混匀,使培养基中红色物质的最终质量浓度分别为12.5、25、50、100、200 μg/mL,以无菌水作为空白对照(CK),将培养基涂于载玻片上,取20 μL意大利青霉孢子悬浮液,滴于凝固的含红色物质的培养基上,放在26 ℃培养箱中培养,7~8 h后观察孢子萌发情况,按式(1)、(2)计算孢子萌发率及抑制率。芽管伸长实验操作步骤同上,在26 ℃培养11~12 h后测量芽管伸长长度。

1.3.3 意大利青霉丝生长量的测定
参考Yang Shuzhen等[10]的菌饼实验方法。取适量红色物质溶液与培养基混匀,使得培养基红色物质的终质量浓度分别为25、50、100、200 μg/mL,将在PDA培养基上培养12 h的意大利青霉用打孔器打出直径5 mm的菌饼,将菌饼反贴在含红色物质的培养基上,每个培养皿贴3 块,26 ℃培养,每24 h测量菌斑直径。
菌丝生长量测定参考Dikbas等[11]的方法。将孢子悬浮液加入马铃薯-葡萄糖肉汤(potato-dextrose broth,PDB)培养基中,封口、摇匀,于恒温振荡培养箱中125 r/min、28 ℃培养24 h。将菌丝过滤,除去多余水分后用无菌水冲洗两次,称取3 g湿菌丝,分别加入红色物质质量浓度为25、50、100、200 μg/mL的PDB培养基中,以无菌水作为空白对照(CK),继续培养48 h。4 层纱布过滤菌丝,蒸馏水冲洗3 次,滤干表面水分后冷冻干燥,记录菌丝干质量。
1.3.4 CFW染色观察几丁质转移现象
参考Viragh等[12]的方法进行CFW染色,将意大利青霉孢子悬浮液分别涂布于红色物质质量浓度为50、100 μg/mL的25 mL PDA平板上,以无菌水作为空白对照(CK),斜插无菌盖玻片后封口,26 ℃倒置培养2 d,取出长有菌丝的盖玻片,置于洁净的载玻片上,滴加足量CFW染液和质量分数10% KOH溶液混合液(现配现用)充分浸润菌丝,室温染色1 min,蒸馏水洗去多余染液,IFM观察,紫外光激发,菌丝细胞壁呈蓝色荧光。实验重复3 次。
1.3.5 几丁质含量的测定
参考Viragh[12]和Stalhberger[13]等的方法。将意大利青霉孢子悬浮液接种于PDB培养基中,加入适量红色物质溶液,控制最终质量浓度为50、100、200 μg/mL,以无菌水作空白对照(CK),26 ℃、125 r/min振荡培养48 h,4 层纱布过滤菌丝,磷酸盐缓冲液(phosphate buffered saline,PBS)冲洗2 次,滤干水分。将菌丝除去蛋白质、脂质后冷冻干燥,取10 mg冻干粉末于10 mL离心管中,向各管中加0.5 mL 2 mol/L浓硫酸,沸水浴4 h充分裂解。收集裂解产物,12 000 r/min离心5 min,上清液用2 mol/L KOH调至pH 3,取100 μL加1 mL乙酰丙酮溶液,以蒸馏水为空白对照(CK),摇匀,沸水浴25 min,冷却后加1.5 mL对二甲胺基苯甲醛溶液和3.0 mL无水乙醇,摇匀,60 ℃水浴1 h,测定各样品在520 nm波长处的吸光度,用D-硫酸盐葡糖胺做标准曲线,通过标准曲线计算几丁质含量。
1.3.6 PI染色观察菌丝体细胞膜的完整性
参考Ouyang Qiuli等[14]的方法,将意大利青霉孢子悬浮液分别涂布于红色物质质量浓度为50、100 μg/mL的PDA培养基上,以无菌水作对照,斜插无菌盖玻片后封口,26 ℃倒置培养2 d,取出盖玻片,置于长有菌丝的洁净载玻片上,滴几滴50 μg/mL PI染色液(PBS配制),避光染色10 min,用蒸馏水洗去多余染色液,置于IFM下观察。
1.3.7 菌丝膜外电导率的测定
参考Tao Nengguo等[15]的方法。菌丝培养方法同1.3.5节,称取2.00 g湿菌丝于50 mL洁净离心管中,用20 mL双蒸水重悬,加入适量红色物质溶液,控制最终质量浓度为50、100、200 μg/mL,以无菌水作空白对照(CK),用电导率仪测定加入红色物质后0、30、60、90、120 min时溶液的电导率。
1.3.8 总脂质含量的测定
参考Ahmad等[16]的方法。菌丝培养方法同1.3.5节,将菌丝冷冻干燥,液氮研磨成干粉,4 ℃保存备用。精确称取0.10 g菌丝干粉于10 mL离心管中,依次加入0.8 mL蒸馏水、1 mL甲醇、2 mL氯仿,漩涡振荡,65 ℃水浴30 min,6 000hg离心,吸取全部氯仿相到另一离心管中,加入0.2 mL生理盐水,漩涡振荡后静置分层,取氯仿相到玻璃试管中,加入500 μL浓硫酸,沸水浴10 min后加入3 mL磷酸香草醛,以无菌水作空白对照(CK)。测定520 nm波长处吸光度,用胆固醇做标准曲线。
1.3.9 麦角固醇含量的测定
参考Tian Jun等[17]的方法。菌丝培养方法同1.3.5节,称取1.0 g湿菌丝于50 mL离心管中,加入4 mL质量分数25% KOH-乙醇溶液,剧烈振摇2 min后漩涡振荡1 min,85 ℃水浴4 h,再加入2 mL蒸馏水和5 mL正庚烷,漩涡振荡2 min,静置1 h至完全分层,取上层正庚烷相,采用紫外-可见分光光度计扫描溶液在230~300 nm波长范围内吸光度。
1.4 数据处理与分析
所有数据均为3 次平行实验测定的平均值,用SPSS 18.0软件进行单因素方差分析及绘图。
2 结果与分析
2.1 抗病性红色物质对意大利青霉孢子萌发及芽管伸长的影响
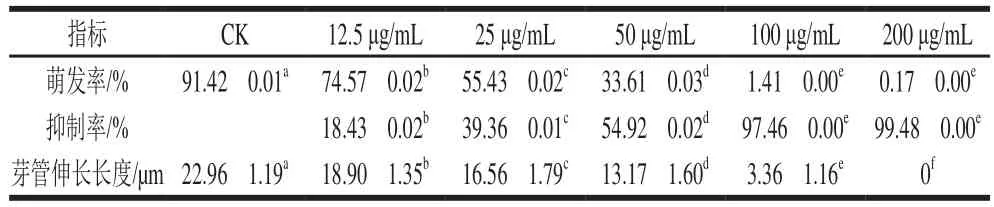
表1 红色物质对意大利青霉孢子萌发和芽管伸长的影响Table1 Effects of the red substances on spore germination and germ tube elongation of Penicillium italicum
由表1可看出,红色物质能够抑制意大利青霉孢子萌发和芽管伸长,且都呈现明显的剂量-效应关系(P<0.05)。红色物质质量浓度为25、50、100 μg/mL时,孢子萌发率分别为(55.43f0.02)%、(33.61f0.03)%、(1.41f0.00)%,明显低于空白对照组(91.42f0.01)%。同样,各质量浓度处理组的芽管伸长长度也明显低于空白对照组((22.96f1.19)μm);当红色物质质量浓度达到200 μg/mL时孢子无法长出芽管。
2.2 抗病性红色物质对意大利青霉菌丝生长的影响
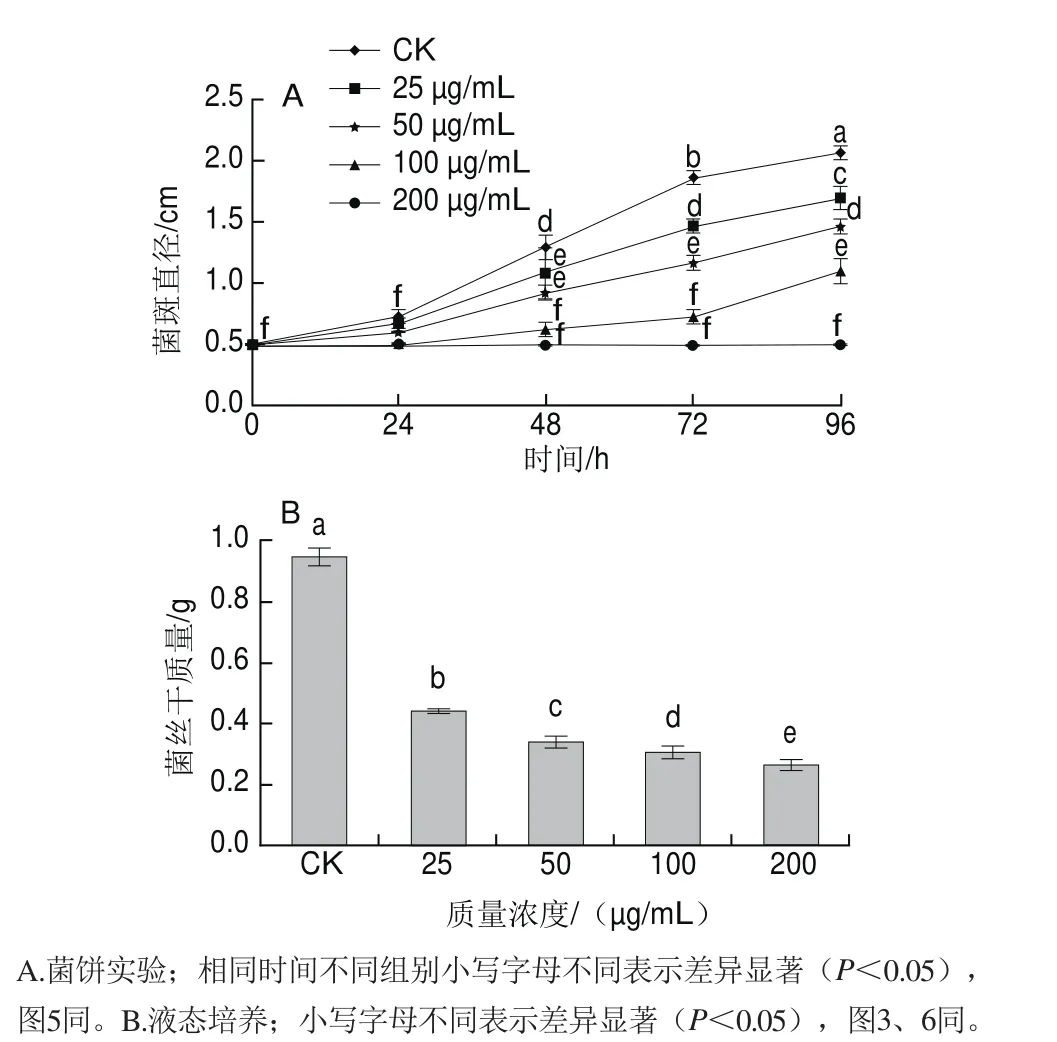
图1 红色物质对意大利青霉菌丝生长的影响Fig.1 Effect of the red substances on mycelial growth of Penicillium italicum
意大利青霉的菌丝体生长受到红色物质的剂量依赖性影响(图1A),培养初期菌斑直径增长显著,但在培养48 h后处理组的菌斑直径均明显小于空白对照组;而质量浓度为200 μg/mL时,直到培养的第4天仍能完全抑制意大利青霉菌丝的生长。图1B为液态培养后去除初始菌丝质量的菌丝干质量。经液态培养后,不同处理组的菌丝干质量都显著低于空白对照组((0.947f0.029)g),说明红色物质对意大利青霉菌丝成熟期也表现出明显抑制作用;红色物质质量浓度达到200 μg/mL时,菌丝仍有生长(干质量为(0.270f0.009)g),说明菌丝成熟期的耐药性较孢子萌发期强。
2.3 抗病性红色物质对几丁质分布的影响

图2 CFW染色观察红色物质对菌丝几丁质分布的影响Fig.2 Effect of the red substances on chitin distribution of mycelia observed by CFW staining
如图2所示,明场下观察,空白对照组菌丝粗壮、结构完整(图2A1),而处理组菌丝多分枝(图2B1),并生成分生孢子(图2C1);在暗场下观察,对照组的少部分菌丝呈微弱的蓝色荧光(图2A2),处理组菌丝则呈现强烈蓝色荧光(图2B2、C2),质量浓度越高荧光越强,且菌丝末端荧光明显弱于菌丝根部,细胞壁节间荧光强度更高,几丁质转移现象明显。
2.4 红色物质对意大利青霉菌丝细胞壁几丁质含量的影响
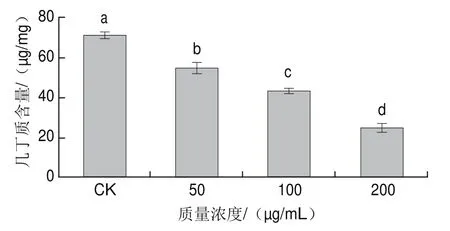
图3 红色物质对意大利青霉菌丝细胞壁几丁质含量的影响Fig.3 Effect of the red substances on chitin content of Penicillium italicum cell wall
总体来看,红色物质处理会造成意大利青霉菌丝细胞壁的几丁质含量下降(图3)。相对于空白对照组((71.017f1.928)μg/mg),红色物质质量浓度分别为25、50、100 μg/mL时,几丁质含量相应下降了22.52%、38.96%、65.26%,红色物质质量浓度与几丁质含量变化间呈现明显的剂量-效应关系。
2.5 红色物质对菌丝体细胞膜完整性的影响
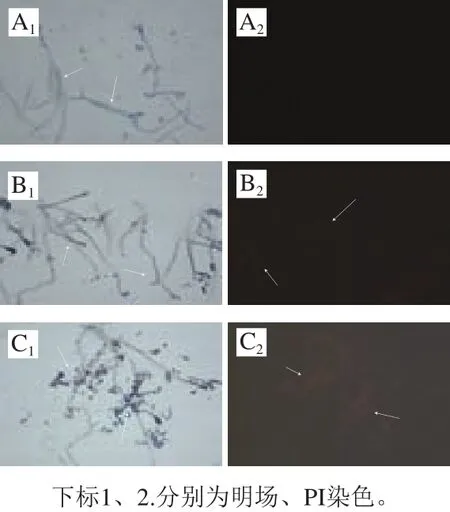
图4 意大利青霉菌丝PI染色观察细胞膜完整性Fig.4 Cell membrane integrity of Penicilicum italicum observed with PI staining
明场下观察,空白对照组菌丝长势良好(图4A1),而处理组的菌丝纤细,且在逆境生长条件下产生了分生孢子(图4B1、C1);暗场下观察,对照组菌丝基本无红色荧光(图4A2),处理组菌丝则呈现较强的荧光,且荧光强度随红色物质质量浓度的增加而增强(图4B2、C2)。
2.6 红色物质对菌丝膜外电导率的影响
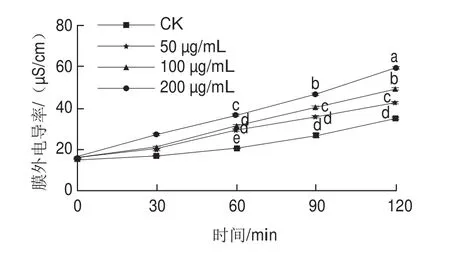
图5 红色物质对菌丝体膜外电导率的影响Fig.5 Effect of the red substances on extracellular conductivity of mycelia
如图5所示,红色物质对菌丝膜外电导率影响的剂量-效应关系显著,各组的膜外电导率都随时间变化而上升。红色物质处理60 min时,质量浓度为50、100 μg/mL处理组的膜外电导率接近,且高于空白对照组;处理时间达到120 min时,50、100、200 μg/mL处理组的膜外电导率分别为(42.53f0.89)、(49.43f0.63)、(59.37f0.78)μS/cm,显著高于空白对照组((34.64f0.79)μS/cm)。
2.7 红色物质对菌丝细胞膜总脂质含量和麦角固醇含量的影响
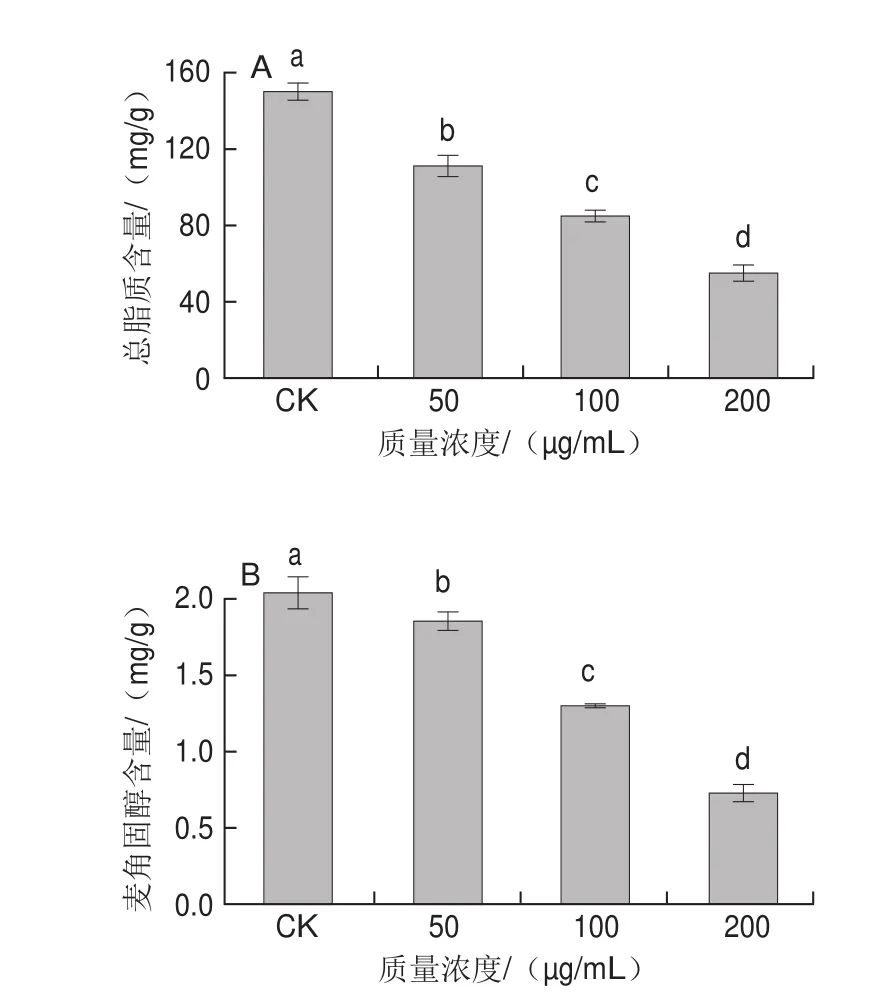
图6 红色物质对意大利青霉菌丝细胞膜总脂质含量(A)和麦角固醇含量(B)的影响Fig.6 Effect of the red substances on lipid (A) and ergosterol (B)contents in the cell membrane of mycelia of Penicillium italicus
如图6所示,随着红色物质质量浓度的增加,菌丝体的细胞膜总脂质含量逐渐降低。相对于空白对照组((149.519f4.121)mg/g),经过50、100、200 μg/mL红色物质处理的菌丝细胞膜总脂质含量分别下降了38.880、64.659、94.030 mg/g。
随着红色物质质量浓度的增加,菌丝体的细胞膜麦角固醇含量显著降低。经过100、200 μg/mL高质量浓度的红色物质处理后,菌丝的细胞膜麦角固醇含量分别为(1.291f0.025)、(0.729f0.059)mg/g,显著低于空白对照组((2.038f0.104)mg/g),而50 μg/mL红色物质处理的菌丝细胞膜麦角固醇含量下降幅度较小,为(1.845f0.056)mg/g。
3 讨 论
毛霉诱导产生的红色物质对意大利青霉的孢子萌发、芽管伸长、菌丝生长均有很强的抑制作用,且具有浓度效应,在质量浓度200 μg/mL时孢子萌发和菌丝生长几乎被完全抑制。据报道,1.0 μL/mL柠檬醛能完全抑制意大利青霉的生长[16];2.0 μL/mL松油醇对指状青霉的孢子萌发有强烈的抑制作用[18];对从Koelreuteria apiculata中分离出来的抗真菌物质2-苯乙醇进行活体实验,发现其能够抑制意大利青霉和指状青霉生长的含量为1.5 μL/mL[19]。红色物质的抗菌活性强于上述活性成分,表明其具有很强的抑菌活性,值得深入探讨其可能的抑菌作用机制。
几丁质作为丝状真菌细胞壁的主要成分,构成了细胞壁的支架结构,也常被认为是抗菌剂作用于细胞壁的靶点[20]。通过CFW染色发现几丁质转移的现象,且红色物质处理会降低菌丝的几丁质含量,这说明其能够造成细胞壁的主要成分几丁质的缺失,使细胞支架结构遭到破坏。这与D-柠檬烯对酵母菌的抑菌研究中CFW染色观察到几丁质转移现象[20]以及茴香精油的主要成分茴香脑能抑制毛霉几丁质的合成[21]等研究的结果一致。
膜通透性是常见的抗真菌剂作用靶标。荧光染料PI是一种可对DNA染色的细胞核染色试剂,其不能通过活细胞膜,但能穿过破损的细胞膜,与细胞中的DNA结合产生红色荧光[17]。IMF观察表明红色物质能够破坏意大利青霉菌丝细胞膜的完整性,这与莳萝子精油对扩展青霉的细胞膜损伤[17]及过氧化氢对构巢曲霉细胞膜损伤[22]的结论一致。红色物质对意大利青霉膜外电导率的测定结果表明,红色物质能造成细胞膜跨膜电势紊乱,导致离子外流,增加了膜通透性;这表明红色物质可攻击意大利青霉细胞膜,破坏膜通透性,造成细胞质流失,最终抑制菌丝生长。一些活性抗菌成分也有相似的抑菌作用机制,如柠檬醛精油对柑橘意大利青霉的抗菌机制[15]和莳萝子精油对黄曲霉的抗菌机制[17]可能是攻击细胞膜和破坏菌丝结构;橙花醇能够破坏葡萄黑曲霉细胞膜完整性和选择透过性[23];松油醇对指状青霉也表现出了相似的抑菌机制[24]。
细胞膜脂质含量的降低会导致脂溶性物质运输受阻和水溶性物质运输加剧,破坏细胞膜的选择透过性[25]。本研究结果表明,红色物质降低了细胞膜总脂质含量,且存在剂量-效应关系。相似的结果在柠檬醛抑制柑橘意大利青霉的研究中[16]也得到验证。作为真菌细胞膜的特有成分,麦角固醇在确保细胞膜结构的完整性与细胞膜结合酶的活性、细胞膜的流动性、细胞活力以及物质运输方面起着重要作用,且是系列抑菌成分的重要作用靶点。红色物质能够显著降低麦角固醇含量,说明其对意大利青霉细胞膜的作用靶点可能是细胞膜上的麦角固醇,能够抑制麦角固醇的生物合成。其他相关研究也有类似结果:香芹酚能够抑制白色念珠菌麦角固醇的合成[25];丁香油酚降低了红色毛藓菌细胞膜麦角固醇含量[26];紫苏醛能够抑制黑曲霉麦角固醇的合成[27];香豆素能够与曲霉细胞膜上的麦角固醇形成聚合物,导致细胞膜通透性增加,最终死亡[28]。这些结果表明,红色物质通过抑制总脂质含量和麦角固醇含量抑制意大利青霉活性。
综上所述,红色物质对意大利青霉的生长有强烈的抑制作用,可造成菌丝细胞壁成分缺失和结构改变,破坏细胞膜完整性,增加其通透性,降低细胞膜脂质含量和麦角固醇含量,具有很高的应用开发价值。后续将进一步鉴定红色物质的组成与结构,并探索其更高效的诱导机制和相应的生物学反应机制,为柑橘新型杀菌剂的研发、产业化及病害防治的实践应用提供切实可行的途径。

