增精宝对环磷酰胺致小鼠生精障碍保护作用的研究
兰新财,叶志惠,欧 彬,赵丽丽,麻军法,卢 骏
(浙江金大康动物保健品有限公司,浙江金华321016)
中医认为,雄性动物性欲下降、精液质量差是因为肝肾不足,气血亏损所致。许多补益肝肾的中药如金匮肾气丸、右归丸等均有提高性欲、改善精液质量的作用。增精宝由黄芪、山药、茯苓、车前子等组成,具有补肾填精、壮阳催情、补益气血的作用。本试验旨在利用环磷酰胺腹腔注射致炎症动物模型,进而采用增精宝灌胃给药,观察小鼠的临床表现、生长的影响,并通过精子密度和活率、精子凋亡状态、组织形态学等方法检测,探讨两种剂量浓度的增精宝对环磷酰胺导致小鼠生精障碍的保护作用。
1 材 料
1.1 试验药物 注射用环磷酰胺(由江苏恒瑞医药股份有限公司提供,规格:0.2 g,批号:HA-30-01-728)。增精宝(由浙江金大康动物保健品有限公司提供,批号:20180508,试验给药剂量定为低剂量组0.6 g/kg·b.w.,高剂量组1.8 g/kg·b.w.);本品由黄芪、山药、茯苓、车前子等8味药材,经两次水提,滤过,减压浓缩至1 mL相当于1 g原生药。
1.2 试验动物 试验动物:ICR小鼠,SPF级,雄性,8~9 周龄,动物来源:南京市江宁区青龙山动物繁殖场提供,合格证SCXK(苏)2017-0001。
1.3 试验材料 异氟醚、生理盐水、FITC Annexin V Apoptosis Detection KitⅠ(BD)、TUNEL细胞凋亡检测试剂盒(南京建成生物工程有限公司)、1%乳酸钠水溶液、丙酮酸钠、硫酸庆大霉素、酚红、人血清白蛋白、HEPES、鼠粮、垫料、小鼠笼8个、水瓶、电子称、灌胃针8号(直头、弯头)、注射器2 mL、200目尼龙网、打耳钳、手术器械、量筒、乳胶手套、烧杯、解剖器械。
2 试验方法
2.1 饲养管理 试验动物饲养于清洁、安静的环境中,环境温度控制在20 ℃左右,自然光照,饲喂鼠全价颗粒料,自由采食和饮水。试验前适应性饲养3 d,观察其健康状况,选择健康、营养状况良好的进行试验。
2.2 试验分组 40只雄性小鼠,随机分为4组,依次为空白对照组(CG)、模型组(MG)、增精宝低剂量组(SG)、增精宝高剂量组(LG)。除空白对照组外,其余小鼠腹腔注射环磷酰胺50 mg/kg,连续注射7 d,空白对照组腹腔注射等量生理盐水。空白对照组和模型组每天灌服1% 羧甲基纤维素钠0.2 mL;增精宝分别设低剂量组给予量和高剂量组给予量,各组小鼠连续给药35 d。
2.3 常规观察 分别于0(试验开始)、7、14、21、28、35、42 d每天早上于固定时间点测定各组小鼠的饮食量、饮水量、体重,观察小鼠外观、精神状态等变化情况。
2.4 睾丸指数、附睾指数、储精囊指数和前列腺指数测定 小鼠末次给药后12 h,禁食不禁水,称量体重、眼球采血后,脱颈处死,剖取睾丸、附睾、储精囊、前列腺,滤纸吸取表面残血及多余水分,称取湿重,计算睾丸指数、附睾指数、储精囊指数和前列腺指数。
2.5 小鼠精子密度及精子活率的测定 双侧附睾置于洁净培养皿中,用眼科剪沿附睾纵轴剪一刀使其分为大致均匀的2半,然后沿横轴剪2刀使附睾分为大致均匀的6段,将剪碎的附睾组织移入预置常温孵育缓冲液1 mL的试管中,然后用1 mL孵育缓冲液冲洗培养皿,冲洗液移入装附睾的试管中。
摘取睾丸和附睾后,分离输精管,于输精管与附睾尾结合部、输精管与前列腺结合部剪切离断输精管。用胰岛素注射针抽取孵育缓冲液1 mL,沿输精管一侧断端将针头插入输精管管腔内,轻推注射器,可见另一侧断端流出1~2滴乳白或灰白色液体,内含大量精子,将所得液体滴入装附睾的试管中,并用注射器中剩余孵育缓冲液冲洗输精管管腔,并将液体全部滴入装附睾的试管中。将所得精子置于37 ℃恒温孵育箱中孵育30 min备用。
精子于37 ℃恒温孵育箱中孵育30 min后,小心吸取上层液体,1500 r/min离心5 min,沉淀物加入1 mL Bww高蛋白获能液,置于37 ℃恒温孵育箱中获能2 h,取1滴滴入牛鲍氏血细胞计数板上,计算每毫升精子数,精液涂片,伊红染色,进行精子活率测定(10 μL伊红∶10 μL精子悬液,死精子头部被染成红色,活精子不着色,随机观察200个精子,计算存活率)。
2.6 小鼠睾丸各倍体生精细胞比例的影响 精子于37 ℃恒温孵育箱中孵育30 min后,小心吸取上层液体,1500 r/min离心5 min,沉淀物加入PBS液洗涤、离心、去上清液,重复洗涤2次,用冷PBS液稀释精子悬液,取1×106个精子于试管中,加PBS液洗涤、离心,管中,加入FITC-AnnexinV 10 μL和PI 0.3 μg染色,室温下避光静置15 min后加400 μL孵育缓冲液,用流式细胞仪检测精子凋亡率,结果以AV/PI表示。
2.7 小鼠睾丸组织形态学观察 取单侧睾丸石腊切片,HE染色,光镜观察睾丸组织内精原细胞与各级生精细胞的分布。
3 结果与分析
3.1 临床表现 试验过程中,各组小鼠精神状态良好,毛发顺畅,采食饮水正常,粪便干燥无异常,未观察到临床可见的异常情况。小鼠体重量逐渐增加,体毛有光泽,活动敏捷,造模中后期相互打斗明显,多数小鼠在尾部、背部可见明显伤痕。试验结束后,剖检大体检查,内脏器官均正常,未见到器官实质病变(图1~图4)。
3.2 体重的影响 试验时随机分成四组饲养并分别进行相关参数的统计。从表1可以看出,整个试验过程中两种剂量浓度的增精宝对环磷酸酰导致小鼠的增重有影响,从统计学角度来看,14、21 d期间体重差异显著(P<0.05),28 d后体重差异不显著。表明与对照组相比腹腔注射环磷酰胺导致其余三组小鼠体重增长幅度明显下降(图5)。
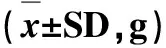
表1 对小鼠体重的影响Tab 1 Effects on body weight of mice
*与空白组差异显著(P<0.05);**与空白组差异极显著(P<0.01)
*There was a significant difference between control group*(P<0.05),**control group (P<0.01)

图1 局部解剖(从左到右:空白组、模型组、低剂量组、高剂量组)Fig 1 Local anatomy (from left to right: control group, model group, low dose group, high dose group)
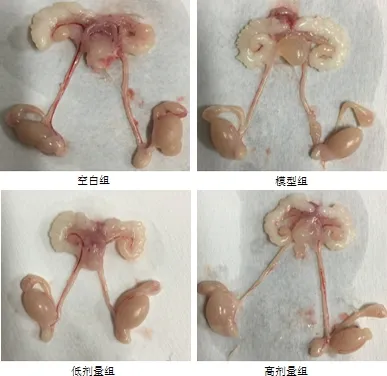
图2 生殖系统大体解剖Fig 2 General anatomy of the reproductive system
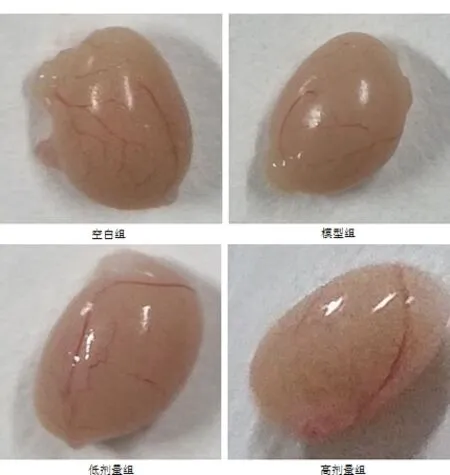
图3 四组睾丸形态大小变化Fig 3 Changes of testicular morphology and size in four groups
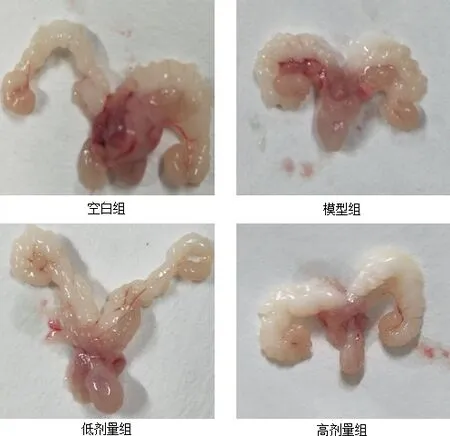
图4 四组储精囊、前列腺、膀胱形态大小变化Fig 4 Morphological and size changes of seminal vesicle, prostate and bladder in four groups
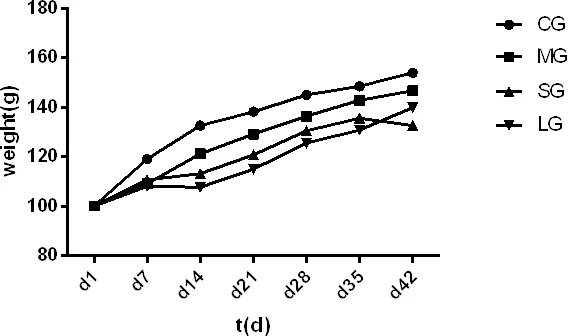
图5 小鼠体重变化趋势图Fig 5 Trend Chart of Weight Change in Mice
3.3 对器官指数的影响 将两种剂量的增精宝连续给小鼠灌胃5周后,进行剖检测定生殖器官(附睾、睾丸、储精囊和前列腺)指数,结果见表2~表3。由表可见,低剂量组与模型组对小鼠的附睾、睾丸、储精囊和前列腺的器官指数均低于空白组,但高剂量组对小鼠的附睾、睾丸、储精囊和前列腺均有较显著的促进作用,但对前列腺的影响较小。
3.4 小鼠精子密度及精子活率的测定 结果见表4。
3.5 小鼠睾丸各倍体生精细胞比例的影响(对精子行FITC-AV/ PI 染色后用流式细胞仪检测精子凋亡率) 从表5中可以看出,模型组和低剂量组小鼠精子凋亡率显著高于对照组小鼠,而高剂量组小鼠精子凋亡率与对照组小鼠无显著差异(图6)。
3.6 对小鼠睾丸组织形态学的影响 HE结果表明空白组小鼠生精小管管腔饱满,生精上皮外的界膜均匀、完整;生精上皮厚度适中,可见不同发育阶段的生精细胞及成熟的精子;管腔内可见密度适当的精子;睾丸间质细胞排列均匀,疏松结缔组织中微血管丰富;TUNEL结果表明空白组睾丸生精小管中凋亡精子数目很少,且结构特征与HE一致(图7)。
表2 对小鼠生殖器官指数的影响Tab 2 Effect on Reproductive Organ Index in Mice

表3 对小鼠生殖器官尺寸大小的影响Tab 3 Effect on the Size and Size of Reproductive Organs in Mice
*与空白组差异显著(P<0.05)
*Significant difference was found compared with control group (P<0.05)
表4 小鼠精子密度及活动能力比较Tab 4 Comparison of sperm density and motility in mice
*与空白组差异显著(P<0.05);**与空白组差异极显著(P<0.01)
*There was a significant difference compared with control group (P<0.05),**There was a significant difference compared with control group (P<0.01)

表5 精子凋亡率( ± SD)Tab 5 Sperm Apoptosis Rate
*与空白组差异显著(P<0.05);**与空白组差异极显著(P<0.01)
*There was a significant difference compared with control group (P<0.05),**There was a significant difference compared with control group (P<0.01)

图6 四组小鼠附睾精子细胞凋亡情况Fig 6 Apoptosis of Sperm Cells in Epididymis of Mice in 4 groups

图7 空白组睾丸组织(HE;TUNEL)Fig 7 Testicular tissue of blank group (HE; TUNEL)
模型组小鼠睾丸变形、塌陷的生精小管数量增多;界膜变薄,部分脱落;生精小管上皮变薄,各级生精细胞数量显著减少;管腔面精子数量显著减少甚至没有;多数生精小管可见生精细胞脱落及排列紊乱;睾丸间质细胞排列稀疏;该组睾丸生精小管稀疏,且管腔内有强阳性反应,但生精小管中精子数量极少(图8)。
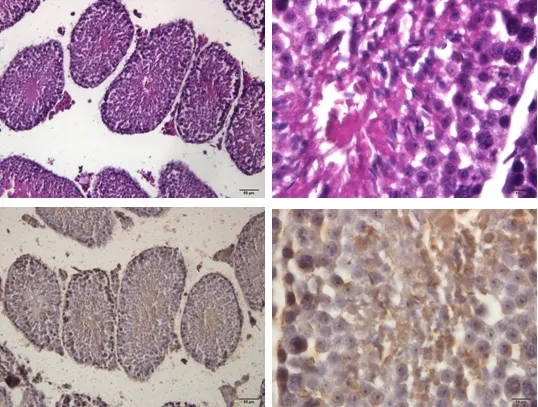
图8 模型组睾丸组织(HE;TUNEL)Fig 8 Testicular tissue of model group (HE; TUNEL)
低剂量组小鼠睾丸生精小管管腔较大,管腔内存在少量的精子,各级生精细胞数目显著减少,睾丸间质细胞排列适中;该组生精上皮呈弱阳性,管腔有部分弱阳性凋亡精子(图9)。
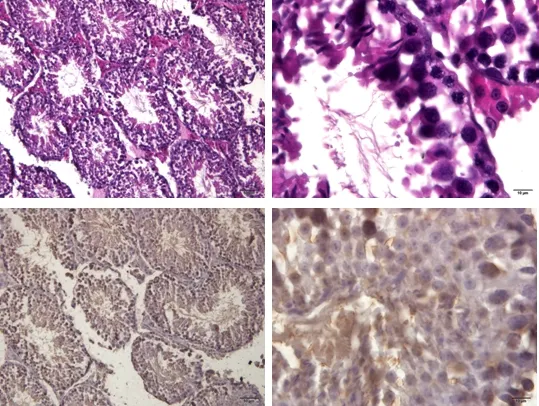
图9 低剂量组睾丸组织(HE;TUNEL)Fig 9 Testicular tissue in low dose group (HE; TUNEL)
高剂量组小鼠睾丸生精小管较为饱满,管腔内存在大量精子,生精上皮较厚,可见各级生精细胞排列整齐,界膜明显,睾丸间质细胞排列整齐;生精上皮含有部分凋亡细胞,而管腔呈阴性(图10)。
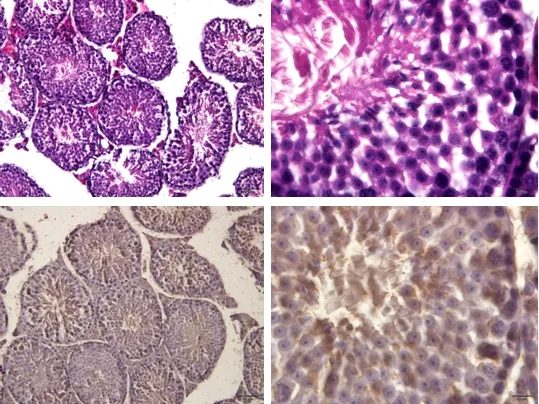
图10 高剂量组睾丸组织(HE;TUNEL)Fig 10 Testicular tissue of high dose group (HE; TUNEL)
4 讨论与结论
机体生殖系统担负着调节生命体多种生理功能的任务,对保证其正常的生理活动至关重要。雄性的生殖系统包括成对的睾丸、附睾、输精管、副性腺及单一的尿生殖道、阴茎等器官。其主要功能是产生、储存、运送精子。精子以及精液的生物学功能的破坏直接导致雄性不育的危害疾病。本研究通过腹腔注射环磷酰胺制造小鼠生精障碍动物模型,其后经灌胃增精宝研究该药物对环磷酰胺致小鼠生精障碍的治疗及保护作用。
环磷酰胺(cyclophosphamide,CP)是一种细胞毒性化疗药物,可破坏DNA结构,阻断复制,从而导致细胞死亡。因环磷酰胺具有较强的免疫抑制作用,故在免疫毒理学中是制备免疫抑制模型的常用阳性物[1-2]。
贾庆军[3]等对雄性小鼠进行腹腔注射环磷酰胺30 mg/kg药物,持续注射5 d,到第28天收集成对的附睾和睾丸,发现小鼠精子的畸形率明显升高,表明腹腔注射环磷酰胺对小鼠生精细胞具有损伤的功能。本研究结果表明,以50 mg/kg腹腔注射环磷酰胺,连续注射7 d,收集附睾液制成精子涂片发现模型组小鼠精子畸形率较高,表明造模成功,然后再以低剂量和高剂量增精宝灌胃治疗小鼠,与空白组相比,低剂量与高剂量增精宝组精子畸形率较低。
Kim等[4]每天给大鼠注射100 mg/kg环磷酰胺,连续给药56 d后检测大鼠睾丸毒性参数,发现大鼠的睾丸和附睾精子数均减少,附睾精子活力明显下降,精母细胞液泡化。这些动物实验证明环磷酰胺能够对小鼠睾丸和附睾造成一定的生殖障碍。Li等[5]和Aghaie等[6]均采用腹腔注射的给药方式给大鼠注射环磷酰胺,用两种措施即每日20 mg/kg和一次性注射100 mg/kg,均发现大鼠的睾丸相对重量、睾酮水平和附睾精子数均明显下降,因此环磷酰胺对大鼠睾丸具有较强的毒性作用。本试验中,腹腔注射环磷酰胺,连续7 d,导致小鼠体重明显低于空白组小鼠体重,随后经增精宝药物的不同剂量灌胃后模型组、低剂量组、高剂量组与空白组小鼠体重有明显差异。高剂量组对小鼠的附睾、睾丸、储精囊和前列腺的器官指数均有较显著的促进作用。
罗少波等[7]给昆明雄性小鼠腹腔注射环磷酰胺60 mg/kg,每天1次,连续5 d,在34 d对睾丸做组织病理切片进行形态学观察,发现塌陷的生精小管数量增多,上皮变薄,各级生精小管数量显著减少,管腔精子数量显著减少。并对小鼠精子进行精液常规分析,发现精子密度、活力、成活率均下降,由此可知腹腔注射环磷酰胺可增加小鼠的精子凋亡率,生精功能降低。高学勇[8]等给SD大鼠腹腔注射环磷酰胺20 mg/kg,每天1次,连续5 d,用药两个月后,用HE染色法制片观察形态,并用原位缺口末端标记法(TUNEL法)检测细胞凋亡。研究发现大鼠的生精小管直径缩小,间距增宽,生精细胞的数目减少,生精小腔内大多未见精子形成,腔内精子稀少,含有大量脱落细胞,生精细胞凋亡增多,通过TUNEL法检测发现,环磷酰胺可引起各阶段生殖细胞凋亡,但以Ⅰ-Ⅳ和Ⅺ-Ⅱ阶段的精原细胞和精母细胞最为显著。张长城等[9]腹腔注射环磷酰胺50 mg/kg于小鼠体内,每日1次,连续7 d,测定小鼠生殖器官重量、精子密度与存活率、生精细胞各倍体比例。研究表明小鼠睾丸和附睾重量明显低于正常小鼠,精子密度和存活率显著降低,精原细胞和精子细胞百分比下降,初级精母细胞显著升高,注射环磷酰胺后小鼠生殖器官重量下降,初级精母细胞和精子显著降低,影响小鼠生精能力。本实验中,对各组小鼠睾丸组织病理切片进行观察发现,空白组小鼠睾丸生精小管管腔饱满,生精上皮外的界膜均匀、完整;生精上皮厚度适中,可见不同发育阶段的生精细胞及成熟的精子;管腔内可见密度适当的精子;睾丸间质细胞排列均匀,疏松结缔组织中微血管丰富。模型组小鼠睾丸组织塌陷的生精小管数量增多,上皮变薄,各级生精小管数量显著减少,管腔精子数量显著减少;低剂量组小鼠睾丸组织排列适中,各生精小管管腔较大,内含少量精子,生精上皮较薄;高剂量组小鼠睾丸生精小管较为饱满,管腔内存在大量精子,生精上皮较厚,可见各级生精细胞排列整齐,界膜明显,睾丸间质细胞排列整齐。
环磷酰胺腹腔注射后,模型组小鼠出现精子密度、活力和活率明显下降,而精子凋亡率显著增加,与空白组小鼠相比有显著差别,与病理检查结果相符合,出现明显的少弱精症表现。另模型组小鼠在实验中还出现精神萎靡、活动减少、恶寒、体毛稀疏、无光泽等类似于中医“肾虚”的症状和体征。
环磷酰胺的生殖毒性很强,如何降低其毒性是当今热议的话题。黄威峰等[10]通过实验发现五子衍宗方可通过减少环磷酰胺造成的睾丸生殖细胞凋亡使其药物毒性降低。郭锡春等[11]发现海参精囊提取物可提高环磷酰胺所致的睾酮分泌降低,保护受损的生殖功能。杨金凤[12]发现姜黄素可通过抑制睾丸氧化损伤,提高抗氧化能力来降低环磷酰胺毒性。同时菟丝子水提取液、CMTM2、淫羊藿总黄酮等都对环磷酰胺的毒性具有拮抗作用,使其损伤减弱。
增精宝由黄芪、山药、茯苓、车前子等组成,具有补肾填精、壮阳催情、补益气血的作用,具有提高性欲、改善精液质量的作用。增精宝两种剂量均能够显著的促进环磷酰胺导致小鼠生精障碍的保护作用,高剂量组对雄性小鼠的作用尤为显著,可能与增精宝补肾填精、壮阳催情、补益气血的功效相关。
通过试验表明:对于小鼠体重的影响,14、21 d期间体重差异显著(P<0.05),28 d后体重差异不显著。表明与空白组相比腹腔注射环磷酰胺导致其余三组小鼠体重增长幅度明显下降;对于小鼠器官指数的影响,低剂量组与模型组对小鼠的附睾、睾丸、储精囊和前列腺的器官指数均低于空白组,但高剂量组对小鼠的附睾、睾丸、储精囊和前列腺均有较显著的促进作用;对于小鼠精子密度及精子活率的影响,与空白组比较,低剂量组精子总密度和精子活率均差异显著(P<0.05);高剂量组精子总密度差异不显著(P>0.05),精子活率差异显著(P<0.05);对小鼠睾丸各倍体生精细胞比例的影响,模型组和低剂量组小鼠精子凋亡率显著高于空白组小鼠,而高剂量组小鼠精子凋亡率与空白组小鼠无显著差异;对小鼠睾丸组织形态学的影响,低剂量组小鼠睾丸组织排列适中,各生精小管管腔较大,内含少量精子,生精上皮较薄;高剂量组小鼠睾丸生精小管较为饱满,管腔内存在大量精子,生精上皮较厚,可见各级生精细胞排列整齐,界膜明显,睾丸间质细胞排列整齐。
增精宝两种剂量均能够显著的促进环磷酰胺导致小鼠生精障碍的保护作用,高剂量组对雄性小鼠的作用尤为显著。这说明两种剂量的增精宝对小鼠生殖系统的调节作用受剂量的影响较大,在一个合理的剂量范围内能表现出强大的生精刺激作用。

