蛹虫草SOD高活性菌株筛选及液体培养条件优化
马婕馨,蔡程山,2,高苏,方晔晨,赵国柱*
1(北京林业大学 生物科学与技术学院,北京,100083)2(中国食品发酵工业研究院,中国工业微生物菌种保藏中心,北京,100015)
蛹虫草(Cordycepsmilitaris)又名北虫草、北冬虫夏草等,是虫草属的模式种[1],其食用与药用保健功能已被广泛关注。蛹虫草具有抗菌、消炎、抗肿瘤、抗氧化、降血脂等功效,富含虫草素、虫草酸、虫草多糖、虫草超氧化物歧化酶(superoxide dismutase,SOD)等成分[2-6]。研究表明蛹虫草在某些活性成分上,甚至要高于冬虫夏草[7-9],并且已经实现规模化人工培育[10]而常被认为是野生冬虫夏草(Ophiocordycepssinensis)的主要替代品[11-12]。因此,人工培育蛹虫草及发酵虫草菌筛选药用保健活性成分,成为虫草研究的重要方向。
SOD是一种生物活性蛋白质,可通过对细胞内超氧化物自由基的清除,帮助人体延缓衰老、对抗炎症、抵御疾病,防御由自由基过量造成的氧毒性[13],在临床[14-16]、食品[17-19]等领域已有广泛应用。传统的SOD多从动物血液里提取,需要饲养动物,技术和成本要求较高。另外,血液来源的SOD用在人体上存在着排他性、交叉感染等安全性风险,在一定程度上限制了开发应用。研究发现蛹虫草可以产生高活性的SOD[20],其菌丝体的SOD酶活力甚至高于子座的SOD酶活力[21-22]。目前市场上的蛹虫草多以食用子实体(子座)为主要形式[23],SOD的吸收、转化效率及功能难以有效发挥,以工业发酵生产方式提取SOD将成为今后发展的重要方向,并且蛹虫草液体培养还具有耗时短、易操作等优点。本研究通过筛选蛹虫草SOD高活力菌株,采用液体培养的方式优化其培养条件,为蛹虫草SOD发酵生产提供参考。
1 材料与方法
1.1 供试材料
1.1.1 供试菌株
蛹虫草菌株YCC-B为市场购买商品化蛹虫草,经分离纯化获得菌株;YCC-C为收集商品栽培菌株;YCC-W由中国科学院真菌学国家重点实验室提供;YCC-Y为采自河北秦皇岛的野生蛹虫草分离菌株。
1.1.2 试剂与仪器
马铃薯葡萄糖琼脂培养基(PDA)、蛋白胨、蔗糖、KH2PO4、MgSO4·7H2O、HCl、磷酸、无水乙醇、EDTA、牛血清白蛋白、VB1、考马斯亮蓝G-250、Tris-HCl、ddH2O、邻苯三酚,上述试剂均为分析纯:购自北京易秀博谷生物科技有限公司。
752型紫外可见分光光度计,上海舜宇恒平科学仪器有限公司;TG16A-WS离心机,上海卢湘仪离心机仪器有限公司;DHG-9626A鼓风数显干燥箱,上海精宏实验设备有限公司;HZC-250全温振荡培养箱,苏州培英实验设备有限公司;SPX-250生化培养箱,上海龙跃仪器设备有限公司;OMEGA真菌DNA小量提取试剂盒(D3390-01),北京华诚兴达科技有限公司。
1.2 菌株鉴定复核
按照真菌DNA提取试剂盒的操作步骤,提取4种来源的蛹虫草全基因组,进行ITSrDNA基因PCR扩增,通用引物:ITS1:5′-TCCGTAGGTGAACCTGCGG-3′、ITS4:5′-TCCTCCGCTTATTGATATGC-3′[24];PCR条件:94 ℃预变性10 min;94 ℃变性15 s,55 ℃退火30 s, 72 ℃延伸40 s,35个循环;72 ℃延伸7 min。PCR产物电泳检测后,送生工生物工程股份有限公司(北京测序部)测序,所得序列校对后,在NCBI中进行BLAST比对分析。
1.3 菌株发酵
1.3.1 菌株活化
将存于4 ℃冰箱的4种蛹虫草菌株分别接种于PDA斜面培养基,于21 ℃生化培养箱中避光培养至菌丝布满培养基。
1.3.2 种子液制备
用接种针从活化培养基中挑取约1cm2的菌块,接种于种子液培养基(蔗糖2%、蛋白胨2%、MgSO4·7H2O 0.05%、KH2PO40.1%),于全温振荡培养箱中培养84h,条件为装液量100 mL/250 mL三角瓶、26 ℃、130 r/min[25]。
1.3.3 液体培养
将种子液接种于基础发酵培养基(蔗糖2%、蛋白胨2%、MgSO4·7H2O 0.05%、KH2PO40.1%、维生素B10.002%),全温振荡培养箱中培养。
1.4 SOD高活性菌株筛选
1.4.1 生物量测定
将液体发酵培养物经纱布过滤,蒸馏水冲洗数次后,将获得的菌丝体于40 ℃烘干至恒重,测定菌丝体干重,以衡量其生物量大小。
1.4.2 粗酶液的提取
参考杜琳等[26]的方法,对菌丝体中的SOD进行粗提。称取0.1 g菌丝体粉末,加入1 mL PBS缓冲液超声提取10 min,4 500×g离心10 min,取上清液,在沉淀中加入1 mL PBS缓冲液再次离心,合并两次上清液,添加固体硫酸铵至质量浓度为340 g/L,9 000×g离心3 min留沉淀。加入2 mL PBS缓冲液溶液,获得粗酶液。
1.4.3 SOD清除超氧阴离子能力(清除率)和酶活力测定
采用邻苯三酚自氧化法[27]测定SOD总酶活力,在试管中依次加入缓冲液和双蒸水,与25 ℃预热的邻苯三酚(对照组用10 mmol/L HCl代替)混合,摇匀后迅速加入比色皿中,在波长420 nm处每0.5 min测定1次吸光度A0,共测4 min,计算自氧化组溶液吸光度值随时间的变化率ΔA0。样品测定:加入1 mL 样品液,相应减少同体积双蒸水,其余试剂添加同自氧化组,测定加入样品后的自氧化速率ΔA1。SOD酶活性单位定义为每分钟每毫升反应液邻苯三酚自氧化被抑制50%所需酶量为1个活力单位。按照公式(1)、(2),计算清除率和酶活力:
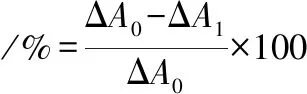
(1)
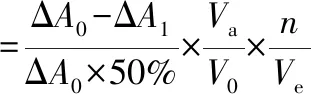
(2)
式中,ΔA0-对照管吸光度(自氧化速率);ΔA1-测定管吸光度(加入酶后的氧化速率);n-稀释倍数;V0-定义体积,1 mL;Va-反应总体积;Ve-加入酶体积。
1.4.4 SOD粗酶液蛋白含量及比活力测定
采用考马斯亮蓝法[28]绘制蛋白标准曲线并测定样品蛋白含量。编号的标准蛋白试管后加入试剂,摇匀后放置2 min,在595 nm测定吸光度,以牛血清蛋白含量(μg)为横坐标,以吸光度值为纵坐标,绘制标准曲线。另取1支试管,准确加入0.1 mL样品提取液,再加入0.9 mL蒸馏水。与5 mL考马斯亮蓝G-250试剂混匀后,放置2 min,以标准曲线0号试管作空白对照。在595 nm测定吸光度,并在标准曲线上查得相应蛋白含量。根据公式(3),计算出样品对应的比活力值。
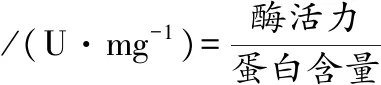
(3)
式中,酶活力,U/mL;蛋白含量,mg/mL。
1.5 液体培养条件正交实验设计
1.5.1 单因素优化
以接种量、装液量、培养基pH、温度和培养天数为单因素,按照表1依次进行优化,每个因素5个水平,每个水平重复3次,以生物量、SOD活性为测定指标,并采用SPSS 20.0统计软件进行数据处理,不同处理组间比较采用One-way ANOVA检验,确定最佳单因素水平。
1.5.2 正交实验设计
借助“正交实验设计助手Ⅱ”软件,以接种量、装液量和培养基pH为因变量,展开3因素3水平的正交实验,分别以生物量、SOD活性为测定指标,确定最佳培养条件组合。
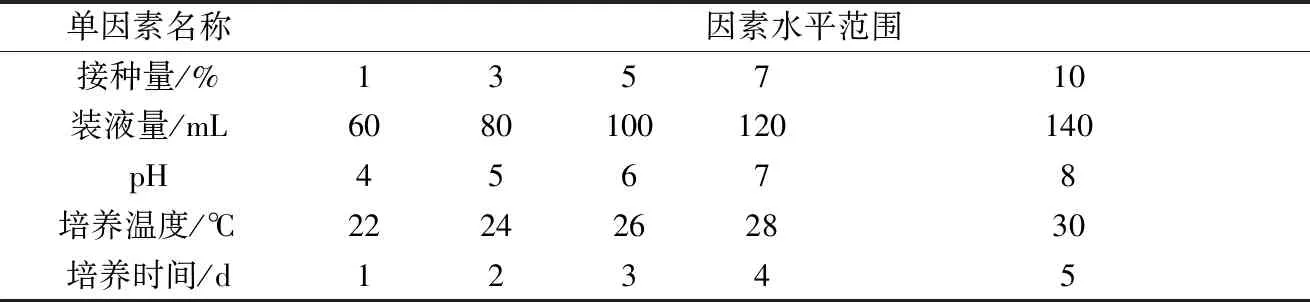
表1 液体培养条件单因素优化实验设计Table 1 Single factor optimization experiment design for liquid culture conditions
2 结果与分析
2.1 菌株鉴定结果
经生物公司测序后,所得序列于NCBI中BLAST序列比对后,复核4株菌株均为蛹虫草。
2.2 蛋白含量标准曲线
根据1.4.4方法,经计算得标准方程为y=0.005 2x+0.026 8,其中x为牛血清白蛋白质量浓度(μg/mL),y为595 nm处的吸光度值,R2=0.991 7,回归性较好,具有可信度。
2.3 SOD高产菌株筛选结果
按照1.4的方法,得到YCC-B、YCC-C、YCC-W和YCC-Y 4个菌株的生物量、SOD活力数值如图1。

图1 不同菌株的SOD活力及生物量Fig.1 SOD activity and biomass of different strains
YCC-W菌株虽然生物量值较小,但其SOD活力(清除率、酶活力、比活力)较显著优于其他3个菌株(P<0.05),因此YCC-W为SOD高活力菌株,以此展开后续研究。
2.4 菌株YCC-W单因素实验结果
2.4.1 接种量组
分别以1%、3%、5%、7%、10%的接种量将种子液接种于液体发酵培养基中,其余条件(温度26 ℃,装液量100 mL/250 mL三角瓶,pH自然,培养时间2 d,转速150 r/min)均一致,并分别设置3组平行实验。由图2可以得出,生物量随接种量增加而增加,当接种量为10%时生物量最大;接种量为3%时酶活力与比活力的值最佳,且差异显著(P<0.05)。因实验主要以SOD活性为测定指标,所以后续单因素实验选取的接种量为3%。
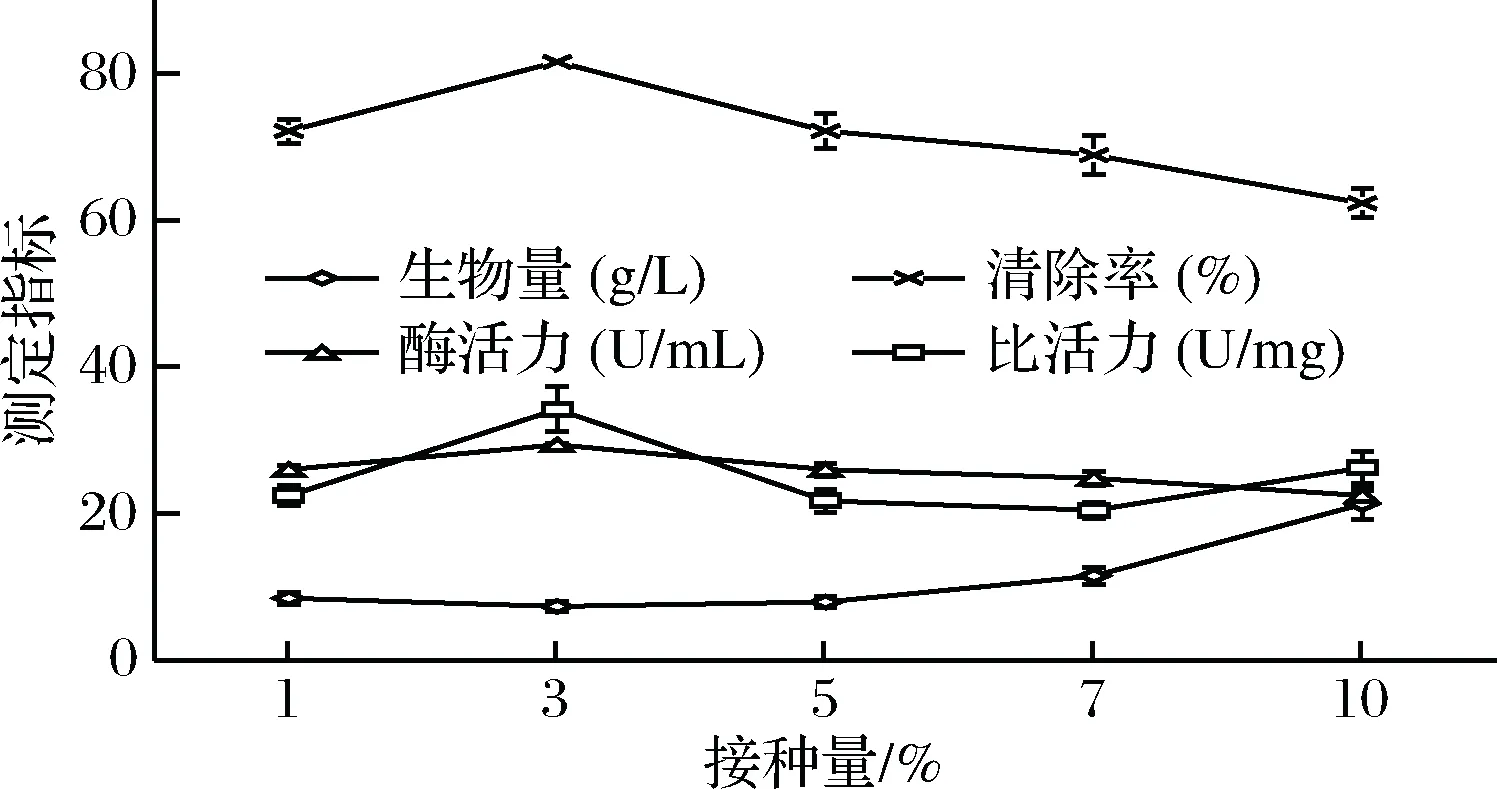
图2 菌株YCC-W在不同接种量下的SOD活性Fig.2 SOD activity of strain YCC-W in different inoculation levels
2.4.2 装液量组
以60、80、100、120、140 mL的不同装液量将液体发酵培养基分装于250 mL三角瓶中,其他条件(接种量3%,温度26 ℃,pH自然,培养时间2 d,转速150 r/min)均一致,并设置3组平行实验。由图3得,装液量为120 mL时生物量高于其他几组,而装液量为100 mL时酶活力与比活力的值最佳,且差异显著(P<0.05),后续单因素实验选取的装液量为100 mL/250 mL三角瓶。
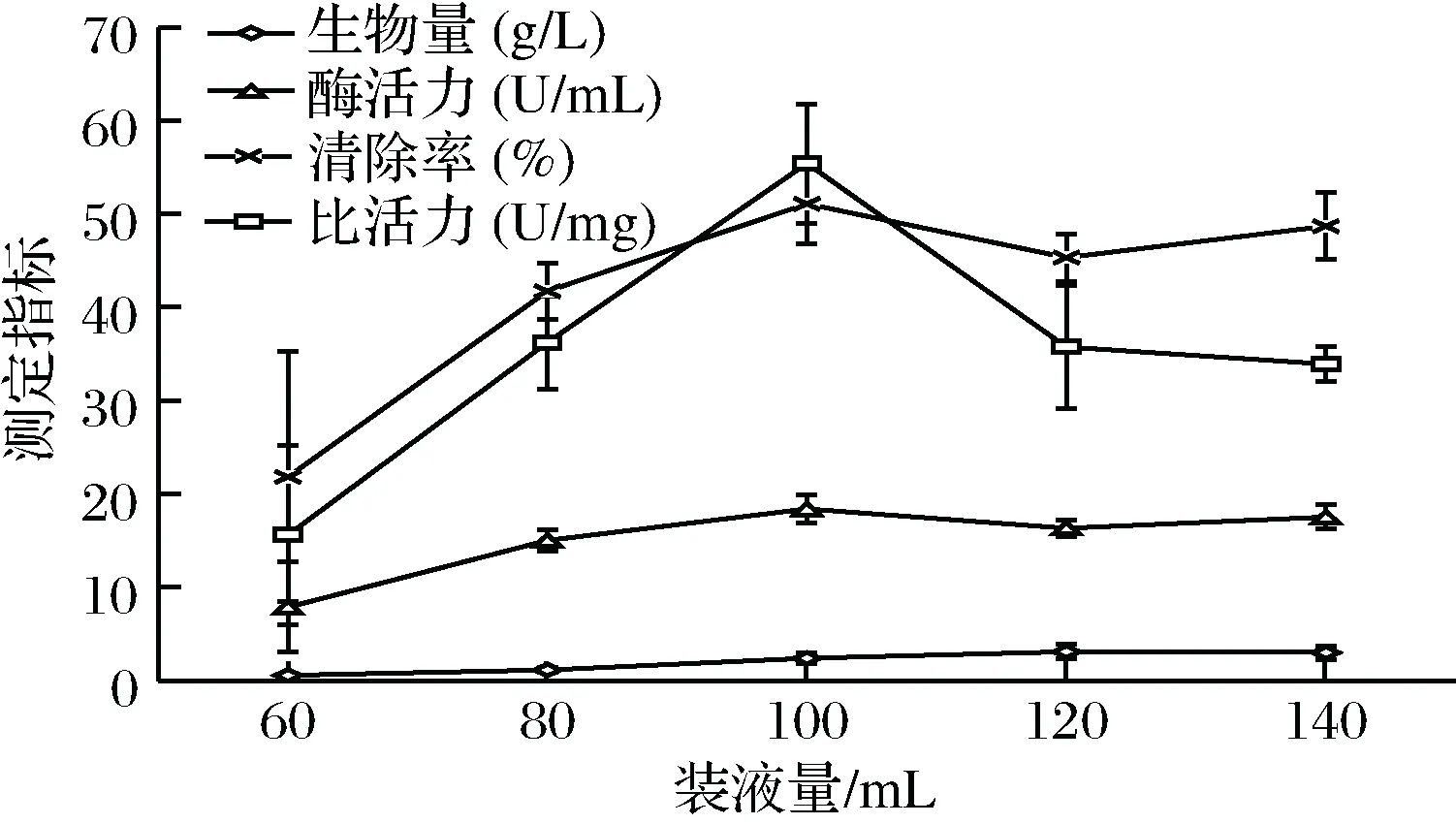
图3 菌株YCC-W在不同装液量下的SOD活性Fig.3 SOD activity of strain YCC-W in different liquid medium
2.4.3 pH值组
分别将发酵培养基的pH值调成4、5、6、7、8,其余条件(接种量3%,装液量100 mL/250 mL三角瓶,温度26 ℃,培养时间2 d,转速150 r/min)均一致,分别设置3组平行实验。由图4可以看出,pH为8时生物量最大,pH为5时酶活力与比活力值最佳,且差异显著(P<0.05),后续单因素实验选取的发酵培养基pH值为5。

图4 菌株YCC-W在不同pH下SOD活性Fig.4 SOD activity of strain YCC-W in different pH
2.4.4 培养天数组
以1、2、3、4、5 d不同时间进行培养,其余条件(接种量3%,装液量100 mL/250 mL三角瓶,pH 5,温度26 ℃,转速150 r/min)均一致,并分别设置3组平行实验。由图5可以看出,培养时间为4 d时生物量最大,培养时间为2 d时酶活力与比活力的值最佳(P<0.05)。但在培养至4 d时,菌丝体出现裂解,致使发酵液浑浊,因此后续单因素实验选取的培养时间为2 d。
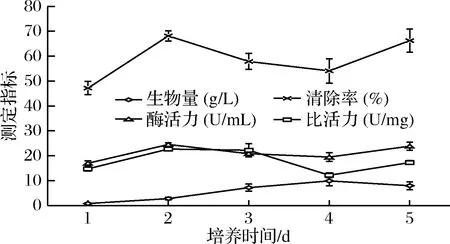
图5 菌株YCC-W在不同培养时间SOD活性Fig.5 SOD activity of strain YCC-W in different culture days
2.4.5 培养温度组
以22、24、26、28、30℃不同温度进行培养,其他条件(接种量3%,装液量100 mL/250 mL三角瓶,pH 5,培养时间2 d,转速150 r/min)均一致,分别设置3组平行实验。由图6可知,温度为24 ℃ 时酶活力与比活力的值最佳,且差异显著(P<0.05),而26 ℃时生物量最大。因此24 ℃较适合作为维持SOD高活性的培养温度。
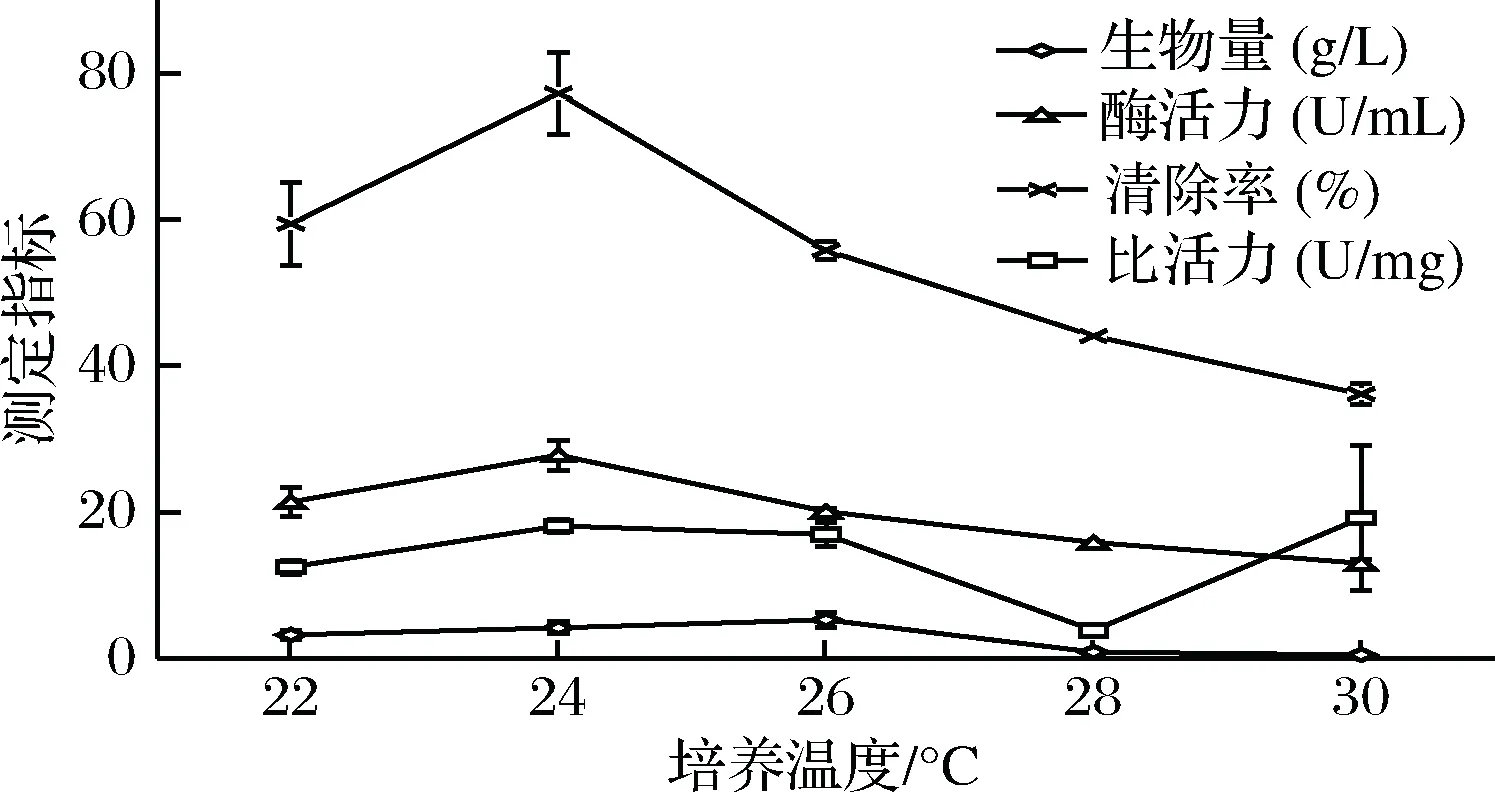
图6 菌株YCC-W在不同温度下SOD活性Fig.6 SOD activity of strain YCC-W in different temperatures
2.5 菌株YCC-W的3因素3水平正交实验设计及数据分析
经过对单因素实验数据的总结与分析,选取pH(因素A)、装液量(因素B)、接种量(因素C)这3个因素,以L9(34)正交表进行3因素3水平的正交实验设计,利用“正交设计助手Ⅱ”软件分别以SOD清除超氧阴离子能力(清除率)、酶活力、比活力和生物量为自变量进行分析,得到直观分析表(表2)和方差分析表(表3)。

表2 菌株YCC-W的3因素3水平正交实验及直观分析Table 2 Orthogonal experimental visual analysis table of YCC-W

表3 菌株YCC-W的SOD清除率方差分析Table 3 SOD clearance rate analysis of YCC-W
注:α=0.05时显著差异水平,*表示有显著差异。
从表2、表3可以看出,3个因素对SOD的清除率影响从大到小为pH>装液量>接种量,其中pH的改变对清除率有显著影响,pH为5.5时清除超氧阴离子效果最好;装液量的改变对清除率也有显著的影响,100 mL和110 mL三角瓶(250 mL)装液量的均值相等,考虑到经济成本,装液量为100 mL/250 mL三角瓶时最佳;接种量的改变则对清除率无显著影响,4%的接种量最佳。3个因素对比活力的影响从大到小为装液量> pH >接种量,但它们的改变对比活力均无显著影响。3个因素对生物量的影响从大到小为接种量> pH >装液量,而它们的改变对生物量同样均无显著影响。综合以上数据,得出蛹虫草菌丝体高SOD活性的培养条件为pH 5.5、装液量100 mL/250 mL三角瓶和接种量4%。SOD清除率最高可提高41.17%,可达到54.84%;SOD酶活力可提高42.04%,达到19.74 U/mL;比活力可提高44.23%,可达到为56.34 U/mg。
3 结论与讨论
对4种来源的蛹虫草菌株进行复核,经初步筛选,得出YCC-W菌株为高活性SOD菌株。单因素优化YCC-W菌株菌丝体SOD活性表明,当以生物量为测定指标时,接种量10%、装液量120 mL/250 mL三角瓶、pH 8、培养时间4 d、温度24 ℃为最佳,组间差异显著(P<0.05);而以SOD活性为测定指标时,接种量3%、装液量100 mL/250 mL三角瓶、pH 5、培养时间2 d、温度24 ℃为最佳,组间差异显著(P<0.05)。在单因素实验基础上,以液体发酵培养基pH、装液量和接种量为因素,展开3因素3水平正交实验,确定了蛹虫草菌丝体高SOD活性的培养条件为pH 5.5、装液量100 mL/250 mL三角瓶和接种量4%。
本研究中,当分别以菌丝体干重和活性成分SOD为测定指标时,5个单因素的最佳数值存在一定差异,说明在培养过程中菌体生物量与SOD的活性并不完全同步,在实际发酵生产中,不能只注重培养物的产量,更要重点关注特定活性成分的产生及其功效和品质。研究同时发现,SOD活性并不随生物量的改变而改变,二者似乎不具有线性关系。正交实验及方差分析,发现pH的改变对SOD活力的变化影响较大,说明蛹虫草菌丝体中的SOD对pH较敏感,高于或低于最适pH时,其活性基团的解离状态可能会发生改变,影响了酶和底物的结合力,造成SOD活力下降。
目前关于蛹虫草的优化培养研究,多注重对培养基成分的改变而忽视了培养条件(接种量、装液量、pH、培养时间、温度等)的影响。蛹虫草在培养发酵过程中,由于菌株、实验条件、培养方式、测定方法差异,其产生的活性化学成分种类、含量及药理作用可能会不同[29]。XIONG等[30]研究表明,用不同培养基培养蛹虫草菌丝体时,以及用不同基质培养子实体时,其转录表达谱都存在差异。贺佳[13]通过实验测得蛹虫草子实体中SOD粗酶液比活力为39.0 U/mg;李万芳等[20]测定北虫草中SOD粗酶液酶活力为 823.57 U/g,平均比活为 36.22 U/mg;刘晓红等[31]比较鲜蛹虫草与干蛹虫草抗氧化活性和活性物质差异发现,鲜蛹虫草子实体的SOD粗酶液比活力为50.3 U/mg,干蛹虫草为37.6 U/mg。本研究通过优化,得到的蛹虫草菌丝体SOD粗酶液比活力可达56.34 U/mg,与其他研究中子实体SOD粗酶液比活力相近甚至要高,与王奇等[21]和梁迪思等[22]的研究一致。另外,本研究发现液体培养2 d时SOD活性最高,这与子实体培养相比(一般需要50~60 d)大大缩短了收获SOD的时间。因此,在进一步蛹虫草规模化SOD发酵生产之前,对培养条件的摸索和优化是十分必要的。本研究在实验条件下完成,取得了较好的结果,进一步将结合SOD纯化实验和发酵罐扩大实验,完善规模化生产蛹虫草SOD的各种条件,为今后蛹虫草SOD的进一步研究和规模化发酵生产奠定基础。

