性早熟蟹蟹油与四种食用油组成和理化性质比较
王枫雅,林琳,陆剑锋,姜绍通
(合肥工业大学 食品与生物工程学院,安徽省农产品精深加工重点实验室,安徽 合肥,230009)
中华绒螯蟹(Eriocheirsinensis)是我国淡水渔业的重要经济养殖品种。近几年来在蟹种培育环节,一龄蟹种性早熟比例逐渐增加。蟹种性早熟是指当年个体较大(通常20 g以上)、性腺已发育成熟的蟹种。用性早熟蟹种作为成蟹销售规格偏小,价值较低[1-2]。目前对于中华绒螯蟹的性早熟研究大部分集中在其性早熟机理的探究,对其开发利用方面报道较少[3]。性早熟蟹性腺与肝胰腺发育与成熟蟹相近,其中油脂含量高达37%[4],性早熟蟹肝胰腺中多不饱和脂肪酸(PUFA)含量显著高于正常蟹,而高不饱和脂肪酸(HUPF)含量差异不大[5]。CHANG等[6]报道性早熟蟹肝胰腺中二十二碳六烯酸(DHA)和花生四烯酸(ARA)含量与成熟蟹没有明显差异。将性早熟蟹肝胰腺中油脂提取出来制成蟹油,可以有效利用性早熟蟹,提高其附加值,同时蟹油具有较高的营养价值,将其开发成为一种功能性食品,具有较好的应用前景。
本文以性早熟蟹肝胰腺为原料,从中提取出蟹油并与市售的4种食用油(花生油、大豆油、玉米油和葵花籽油)的脂肪酸组成、理化性质、α-生育酚含量及挥发性风味物质进行对比,以期全面地了解蟹油与常见食用油之间的差异,为开发和推广性早熟蟹蟹油提供参考。
1 材料与方法
1.1 原料与试剂
性早熟中华绒螯蟹:2017年11月从香涧湖(安徽省五河市)取样获得,每只约40 g。洗去蟹体表污垢后沥干,在低温环境中手动剥离螃蟹肝胰脏,迅速置于聚乙烯袋中并在-20 ℃下储存直至使用。
花生油、大豆油、玉米油、葵花籽油,购自合肥市马鞍山路家乐福超市;中性蛋白酶(5×104U/g),购自北京奥博星生物技术有限责任公司;甲醇、H2SO4、NaOH、HCl、无水Na2SO4、KOH、NaCl、乙醚、异丙醇、碘化钾硫代硫酸钠、环己烷、冰乙酸、一氯化碘、乙醇、三氯甲烷、石油醚(30~60 ℃)(分析纯),上海国药集团;正己烷、甲醇(色谱纯),上海星可高纯溶剂有限公司。
1.2 仪器与设备
高速分散均质机,上海标本模型厂;HH-2数显水浴锅,江苏金坛市环宇科学仪器厂;pH计,上海大谱仪器有限公司;台式高速冷冻离心机,上海天美生化仪器设备工程有限公司;75 μm萃取头(碳分子筛(CAR)/二甲基硅氧烷(PDMS))、手动进样手柄,德国Sigma公司;GC-MS-QP2010气质联用仪,日本岛津公司;GC7890A气相色谱仪,美国安捷伦科技公司;Waters Alliance-e2695高效液相色谱仪,美国Waters公司。
1.3 方法
1.3.1 蟹油的制备
通过水酶法制备,称取50 g螃蟹肝胰腺置于锥形瓶中,按料液比1∶5(g∶mL)加入200 mL去离子水,混匀后均质。用4 mol/L NaOH或HCl调节pH值为7,然后加入中性蛋白酶。在50 ℃水浴锅中酶解180 min,期间轻微摇动,90 ℃灭酶10 min。趁热5 000 r/min离心15 min,吸取上层红色透明粗蟹油。采用郭无瑕等的方法[7]对蟹油进行脱胶、脱酸和脱臭后,得到深红色,澄清透明的蟹油,置于冰箱-20 ℃冷冻保存。
1.3.2 理化指标测定
酸价测定参照GB 5009.229—2016 《食品中酸价的测定》;碘值测定参照GB/T 5532—2008 《动植物油脂碘值的测定》;皂化值测定参照GB/T 5534—2008 《动植物油脂皂化值的测定》;过氧化值测定参照GB 5009.227—2016 《食品中过氧化值的测定》
1.3.3 脂肪酸组成分析
1.3.3.1 样品甲酯化
称取0.5 g油脂置于具塞试管中,加入l mol/L氢氧化钾-甲醇溶液4 mL,塞上瓶塞,置于60 ℃水浴锅上皂化30 min至油珠完全消失,冷却后加入40 mL 12.5%(体积分数) 硫酸-甲醇溶液,于60 ℃水浴上酯化5 min后冷却,并移至分液漏斗中,加入蒸馏水45 mL,再加入3 mL 正己烷,振荡混匀,静置10 min,移除下层水相,加入饱和NaCl溶液4 mL洗涤3次,移取上清液,再加入1.0 g无水Na2SO4除水,4 000 r/min离心10 min,取上清液用0.22 μm微孔过滤膜过滤,待GC-MS分析。
1.3.3.2 气相色谱条件
色谱柱:DB-WAX毛细管柱(30 m×0.25 mm, 0.25 μm);检测器:火焰离子化检测器;进样口温度:230 ℃;升温程序:100 ℃保持1 min,以20 ℃/min升至200 ℃,保持1 min后,以3 ℃/min升至230 ℃,保留12 min;氮气流速0.8 mL/min;进样量1 μL;分流比10∶1。
按峰面积归一法计算油脂中不同脂肪酸的含量。
1.3.4 α-生育酚含量的测定
依据AOCS方法[8],称取各油样0.5 g,用2.5 mL正己烷溶解,经0.22 μm滤膜过滤后取10 μL样品进样测定。
色谱柱:Waters C18柱(5 μm, 4.6 mm×250 mm);检测器:2998PDA检测器;色谱条件:流动相:100%甲醇;流速:1.0 mL/min;柱温:35 ℃;检测波长:282 nm。
1.3.5 挥发性风味成分分析
参照杨春英等的方法[9],采用顶空固相微萃取-气质联用法(SPME/GC/MS)分析食用油及蟹油中挥发性组分。
1.3.5.1 样品处理
取5.0 g样品置于20 mL顶空瓶中,100 ℃恒温预热15 min,将老化后的SPME固相微萃取头插入顶空瓶中,吸附40 min后取出萃取头插入气相色谱进样口,250 ℃解析5 min,进行GC-MS分析。
1.3.5.2 气相色谱条件
色谱柱:DB-5毛细管柱(60 m×0.25 mm×0.25 μm); 进样口温度:250 ℃,不分流;载气:N2(纯度≥99.9%),流速:1.0 mL/min;程序升温:初始温度:35 ℃,保持5 min,以6 ℃/min升温速率升至60 ℃, 以4 ℃/min升温速率升至70 ℃,以5 ℃/min升温速率升至150 ℃,以10 ℃/min升温速率升至220 ℃,保持5 min。
1.3.5.3 质谱条件
EI离子源,电子能量70 eV;离子源温度250 ℃;四级杆温度250 ℃;传输线温度250 ℃;扫描质量30~550 amu,全扫描方式。
挥发性成分经GC-MS分析得到总离子流图后,进行NIST11.L谱库检索,并结合文献报道进行图谱解析,取相似度≥80确认为该化合物。按照峰面积归一法计算产物中不同挥发性成分组成相对百分含量。
1.4 数据分析
采用SPSS 13.0统计软件分析,检测结果用平均值±标准差表示,所有实验均重复3次,P<0.05为差异显著。
2 结果与分析
2.1 理化性质比较
蟹油(湿基)提取率为33%。从性早熟蟹肝胰腺提取的蟹油颜色呈鲜红色,色泽透彻澄清。味道醇香,具有蟹黄的浓郁味道。由表1可知,蟹油酸价(KOH)为0.40 mg/g,皂化值(KOH)为207.87 mg/g,碘值为128.12 g/100 g,过氧化值为0.02 g/100 g。酸价是衡量油脂抗氧化性能的重要指标之一,酸价越高其油中游离脂肪酸含量越高,相对容易被氧化酸败,蟹油酸价在食用动物油脂国标(GB 10146—2015)要求范围内(0~2.5 mg/g);碘值是衡量油脂不饱和程度的重要指标,蟹油的碘值接近葵花籽油,为128.12 g/100 g,表明蟹油是一种半干性油脂,含有大量不饱和双键,其不饱和程度与葵花油、玉米油和大豆油等植物油类似;过氧化值是衡量油脂氧化程度的指标,一般来说过氧化值越高其酸败程度越大,蟹油中虽含有较多不饱和双键和游离脂肪酸,但其过氧化值较低,这可能与其中较高含量的α-生育酚(表3)有关;皂化值大小直接反映油脂中脂肪酸相对分子质量,蟹油的皂化值与葵花籽油接近(P≥0.05),而高于其他3种植物油(P<0.05), 说明蟹油脂肪酸组成相对平均分子质量与葵花籽油相当。以上数据表明,蟹油的各项指标均符合食用油脂理化性质要求。作为一种动物性油脂,其主要性质与常见的植物油脂较接近,具有游离脂肪酸含量和不饱和程度高的特点,同时由于蟹油中还含有生物酚等抗氧化物质,其过氧化值较低,因此,蟹油可作为一种高品质的食用油进行开发利用。

表1 蟹油和4种植物油的理化性质Table 1 The physicochemical properties of crab oil and four kinds of edible oils
注:同行小写字母不同表示差异显著(P<0.05)。
2.2 脂肪酸组成及含量比较
蟹油与4种食用油的脂肪酸组成在表2中列出,本研究中分析的蟹油脂肪酸组成与邵利平等的[4]结果一致,共检测出27种脂肪酸,脂肪酸种类较4种植物油丰富。蟹油中饱和脂肪酸(SFA)、单不饱和脂肪酸(MUFA) 和多不饱和脂肪酸(PUFA)的比值为1∶1.8∶1.3,接近中国营养学会膳食脂肪酸供能标准1∶1∶1[10]。性早熟蟹蟹油与正常蟹肝胰腺中脂肪酸组成及含量基本类似。就PUFA而言,性早熟蟹蟹油中含量高于正常蟹,主要是其中C18∶2含量的差异导致,这与刘强[5]的报道一致。
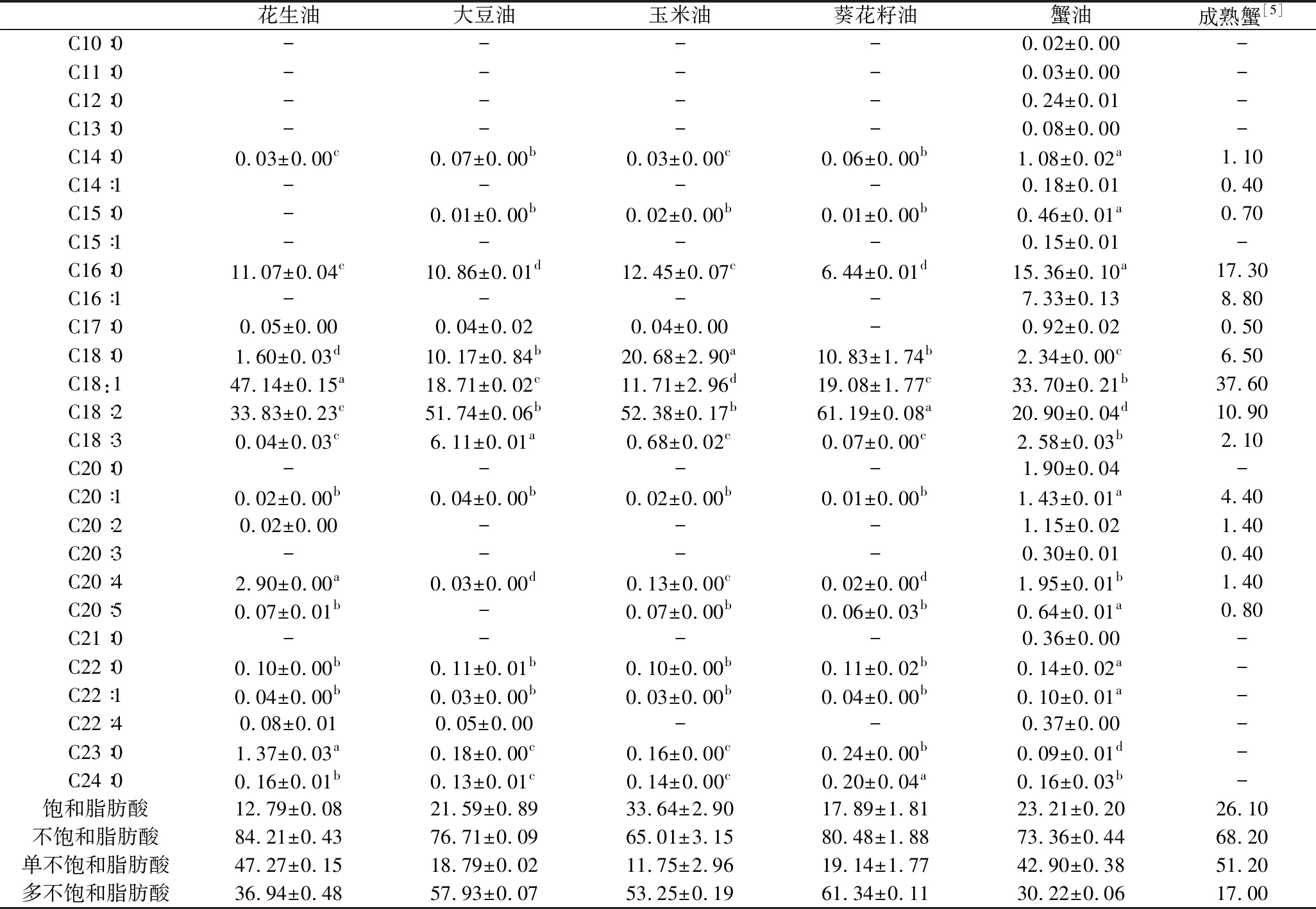
表2 蟹油和4种植物油的脂肪酸组成及相对含量 单位:%
注:同行小写字母不同表示差异显著(P<0.05)。
棕榈酸(C16∶0)是蟹油中含量最丰富的饱和脂肪酸,占15.36%,其次是硬脂酸(C18∶0),其他4种食用油中,花生油中含量最高的饱和脂肪酸为棕榈酸,而大豆油、玉米油和葵花籽油中硬脂酸为主要的饱和脂肪酸,且含量显著高于蟹油和花生油。对于不饱和脂肪酸,蟹油中的单不饱和脂肪酸较多(42.90%),与花生油相似(47.27%),而大豆油、玉米油和葵花籽油中多不饱和脂肪酸占主体。油酸(C18∶1)为蟹油中主要的单不饱和脂肪酸(33.70%),这与其他食用油一致。其次蟹油中还存在7.33%棕榈油酸(C16∶1)。5种油脂中,均以亚油酸(C18∶2)为主要多不饱和脂肪酸,大豆油、玉米油和葵花籽油中亚油酸含量超过50%,为其主要脂肪酸,蟹油中含量为20.90%。其他多不饱和脂肪酸中,蟹油和花生油的花生四烯酸(C20∶4)含量显著高于其他3种。研究表明,花生四烯酸在保护皮肤、降低胆固醇、抑制血小板凝集、提高免疫能力等方面具有独特的生物活性,是婴幼儿的必需脂肪酸。
总体而言,蟹油和花生油的脂肪酸组成相似,均以油酸和亚油酸为主要脂肪酸。脂肪酸是风味化合物的重要前体,是挥发性化合物的主要来源。对风味起重要作用的醛类物质大部分是由油酸和亚油酸氧化形成的[11]。
2.3 α-生育酚含量比较
生育酚具有抗氧化特性,它们可以清除氧自由基并在氧化过程中阻止自由基链式反应,α-生育酚是维生素E(VE)中最主要的组分[12],通常作为反映油脂中VE含量的指标。蟹油与4种植物油中α-生育酚含量如表3所示,其中蟹油中α-生育酚含量为765 mg/kg,显著高于花生油、大豆油和玉米油(P<0.05), 与葵花籽油中α-生育酚含量相当(P≥0.05),并高于文献报道的磷虾油[13]中的α-生育酚含量(147.4~222.7 mg/kg)。4种植物油中α-生育酚含量与温运启等[14]的研究结果相似,与常见食用植物油相比,蟹油中α-生育酚含量较高,具有较强的抗氧化性。

表3 蟹油和4种植物油的α-生育酚含量Table 3 The α-tocopherol content of crab oil and four kinds of edible oils
注:同行小写字母不同表示差异显著(P<0.05)。
2.4 挥发性成分比较
蟹油挥发性物质中检测到33种化合物(表4),包括酯类(0.91%)、醛类(69.72%)、酮类(4.76%)、醇类(3.59%)、酸类(2.18%)、烯类(7.47%)、呋喃(6.54%)、吡嗪(0.23%)、烷烃(3.17%)、芳香烃(1.22%)。
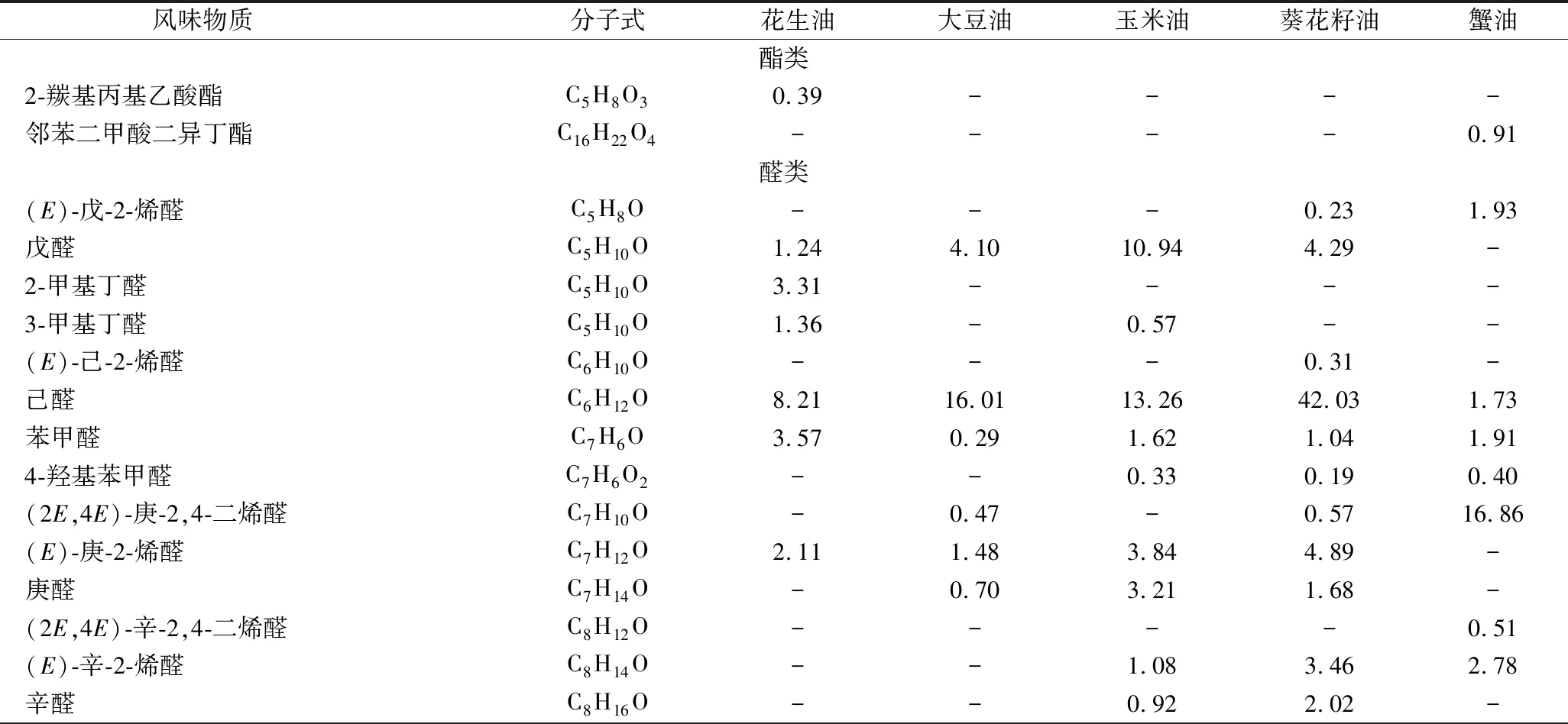
表4 蟹油和4种植物油挥发性成分及相对含量 单位:%
续表4
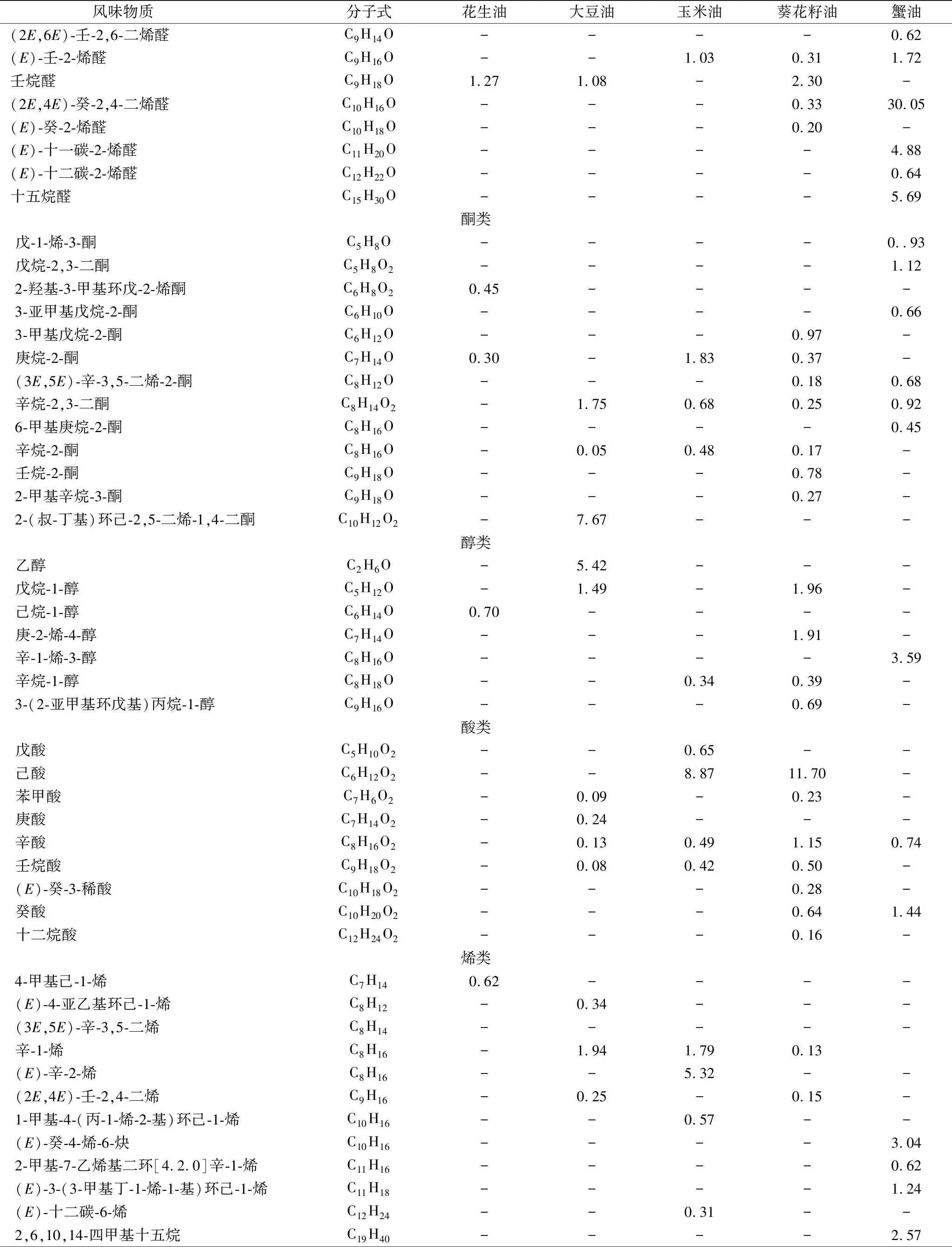
风味物质 分子式花生油大豆油玉米油葵花籽油蟹油(2E,6E)-壬-2,6-二烯醛C9H14O----0.62(E)-壬-2-烯醛C9H16O--1.030.311.72壬烷醛C9H18O1.271.08-2.30-(2E,4E)-癸-2,4-二烯醛C10H16O---0.3330.05(E)-癸-2-烯醛C10H18O---0.20-(E)-十一碳-2-烯醛C11H20O----4.88(E)-十二碳-2-烯醛C12H22O----0.64十五烷醛C15H30O----5.69酮类戊-1-烯-3-酮C5H8O----0..93戊烷-2,3-二酮C5H8O2----1.122-羟基-3-甲基环戊-2-烯酮C6H8O20.45----3-亚甲基戊烷-2-酮C6H10O----0.663-甲基戊烷-2-酮C6H12O---0.97-庚烷-2-酮C7H14O0.30-1.830.37-(3E,5E)-辛-3,5-二烯-2-酮C8H12O---0.180.68辛烷-2,3-二酮C8H14O2-1.750.680.250.926-甲基庚烷-2-酮C8H16O----0.45辛烷-2-酮C8H16O-0.050.480.17-壬烷-2-酮C9H18O---0.78-2-甲基辛烷-3-酮C9H18O---0.27-2-(叔-丁基)环己-2,5-二烯-1,4-二酮C10H12O2-7.67---醇类乙醇C2H6O-5.42---戊烷-1-醇C5H12O-1.49-1.96-己烷-1-醇C6H14O0.70----庚-2-烯-4-醇C7H14O---1.91-辛-1-烯-3-醇C8H16O----3.59辛烷-1-醇C8H18O--0.340.39-3-(2-亚甲基环戊基)丙烷-1-醇C9H16O---0.69-酸类戊酸C5H10O2--0.65--己酸C6H12O2--8.8711.70-苯甲酸C7H6O2-0.09-0.23-庚酸C7H14O2-0.24---辛酸C8H16O2-0.130.491.150.74壬烷酸C9H18O2-0.080.420.50-(E)-癸-3-稀酸C10H18O2---0.28-癸酸C10H20O2---0.641.44十二烷酸C12H24O2---0.16-烯类4-甲基己-1-烯C7H140.62----(E)-4-亚乙基环己-1-烯C8H12-0.34---(3E,5E)-辛-3,5-二烯C8H14-----辛-1-烯C8H16-1.941.790.13(E)-辛-2-烯C8H16--5.32--(2E,4E)-壬-2,4-二烯C9H16-0.25-0.15-1-甲基-4-(丙-1-烯-2-基)环己-1-烯C10H16--0.57--(E)-癸-4-烯-6-炔C10H16----3.042-甲基-7-乙烯基二环[4.2.0]辛-1-烯C11H16----0.62(E)-3-(3-甲基丁-1-烯-1-基)环己-1-烯C11H18----1.24(E)-十二碳-6-烯C12H24--0.31--2,6,10,14-四甲基十五烷C19H40----2.57
续表4
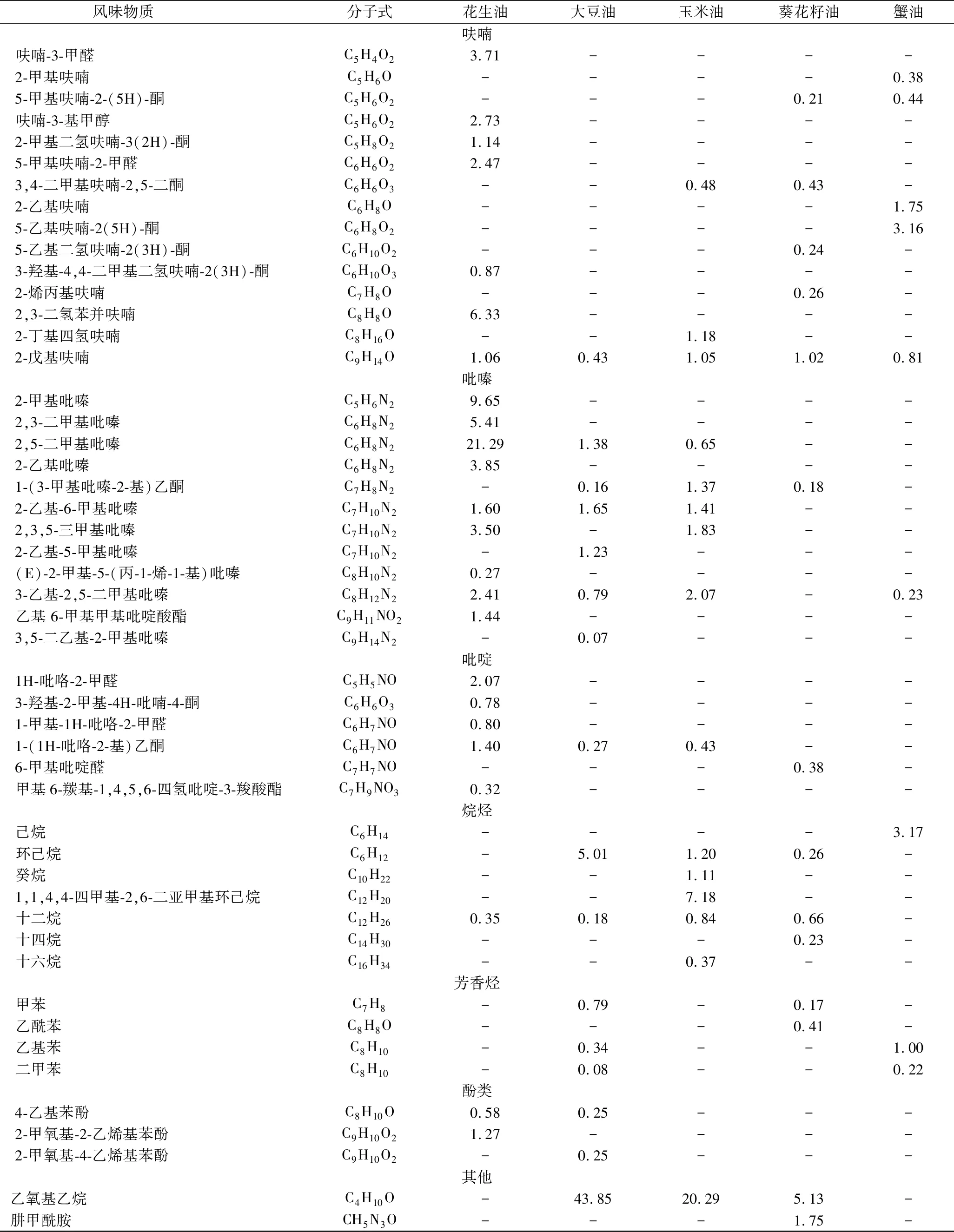
风味物质 分子式花生油大豆油玉米油葵花籽油蟹油呋喃呋喃-3-甲醛C5H4O23.71----2-甲基呋喃C5H6O----0.385-甲基呋喃-2-(5H)-酮C5H6O2---0.210.44呋喃-3-基甲醇C5H6O22.73----2-甲基二氢呋喃-3(2H)-酮C5H8O21.14----5-甲基呋喃-2-甲醛C6H6O22.47----3,4-二甲基呋喃-2,5-二酮C6H6O3--0.480.43-2-乙基呋喃C6H8O----1.755-乙基呋喃-2(5H)-酮C6H8O2----3.165-乙基二氢呋喃-2(3H)-酮C6H10O2---0.24-3-羟基-4,4-二甲基二氢呋喃-2(3H)-酮C6H10O30.87----2-烯丙基呋喃C7H8O---0.26-2,3-二氢苯并呋喃C8H8O6.33----2-丁基四氢呋喃C8H16O--1.18--2-戊基呋喃C9H14O1.060.431.051.020.81吡嗪2-甲基吡嗪C5H6N29.65----2,3-二甲基吡嗪C6H8N25.41----2,5-二甲基吡嗪C6H8N221.291.380.65--2-乙基吡嗪C6H8N23.85----1-(3-甲基吡嗪-2-基)乙酮C7H8N2-0.161.370.18-2-乙基-6-甲基吡嗪C7H10N21.601.651.41--2,3,5-三甲基吡嗪C7H10N23.50-1.83--2-乙基-5-甲基吡嗪C7H10N2-1.23---(E)-2-甲基-5-(丙-1-烯-1-基)吡嗪C8H10N20.27----3-乙基-2,5-二甲基吡嗪C8H12N22.410.792.07-0.23乙基 6-甲基甲基吡啶酸酯C9H11NO21.44----3,5-二乙基-2-甲基吡嗪C9H14N2-0.07---吡啶1H-吡咯-2-甲醛C5H5NO2.07----3-羟基-2-甲基-4H-吡喃-4-酮C6H6O30.78----1-甲基-1H-吡咯-2-甲醛C6H7NO0.80----1-(1H-吡咯-2-基)乙酮C6H7NO1.400.270.43--6-甲基吡啶醛C7H7NO---0.38-甲基6-羰基-1,4,5,6-四氢吡啶-3-羧酸酯C7H9NO30.32----烷烃己烷C6H14----3.17环己烷C6H12-5.011.200.26-癸烷C10H22--1.11--1,1,4,4-四甲基-2,6-二亚甲基环己烷C12H20--7.18--十二烷C12H260.350.180.840.66-十四烷C14H30---0.23-十六烷C16H34--0.37--芳香烃甲苯C7H8-0.79-0.17-乙酰苯C8H8O---0.41-乙基苯C8H10-0.34--1.00二甲苯C8H10-0.08--0.22酚类4-乙基苯酚C8H10O0.580.25---2-甲氧基-2-乙烯基苯酚C9H10O21.27----2-甲氧基-4-乙烯基苯酚C9H10O2-0.25---其他乙氧基乙烷C4H10O-43.8520.295.13-肼甲酰胺CH5N3O---1.75-
注:“- ”表示未检出。
从蟹油挥发性成分中检测出大量醛类化合物,峰总面积百分比为69.72%,醛类的气味阈值一般低于醇类的气味阈值。(2E,4E)-庚-2,4-二烯醛和(2E,4E)-癸-2,4-二烯醛是蟹油中最主要的挥发性物质分别占16.86%和30.05%,含量显著高于(P<0.05)4种植物油脂,是组成蟹油浓郁香味的关键风味物质。(2E,4E)-庚-2,4-二烯醛和(2E,4E)-癸-2,4-二烯醛是亚油酸的氧化降解产物,具有油脂味和水果香气[15],其气味阈值极低,对气味贡献较大。戊醛、己醛、庚醛等几种挥发性物质是油酸和亚油酸氧化裂解产物,是植物油中主要的醛类化合物。葵花籽油中醛类物质占63%,与其脂肪酸组成中高含量的亚油酸结果一致[16]。饱和的直链醛,如辛醛一般被认为有令人不快的、辛辣和刺激性的气味并带有蜡的特征气味[17],在蟹油中并未检出。
酮类一般由多不饱和脂肪酸的热氧化降解、氨基酸降解或微生物氧化产生[18],具有独特的清香和果香味。相较于其他4种食用油,蟹油中有多种特有酮类挥发性物质,如戊-1-烯-3-酮、戊烷-2,3-二酮、3-亚甲基戊烷-2-酮、6-甲基庚烷-2-酮等。6-甲基庚烷-2-酮在熟的小龙虾中被检测到[19],赋予甲壳类鱼肉的甜的花香和果香风味[20]。烯酮类是在加热期间生成的,是脂质氧化的产物,具有很浓的似玫瑰叶香[21]。而二酮类化合物如在中华绒螯蟹蟹黄中检出的辛烷-2,3-二酮,具有一种强烈的奶油香,也同样出现在蟹油挥发性风味中[22]。
醇类可能由脂肪酸的二级氢过氧化物的分解、脂质氧化酶对脂肪酸的作用或由羰基化合物还原产生,醇类一般对于食品的风味贡献很小。辛-1-烯-3-醇是一种亚油酸的氢过氧化物降解产物,具有似蘑菇的气味[23],它被广泛报道存在于牡蛎、蟹、对虾、小龙虾中的主要挥发性醇类,在海水和淡水鱼中也常有发现[24],在蟹油中占3.59%,是蟹油中的特有风味成分。
烃类主要来源于脂肪酸烷氧自由基的均裂[25]。由于它们的阈值较高,因此烃类对于食品整体的风味贡献较小[26]。正己烷在克氏原螯虾肝胰脏[27]及许多肉类挥发性风味物质中均有报道[28-30],是肉类特征风味物质。目前研究普遍认为脂肪烃主要来自烷基自由基的脂质自氧化过程或类胡萝卜素的分解生成[31]。蟹油挥发性物质中含有3.17%的正己烷,这与蟹油中类较高含量的类胡萝卜素有关,据报道,中华绒螯蟹肝胰腺中胡萝卜素含量达653.4 mg/kg[32]。
酯类被认为是发酵或脂质代谢生成的羧酸和醇酯化作用的产物,是很重要的风味物质,一般认为酯赋予食品一种甜的果香。在5种油中,仅在蟹油(0.91%) 和花生油(0.39%)中检测到酯类物质。
杂环类化合物在花生油中含量最高,以吡嗪类物质为主,占总检出物49%。吡嗪类物质是通过美拉德褐变反应生成的,由2个α-氨基羰基化合物缩合反应生成二氢吡嗪,最后自发氧化为其他的吡嗪类物质[33]。高蛋白的花生为美拉德反应提供了物质基础,故其吡嗪类物质含量高于其他植物油。KRISHNAMURTHY等发现2-戊基呋喃对于小龙虾和蟹肉的风味有负面的贡献,它也被报道在一些脂肪和油中有异常风味的效应并且给贮存的大豆油以一种豆和草的气味[34]。蟹油中检测到的2-戊基呋喃仅为0.81%,低于其他几种油。
3 结论
采用气相色谱法对从性早熟河蟹肝胰腺中提取的蟹油与4种市售食用植物油进行脂肪酸组成和含量进行比较,结果表明,蟹油中脂肪酸种类较4种植物油丰富,蟹油的脂肪酸组成与花生油接近,其中油酸、亚油酸、棕榈酸和花生四烯酸含量较高。理化指标的测定和分析表明,蟹油的碘值、皂化值等理化性质与葵花籽油相似,虽然蟹油中游离脂肪酸和不饱和双键含量较高,但因其中含有较高含量的α-生育酚,因此氧化稳定性较4种植物油好。通过对油中挥发性物质的对比可知,蟹油中保留了很多蟹黄中的风味成分。综合评价,蟹油具有较高的营养价值和风味特性,是一种优质的动物性油脂,开发和利用价格低廉的性早熟蟹制备蟹油具有良好的应用前景。

