鸡腿菇多糖的液态发酵工艺优化及抗氧化活性
陈旭峰,王佳丽,贾瑞娟,许 女*
(1.山西农业大学 实验教学中心,山西 太谷 030801;2.山西农业大学 食品科学与工程学院,山西 太谷 030801)
鸡腿菇(Coprinus comatus)属真菌门担子菌亚门层菌纲伞菌目鬼伞科鬼伞属,肉质细嫩、鲜美可口,研究表明,其具有降血糖、降血脂、增强免疫和抗肿瘤等多种生理功能,已被确定为符合联合国粮农组织(food and agriculture organization,FAO)和世界卫生组织(world health organization,WHO)要求的具“天然、营养、保健”三种机能为一体的16种珍稀食用菌之一[1-3]。鸡腿菇含有丰富的糖类,据测定,干品鸡腿菇中总糖含量为57.65%,还原糖含量为53.54%,多糖含量为4.11%[4],是发挥生理功能的重要成分。关于鸡腿菇多糖生理功能的研究主要集中在免疫[5-6]、降血糖[7]、抗病毒[8]和抗氧化[9]方面,多数研究都采用的是子实体提取的粗多糖。
应用深层发酵技术培养食用菌发展迅速,深层培养产生的菌丝体所含营养物质与子实体类似,深层发酵培养菌丝体生产周期短、产量高、成本低,液态深层发酵是开发鸡腿菇活性成分的有效手段。金卫根等[10]采用正交试验优化了鸡腿菇菌丝体生长的最佳培养基和培养条件,研究发现,葡萄糖和黄豆为其最适的碳氮源,最佳培养条件为温度25℃、装液量75 mL/250 mL、摇瓶转速150 r/min。李巍巍等[11]对鸡腿菇产溶栓酶液体发酵条件进行了优化,最终得到的溶栓酶活力相当于尿激酶活力150 IU/mL,较优化前提高5倍。凡军民[12]对鸡腿菇菌丝体进行了深层发酵,并对其菌丝体多糖进行了提取、分离纯化、结构鉴定和免疫活性研究。陆武祥等[13]比较了5种食用菌(猴头菇、杏鲍菇、香菇、金针菇、鸡腿菇)液体发酵菌丝多糖的抗氧化活性,结果表明,大部分菌丝多糖均具有一定的还原力及清除超氧阴离子自由基(O2-·)、羟自由基(·OH)和1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基(DPPH·)的能力。
本研究在单因素试验基础上,通过响应面方法优化鸡腿菇胞外多糖液态发酵工艺,并且探讨发酵液上清的胞外多糖及菌丝体胞内多糖对DPPH·、羟基自由基(·OH)、一氧化氮自由基(NO·)、超氧阴离子自由基(O2-·)的清除能力及对由亚铁离子(Fe2+)诱发的卵黄脂蛋白脂质过氧化抑制能力,评价其抗氧化活性,以期为鸡腿菇液态发酵生物活性多糖产业化开发提供基础研究。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
鸡腿菇(Corprinus comatus)菌株SXAU-Chang:山西农业大学食用菌中心保藏、提供。
1.1.2 主要试剂
DPPH(纯度95%):北京索莱宝科技有限公司;氯化硝基四氮唑蓝(nitroblue tetrazolium,NBT)(纯度95%):上海恒星应用化学研究所;核黄素(分析纯):北京奥博星生物技术责任有限公司。
1.1.3 培养基
斜面种子培养基:土豆200 g,葡萄糖30 g,蛋白胨4 g,KH2PO42 g,MgSO4·7H2O 1 g,维生素B1(vitamin B1,VB1)0.01 g,水1 000 mL,pH自然。
液体发酵基础培养基:葡萄糖40 g,蛋白胨4 g,KH2PO42 g,MgSO4·7H2O 1 g,VB10.01 g,水1 000 mL,pH自然。
1.2 仪器与设备
BS-2F恒温振荡培养箱:上海常思工贸有限公司;HZQF160全温振荡培养箱:哈尔滨市东联电子有限公司;Vanti J-E型柜式冷冻离心机:美国Beckman Coulter公司;JA2003电子天平:上海精密科学仪器有限公司;DZKW-C型水浴锅:河北省黄骅仪表厂;UV-9100型紫外可见分光光度计:北京瑞利分析仪器有限公司。
1.3 试验方法
1.3.1 菌种活化
将保藏的鸡腿菇菌种转接于斜面培养基上,25℃培养至满管,进行菌种活化,选择菌丝生长旺盛的菌种备用。将斜面菌种切割成约0.5 cm2大小的菌丝块,接种于装有100 mL液体发酵基础培养基的250 mL锥形瓶中,每瓶接半支斜面,25℃、160 r/min振荡培养4 d。
1.3.2 摇瓶培养
将活化好的液体种子培养基,按10%(V/V)的接种量接种于液体发酵基础培养基中,25℃、160 r/min振荡培养6 d,测定菌丝体干质量及发酵液中的多糖含量。
1.3.3 鸡腿菇菌丝体胞外和胞内多糖的制备
胞外多糖的制备:鸡腿菇发酵液在8 000 r/min离心20min,将得到的上清液用旋转蒸发仪浓缩至原体积的1/3,加入与原上清液等体积的体积分数为95%乙醇,于4℃条件下醇沉24 h,8 000 r/min离心15 min,取沉淀物于55℃烘箱中烘干至恒质量。
胞内多糖的制备:干菌丝体按照料水比1∶2(g∶mL)加水匀浆,在70℃条件下热水抽提4 h,离心取上清液,浓缩至原体积的1/3,加入与原上清液等体积的体积分数为95%乙醇,于4℃条件下醇沉24 h,8 000 r/min离心15 min,取沉淀物于55℃烘干至恒质量。
1.3.4 分析检测
采用干重法测定菌丝体生物量,将发酵液8 000 r/min离心20 min,菌丝体水洗两次,60℃烘干至恒质量称质量;采用苯酚-硫酸法测定鸡腿菇胞外和胞内多糖含量。
1.3.5 鸡腿菇多糖液态发酵工艺优化
(1)单因素试验
在液体发酵基础培养基的基础上,分别替换其中的碳氮源,考查添加量均为4%的不同碳源(玉米粉、红薯淀粉、可溶性淀粉、蔗糖、麦芽糖、葡萄糖),添加量均为0.4%的不同氮源(黄豆饼粉、花生饼粉、酵母膏、蛋白胨、硫酸铵、硝酸铵)对菌丝体生物量及发酵液中胞外多糖含量的影响。
(2)响应面试验
选取玉米粉(X1)、蔗糖(X2)、黄豆饼粉(X3)、酵母膏(X4)作为主要的影响因素,以菌丝体生物量(Y1)和胞外多糖含量(Y2)为响应值,采用Box-Behnken设计,对鸡腿菇液态发酵培养基进行优化,并进行响应面分析(response surface analysis,RSD),筛选最佳的发酵培养基条件。Box-Behnken试验设计因素与水平见表1。

表1 发酵培养基配方优化Box-Behnken试验因素与水平Table 1 Factors and levels of Box-Behnken design for fermentation medium formula optimization
(3)发酵条件优化
采用优化后的培养基,25℃条件下发酵6d,考察不同装液量(50mL/250mL、70mL/250mL、90mL/250mL、120mL/250 mL)和转速(120 r/min、160 r/min、180 r/min、200 r/min)对菌丝体干质量及发酵液中的胞外多糖含量影响。
1.3.6 抗氧化活性测定
对鸡腿菇液态发酵产生的胞外多糖和胞内多糖进行DPPH·、·OH、O2-·、NO·清除能力及还原力和脂质过氧化抑制能力测定[14-15]。
2 结果与分析
2.1 鸡腿菇多糖发酵培养基的优化
2.1.1 不同碳源对鸡腿菇胞外多糖和菌丝体生成量的影响
碳源是菌体生长和多糖合成的物质基础,适宜的碳源能使胞外多糖的产量得到提高,其浓度的大小也对胞外多糖产量产生影响,过高或过低都不利于胞外多糖的产生,甚至会抑制胞外多糖的合成。不同碳源对鸡腿菇的生物量及胞外多糖含量的影响结果见图1。由图1可知,鸡腿菇对碳源的利用相当广泛,对单糖、寡糖、多糖都可以利用,其中以玉米粉和葡萄糖作为碳源时,生物量和胞外多糖含量较高,生物量分别为1.8 g/100 mL、2.0 g/100 mL,胞外多糖含量分别为1.5 g/L、1.7 g/L,考虑到葡萄糖成本高,所以综合培养基的价格、来源、成本等因素,选择玉米粉和蔗糖作为最优碳源。
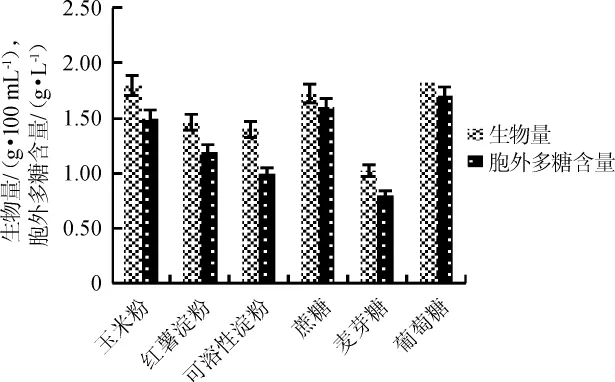
图1 不同碳源对鸡腿菇生物量及胞外多糖含量的影响Fig.1 Effect of different carbon sources on the biomass and extracellular polysaccharide of Coprinus comatus
2.1.2 不同氮源对鸡腿菇多糖和菌丝体生成量的影响
氮源是食用菌细胞合成蛋白质、核酸必不可少的主要原料,在深层发酵过程中起着非常重要的作用。不同氮源对鸡腿菇的生物量及胞外多糖含量的影响结果见图2。由图2可知,鸡腿菇对有机氮的利用率高于无机氮,酵母膏、黄豆饼粉和花生饼粉作为氮源时,鸡腿菇的生物量和胞外多糖含量较高,这与金萍[16]报道的结果相似,即酵母膏作为氮源时,菌丝体的生物量和多糖合成量最高,分别为2.2 g/100 mL和2.1 g/L。一方面这些氮源中含有丰富的蛋白质及多种生长因子,菌丝生长较快,胞外多糖产量也较高,另一方面可能是由于菌体自身分泌的蛋白酶较适合于这类蛋白。结合成本考虑,选择黄豆饼粉和酵母膏作为鸡腿菇生长的最优氮源。

图2 不同氮源对鸡腿菇生物量及胞外多糖含量的影响Fig.2 Effect of different nitrogen sources on the biomass and extracellular polysaccharide of Coprinus comatus
2.1.3 鸡腿菇最佳碳氮源的响应面优化[20]
在单因素试验基础上,选取玉米粉(X1)、蔗糖(X2)、黄豆饼粉(X3)、酵母膏(X4)作为主要的影响因素,以菌丝体生物量(Y1)和胞外多糖含量(Y2)为响应值,采用Box-Behnken试验设计,对鸡腿菇多糖碳氮源进行优化,响应面试验结果见表2,方差分析结果见表3,由RSA软件分析可以得到响应面见图3。

表2 发酵培养基配方优化Box-Behnken试验设计及结果Table 2 Design and results of Box-Behnken experiments for fermentation medium formula optimization

表3 回归模型方差分析Table 3 Variance analysis of regression model
由表3可知,模型在α=0.01水平上回归显著;失拟项反映的是实验数据与模型是否相符的情况,失拟项P值=0.941 508>0.1,不显著,因此,模型选择正确。同时,一次项和平方项影响显著(P<0.05),而交互项的影响不显著(P>0.05)。复相关系数R2=0.9326,说明模型可以解释93.26%试验所得菌丝体生物量的变化,表明方程拟合较好,即回归方程给鸡腿菇培养基优化提供了一个合适模型。变异系数(coefficientof variation,CV)5.15%<10%,表明模型准确度高,变异可能性低。最终经软件分析可得最优水平值为玉米粉3%、蔗糖3%、黄豆饼粉0.2%、酵母膏0.2%。在此最佳培养基条件下,菌丝体生物量为2.7 g/100 mL,胞外多糖产量为2.7 g/L。

图3 玉米粉、蔗糖、黄豆饼粉及酵母膏添加量交互作用对菌丝体生物量影响的响应面及等高线Fig.3 Response surface plots and contour line of effects of interaction between corn flour,sucrose,soybean powder and yeast extract addition on mycelium biomass
2.2 鸡腿菇多糖发酵条件优化
鸡腿菇作为一种好气性真菌,通气量大,生长好,进而影响其代谢物胞外多糖的产生。本试验采用优化后的培养基,考察不同的摇瓶装液量和转速对菌株发酵的影响,试验结果见图4和图5。
由图4可知,装液量为50~90mL/250mL时,鸡腿菇的生物量和胞外多糖产量逐渐增加;装液量为90mL/250mL时,鸡腿菇的生物量和胞外多糖产量最高,分别为2.9 g/100 mL和2.8g/L;装液量为90~120mL/250mL时,鸡腿菇的生物量和胞外多糖产量逐渐降低。因此,最适装液量为90mL/250mL。
由图5可知,转速为120~160 r/min时,鸡腿菇的生物量和胞外多糖产量逐渐增加;转速为160 r/min时,鸡腿菇的生物量和胞外多糖产量最高,分别为3.0g/100mL和2.8g/L;转速为160~200 r/min时,鸡腿菇的生物量和胞外多糖产量逐渐降低。因此,最适转速为160 r/min。

图4 装液量对鸡腿菇生物量及胞外多糖含量的影响Fig.4 Effect of liquid loading volume on the biomass and extracellular polysaccharide of Coprinus comatus

图5 转速对鸡腿菇生物量及胞外多糖含量的影响Fig.5 Effect of rotation speed on the biomass and extracellular polysaccharide of Coprinus comatus
2.3 鸡腿菇多糖发酵曲线测定
采用上述优化的发酵工艺,10%接种量,12层纱布包扎瓶口,25℃条件下培养10d。每天测定菌丝体生物量和发酵液中的胞外多糖含量,绘制鸡腿菇多糖发酵曲线见图6。

图6 鸡腿菇菌丝干质量及胞外多糖含量摇瓶发酵曲线Fig.6 Fermentation curve of mycelium dry mass and extracellular polysaccharide of Coprinus comatus in shaking flask
由图6可知,菌丝体生物量在第7天达到最大值,为3.2 g/100 mL,之后由于发酵液中营养物质减少,菌丝生长速度变慢,部分菌丝开始自溶,所以整体表现为菌丝干质量下降,发酵液颜色也逐渐变深。在发酵第6天,鸡腿菇产生的胞外多糖含量达到最大值,为2.9 g/L,之后胞外多糖的含量开始下降,最终趋于平缓。分析可能是因为随着发酵的进行,营养物质逐渐变得不充足,菌体分泌出的胞外多糖又被自身重新利用,所以胞外多糖含量在后期开始下降。
2.4 鸡腿菇胞外和胞内多糖抗氧化活性测定
2.4.1 总还原力测定
一般情况下,物质的还原能力越强,其抗氧化活性也越高。鸡腿菇胞内及胞外多糖的还原力测定结果图7。由图7可知,鸡腿菇的胞外多糖和胞内多糖溶液均具有一定的还原能力,但胞内多糖的还原能力高于胞外多糖,在质量浓度为8mg/mL时,胞外及胞内多糖的还原力分别达到0.52和0.78,但仍显著低于VC的还原力。
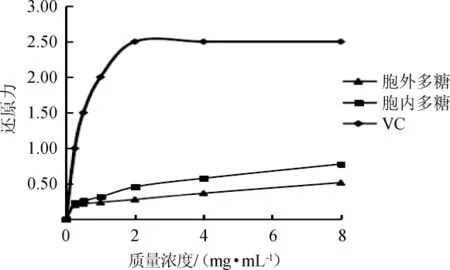
图7 鸡腿菇胞外和胞内粗多糖的还原力Fig.7 Reducing power of extracellular and intracellular crude polysaccharides from Coprinus comatus
2.4.2 DPPH·清除能力测定
由图8可知,鸡腿菇胞外和胞内多糖清除DPPH·的能力随浓度的增加而增强,具有明显的浓度依赖性。在低浓度下就有一定的还原力,当质量浓度为0.25 mg/mL,胞外及胞内多糖对DPPH·的清除率分别达到15.9%和20.1%;当质量浓度升高至2.00 mg/mL时,胞外多糖对DPPH·的清除率达到47.4%;胞内多糖对DPPH·的清除能力则达到55.1%,但二者均低于VC的DPPH·清除能力。

图8 鸡腿菇胞外和胞内粗多糖对DPPH自由基清除能力测定Fig.8 Scavenging capacity of extracellular and intracellular crude polysaccharides from Coprinus comatus on DPPH·
2.4.3 ·OH清除能力测定
羟基自由基是活性氧类物质中化学活性最强的物质。在细胞内,羟基自由基很容易通过特定位置穿过细胞膜,然后和氨基酸、蛋白质和脱氧核糖核酸(deoxyribonucleic acid,DNA)等生物分子发生反应,造成组织破坏和细胞死亡。因此,去除羟基自由基可能是生物体预防多种疾病最有效的措施之一[17-18]。鸡腿菇胞外、胞内粗多糖对羟基自由基的捕获能力结果见图9。
由图9可知,鸡腿菇多糖对·OH清除作用与浓度有着较强的依赖关系。当胞外多糖质量浓度为8 mg/mL时,清除率达44.1%;胞内多糖对·OH清除的清除率达52.2%,远远高于吴艳兵[8]报道的同等浓度下经脱蛋白处理的鸡腿菇子实体多糖的·OH清除率(25%);然而却低于王金玺等[20]的报道(80%)。

图9 鸡腿菇胞外和胞内粗多糖对·OH清除能力测定Fig.9 Scavenging capacity of extracellular and intracellular crude polysaccharides from Coprinus comatus on·OH
2.4.4 O2-·清除能力测定
由图10可知,鸡腿菇胞外和胞内多糖具有一定的O2-·清除能力,在8 mg/mL的浓度时,二者的清除率分别为27.2%和38.2%,与王金玺等[20]报道的同等浓度下鸡腿菇粗多糖的结果相当(26%),但二者都远远低于VC的O2-·清除能力。鸡腿菇粗多糖表现出较弱的清除O2-·的能力,其原因可能是与其空间构象相关,使其羟基被包裹在结构内部,无法与结构外围的O2-·发生作用[20]。

图10 鸡腿菇胞外和胞内粗多糖对O2-·清除能力测定Fig.10 Scavenging capacity of extracellular and intracellular crude polysaccharides from Coprinus comatus on O2-·
2.4.5 NO·的抑制能力测定
一氧化氮自由基(NO·)已被广泛认同在各种生理和病理过程中发挥调节作用。但是,过多产生的一氧化氮自由基(NO·)能够引发各种不利于健康的细胞反应,并且造成包括炎症、脓肿、中风、动脉硬化在内的多种疾病。一氧化氮自由基(NO·)捕获剂可以中止由于过多硝基自由基引发的链式反应。鸡腿菇胞外、胞内多糖和VC对NO·的抑制作用结果见图11。

图11 鸡腿菇胞外和胞内粗多糖对NO·的抑制能力Fig.11 Inhibiting capacity of extracellular and intracellular crude polysaccharides from Coprinus comatus on NO·
由图11可知,在试验浓度范围内,两种多糖组分的抑制作用虽然比维生素C要弱,但也具有明显的效果。胞外多糖、胞内多糖在8mg/mL时,NO·清除率分别达48.1%、65.1%。
2.4.6 抑制脂质过氧化能力测定
生物体内的脂质过氧化主要发生在生物膜上,由于构成生物膜骨架的主要成分磷脂中含有多不饱和脂肪酸,最容易发生过氧化反应,而脂质过氧化和细胞损伤的发生,可引起人体衰老和心脏病、动脉粥样硬化、癌症、炎症、糖尿病等严重疾病。引起机体脂质过氧化的因素很多,其中二价铁离子是生物体内最主要的脂质过氧化促进剂[21],故本研究以二价铁离子为氧化促进剂,以卵黄脂质体体系为模型,研究鸡腿菇多糖成分对脂质过氧化的抑制作用。卵黄中磷脂C-2位上所含的极低密度脂蛋白(very low density lipoprotein,VLDL)和低密度脂蛋白(low densitylipoprotein,LDL)及过不饱和脂肪酸(polyunsaturated fattyacids,PUFA)在铁离子的催化下,经振荡,能诱发过氧化,产生烷氧基(LO·)和烷过氧基(LOO·)物质,再引发链式反应。当有抗氧化剂存在时,可清除过氧化产物,从而阻断链式反应的发生,使得该卵黄脂蛋白脂质过氧化体系的过氧化产物生成受阻,根据吸光度数值的变化可测定抗氧化剂的抑制率[21]。

图12 鸡腿菇胞外和胞内粗多糖对卵黄脂蛋白过氧化的抑制能力Fig.12 Inhibiting capacity of extracellular and intracellular crude polysaccharides from Coprinus comatus on lipovitellinin peroxidation
鸡腿菇胞外和胞内多糖对Fe2+诱发的卵黄脂蛋白脂质过氧化的抑制结果见图12。由图12可知,胞外和胞内对Fe2+诱发的脂质过氧化的抑制能力与浓度均呈正相关,两者在试验浓度最高浓度时的抑制率分别为25.2%和37.1%,抑制率作用均不明显,远低于VC抑制作用。
3 结论
通过响应面方法优化鸡腿菇胞外多糖液态发酵工艺,并且对发酵液上清的胞外多糖及菌丝体胞内多糖的抗氧化活性进行系统研究,结果表明,最优发酵工艺为玉米粉3%、蔗糖3%,黄豆饼粉0.2%,酵母膏0.2%,装液量90mL/250mL,转速160 r/min,25℃条件下发酵6 d。在此最优工艺下,鸡腿菇菌丝体生物量可达到3.2 g/100 mL,胞外多糖产量可达到2.9 g/L。抗氧化试验结果表明,鸡腿菇多糖对DPPH自由基的清除率很高,胞内多糖的清除能力强于发酵上清胞外多糖,并且对·OH和NO·也有着较好的清除效果,另外,鸡腿菇胞内和胞外多糖还对O2-·及Fe2+诱发的卵黄脂蛋白脂质过氧化具有一定的清除和抑制能力。鸡腿菇液态发酵多糖具有良好的的抗氧化活性,显示了其作为功能食品添加剂的应用潜力。

