不同温度下长茎葡萄蕨藻无机碳利用
黄 丹,刘东超,王晓梁,林 挺,黄晓健,欧阳兆攀
不同温度下长茎葡萄蕨藻无机碳利用
黄 丹1,2,刘东超1,2,王晓梁1,2,林 挺1,黄晓健1,欧阳兆攀1
(1. 广东海洋大学水产学院 / 2. 广东省藻类养殖与应用工程技术研究中心,广东 湛江 524088)
【】阐明长茎葡萄蕨藻对无机碳的利用方式。运用pH漂移技术,探索藻体质量、藻体部位、照度和海水体积对长茎葡萄蕨藻()的pH补偿点的影响,并研究在3种不同温度(20、25、30 ℃)下,乙酰唑胺(AZ)、乙氧苯丙噻唑磺胺(EZ)、4,4′-二异硫氰基芪2,2′-二磺酸(DIDS)、钒酸盐(Van)4种抑制剂对长茎葡萄蕨藻无机碳的利用影响。藻体质量、藻体部位、照度和海水体积对长茎葡萄蕨藻的pH补偿点均无显著性影响(> 0.05),在一定范围内藻体质量或照度越大,达到pH补偿点时间越短,且pH补偿点均大于9。20 ℃下各抑制剂的抑制作用最大,其次为30 ℃,25 ℃最小,但3种温度下各抑制剂的抑制率无显著差别(> 0.05)。4种抑制剂中DIDS对长茎葡萄蕨藻pH补偿点和无机碳利用均无显著影响(> 0.05),剩余3种抑制剂的抑制作用依次为EZ> AZ >Van。藻体质量、藻体部位、照度和海水体积对长茎葡萄蕨藻pH补偿点无影响。温度对长茎葡萄蕨藻吸收利用无机碳没有明显影响。长茎葡萄蕨藻能利用HCO3-作为无机碳源进行光合作用。
长茎葡萄蕨藻;pH补偿点;无机碳利用;温度;抑制剂
长茎葡萄蕨藻(),隶属蕨藻科(Caulerpaceae),蕨藻属(),又名“海葡萄”“绿色鱼子酱”[1],是一种高蛋白、高纤维、低脂肪,且富含矿物质的食用绿藻[2-5]。其藻体内含有具较强抗氧化、抗菌、抗炎、抗肿瘤、镇痛、抗癌和治疗痛风、糖尿病、肥胖症作用的多糖、蕨藻倍半萜、蕨藻红素等活性物质[6-8],其干藻粉有吸附铜、镉、铅等重金属和废水中碱性染料的作用[9-10],其在生态混合养殖中还可有效去除养殖水体中的氨氮起到净化水质的作用[11-13]。因此,对长茎葡萄蕨藻的研究具有重要的现实意义和经济价值。目前,国内外对长茎葡萄蕨藻的研究主要集中在营养成分[2-5]、养殖技术[14-17]、净化水质[11-13]等方面,但有关长茎葡萄蕨藻无机碳的利用途径的研究尚未见报道。
开展长茎葡萄蕨藻对无机碳的利用研究是深入认识其光合生理机制和提高养殖产量的基础。在较高pH(约8.0~8.2)和高盐度(约35)的天然海水中,溶解的无机碳(DIC)主要以HCO3-为主,约占90%,游离的CO2极少,而CO32-不能直接被利用[18-20]。为了克服低CO2环境的限制,许多大型海藻逐渐形成了利用HCO3-以提高细胞内的CO2浓度的碳浓缩机制(CCM)[19, 21-23]。研究表明,大多数大型海藻能通过以下3种途径利用HCO3-作为无机碳源进行光合作用:胞外碳酸酐酶(CA)催化的HCO3-利用(此过程可被胞外碳酸酐酶抑制剂AZ所抑制)[24];通过阴离子交换蛋白直接转运HCO3-(此过程可被阴离子交换蛋白抑制剂DIDS所抑制)[20, 25];依赖于质膜P型H+- ATP酶的HCO3-主动运输(此过程可被膜ATP酶抑制剂Van所抑制)[26-27]。进入细胞内的HCO3-必须在胞质CA或叶绿体CA的作用下转化成CO2才能参与核酮糖-1,5-二磷酸羧化酶(Rubisco)所催化的光合作用的碳固定反应(此过程可被抑制剂EZ所抑制)[26]。由于HCO3-的利用能被不同的抑制剂所抑制,因此添加抑制剂被广泛的应用于海藻无机碳利用途径的研究中。
在封闭系统中测量pH补偿点在一定程度上能反映藻类对无机碳的利用。目前众多学者运用pH漂移技术测定pH补偿点的方法来研究藻类对无机碳的利用,但其所用到的藻体质量、海水体积以及照度不一致[19, 24-26, 28-33],而上述因素是否会影响pH补偿点的测定,目前相关报道较少,仅岳国峰等[34]研究了材料用量和照度对烟杂一号海带(×)幼孢子体pH补偿点的影响。同时,长茎葡萄蕨藻藻体由直立枝、匍匐茎以及假根3部分组成,不同的藻体部位是否会影响补偿点的测定,尚不清楚。研究表明,不同的藻类对无机碳的利用途径不同,同一种藻在不同温度条件下其无机碳利用方式亦不同,且温度对大型海藻无机碳利用途径的影响具有较大的种间差异性[19]。
本研究通过分析藻体质量、藻体部位以及照度和海水体积对长茎葡萄蕨藻的pH补偿点的影响,研究在不同温度下利用4种抑制剂对长茎葡萄蕨藻光合作用中无机碳的利用,旨在阐明长茎葡萄蕨藻对无机碳的利用能力及可能的利用方式,以期为长茎葡萄蕨藻养殖过程中外源无机碳的添加提供科学依据。
1 材料与方法
1.1 实验材料
实验用长茎葡萄蕨藻购自深圳市蓝汀鼎执生物科技有限公司,培养于广东海洋大学藻类实验室。培养条件:温度为(26 ± 1)℃,照度为2 000~5 000 lx,光暗周期为12∶12,连续充气培养;培养液为添加NaNO30.5 mmol•L-1、KH2PO40.1 mmol•L-1,盐度为(32 ± 1),pH为7.8~8.2的消毒海水;实验前挑选健康的、表面无杂藻的藻体,用消毒海水冲洗3遍,再用灭菌的解剖剪剪下一定数量的直立枝和匍匐茎暂养恢复一天,选择暂养后情况较好的藻体进行实验。
1.2 藻体质量、藻体部位、照度以及海水体积对pH补偿点的影响
利用pH漂移技术测定pH补偿点,按照表1实验设计将不同质量、部位的长茎葡萄蕨藻藻体置于50 mL透明玻璃小瓶中,用瓶盖密封,放于25 ℃光照培养箱连续光照培养,每组设置3个重复。每隔2 h采用pH计测定pH,pH计使用前用pH校正液校准,pH增加不超过0.01时停止测定,此时的pH值为藻体在该条件下的pH补偿点,这段时间内pH的变化曲线称为pH漂移曲线[35]。B组为对照组,A、C、D、E组分别研究海水体积、藻体部位、藻体质量、照度对pH补偿点的影响。

表1 藻体质量、藻体部位、照度以及海水体积对pH补偿点影响实验设计
1.3 不同温度下抑制剂对长茎葡萄蕨藻无机碳利用的影响
称取长茎葡萄蕨藻直立枝约1.0 g(鲜重FW)置于含200 mL消毒海水的250 mL锥形瓶中,分别加入胞外碳酸酐酶抑制剂——乙酰唑胺(AZ)、胞外和胞内碳酸酐酶抑制剂——乙氧苯丙噻唑磺胺(EZ)(AZ、EZ均用 0.05 mol•L-1NaOH溶液配制成 20 mmol•L-1的原液)、阴离子交换蛋白抑制剂——4,4′-二异硫氰基芪2,2′-二磺酸(DIDS)、ATP酶抑制剂——钒酸盐(原钒酸钠,Van),参照王吉等[26]研究确定AZ、EZ、Van 3种抑制剂的最终浓度分别为100、100、500 μmol•L-1,参照程苗等[25]研究确定抑制剂DIDS的最终浓度为300 μmol•L-1。最后用0.1 mol•L-1NaOH溶液或0.1 mol•L-1HCl溶液将各组溶液pH调成与未加抑制剂的对照组一致,封口膜密封。每组设置3个平行,分别置于温度为20、25、30 ℃,照度为2 000 lx的光照培养箱中持续光照培养。抑制剂AZ、EZ、DIDS均购自Sigma公司,抑制剂Van购自国药集团化学试剂有限公司。
1.4 总碱度测定及无机碳浓度、无机碳利用量抑制率的计算
每隔3 h测定pH,pH增加不超过0.01时停止测定,并在测定pH后取20 mL培养液测定总碱度,总碱度测定5次。采用 pH 法(GB/T 12763.4— 2007)测定总碱度(TA)。根据pH、温度、盐度和总碱度值,使用由MILLERO等[36]确定的碳酸解离常数和DICKSON[37]发表的HSO4-解离常数,运用CO2SYS 软件[38]计算无机碳(DIC)浓度。并计算12 h内无机碳利用量以及抑制剂对无机碳利用量的抑制率[39]。
抑制率=(对照组DIC的利用量-抑制剂组DIC的利用量)/ 对照组DIC的利用量。
1.5 统计分析
所得测定结果均表示为平均值± 标准差(≥ 3)。用SPSS 19.0软件进行单因素方差分析,差异显著者利用Tukey进行多重比较,以< 0.05作为差异的显著性水平。用GraphPad Prism 7.00软件制图。
2 结果与分析
2.1 藻体质量、藻体部位、照度以及海水体积对pH补偿点的影响
由表1、2可知5个处理组最终在不同的时间内均达到了基本相同的pH补偿点,且均大于9。A、C、D、E组分别与B组比较得到海水体积、藻体部位、藻体质量、照度均对pH补偿点无显著性影响(> 0.05)。D组藻质量0.8 g,达到pH补偿点的时间为26 h,E组照度为4 000 lx达到pH补偿点的时间为28 h,而B组藻质量0.4 g、照度2 000 lx则需要30 h,表明在一定范围内藻体质量越大或照度越强,达到pH补偿点时间越短。A、C两组与B组达到pH补偿点的时间一致,表明海水体积与藻体部位对达到pH补偿点的时间无影响。
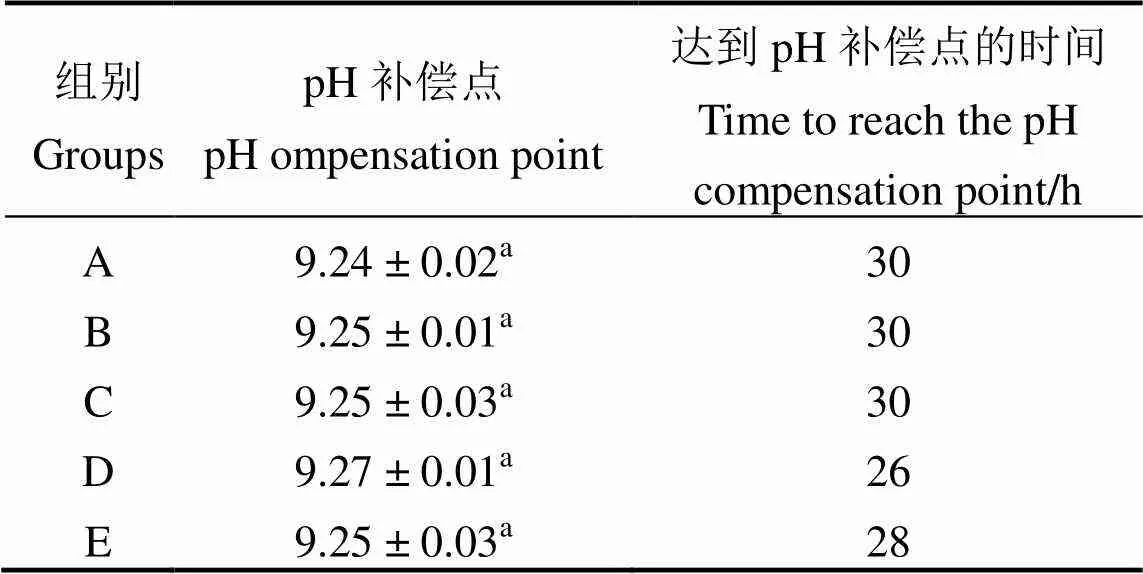
表2 藻体质量、藻体部位、照度以及海水体积对pH补偿点的影响
注:同一列中字母不同表示差异存在统计学意义(< 0.05)
Note:The difference of letters in the same column was statistically significant (< 0.05)
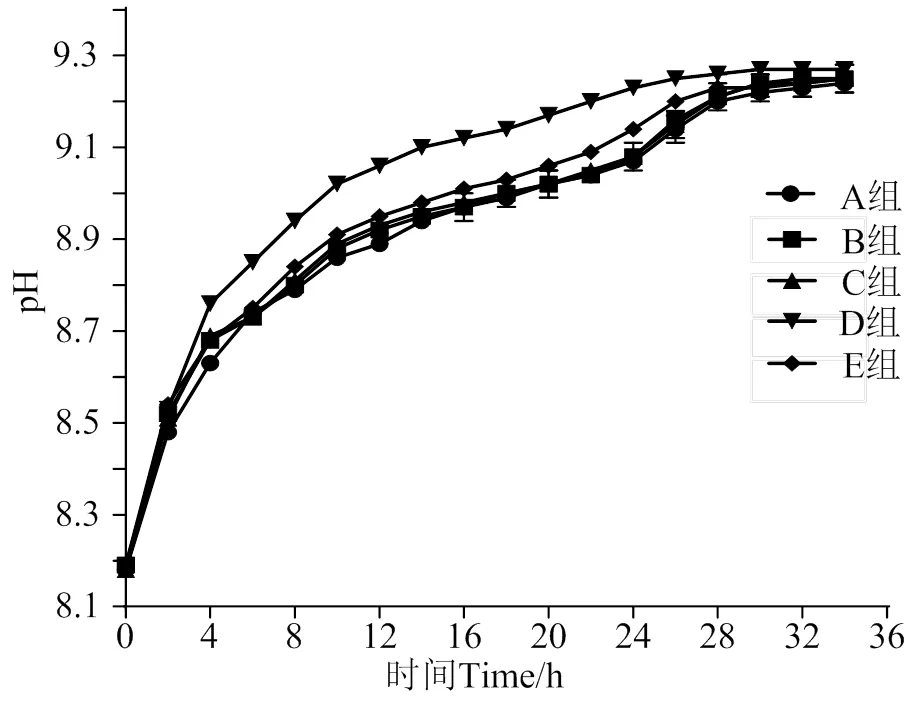
图1 长茎葡萄蕨藻不同处理组的pH漂移曲线
2.2 不同温度下抑制剂对长茎葡萄蕨藻无机碳利用的影响
2.2.1 不同温度下抑制剂对长茎葡萄蕨藻培养体系pH的影响 从图2 a-c可见,除了30 ℃添加Van组在30 h后pH降低,其余处理组在20、25、30 ℃持续光照的密闭条件下pH变化趋势大体一致,30 h基本达到平缓,直至达到pH补偿点。较其它组而言,对照组pH值上升速度最快,pH补偿点最高,在20、25、30 ℃的pH补偿点分别为9.02、9.27、9.06。DIDS处理组的pH补偿点在20、25、30 ℃下分别为8.99、9.26、9.02,比对照组低(> 0.05)。其次为添加Van组,在20、25、30 ℃下pH补偿点分别为8.66、8.86、8.52,显著低于对照组和DIDS处理组(< 0.05)。由于30 ℃添加Van组30 h后有部分藻体腐烂,因此出现pH下降趋势。除了30 ℃下Van处理组与AZ处理组的pH补偿点无显著差异(> 0.05),其余温度下Van处理组的pH补偿点明显高于AZ和EZ处理组(< 0.05)。其中EZ处理组的pH值上升最少,pH补偿点最低,分别为8.26(20 ℃)、8.46(25 ℃)、8.37(30 ℃),并明显低于AZ处理组的pH补偿点8.54(20、30 ℃)、8.78(25 ℃)(< 0.05)。可见,DIDS基本无抑制作用,AZ、EZ、Van分别有不同程度的抑制作用,其中EZ抑制效果最明显,AZ次之,Van最差。
3个温度中25 ℃培养条件下各组的pH补偿点最高,并显著高于20 ℃和30 ℃的pH补偿点(< 0.05)。除了20 ℃Van处理组的pH补偿点显著高于30 ℃外(< 0.05),其余各组均低于30 ℃,除了EZ处理组有显著差异外(< 0.05),剩下的3组均无显著差异(> 0.05)(图2-d)。
2.2.2 不同温度下抑制剂对长茎葡萄蕨藻培养体系无机碳DIC的影响 连续光照培养下,随着长茎葡萄蕨藻光合作用的进行,密闭系统中无机碳浓度逐渐降低。不同温度和不同抑制剂处理对长茎葡萄蕨藻DIC吸收的影响不同,但在不同温度下大体变化趋势一致(图3 a-c),并且在前6 h无机碳吸收利用的较多。未添加抑制剂的对照组DIC降低最快,吸收利用无机碳的能力最强。其次为添加DIDS组,添加AZ组虽较添加Van组的DIC浓度高,但二者均比EZ组低,EZ 是4种抑制剂中对长茎葡萄蕨藻无机碳吸收抑制效果最强的。5组利用无机碳的能力从大到小依次为对照组> DIDS > Van > AZ > EZ。
从图3-d可见,培养6 h后长茎葡萄蕨藻在25 ℃对DIC的吸收利用量最大,对照组、AZ、EZ、Van、DIDS处理组的无机碳利用量分别为370.93、180.07、126.74、245.07、362.74 μmol•kg-1。降低(20 ℃)或升高温度(30 ℃)条件下,长茎葡萄蕨藻的DIC利用量均有所下降,且30 ℃下DIC利用量下降更多,但20、30与25 ℃的DIC利用量无显著差异(> 0.05)。
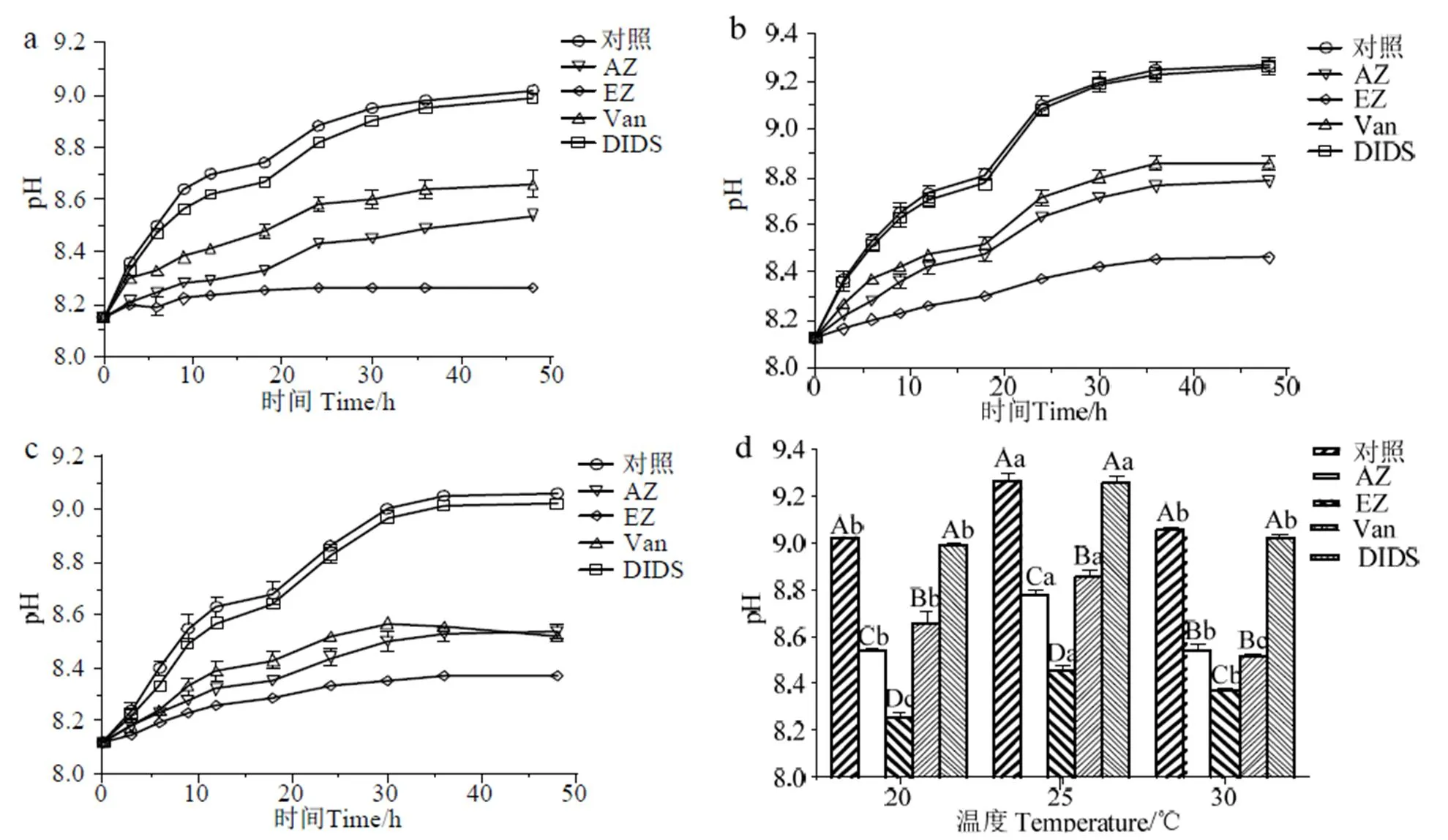
a、b、c表示20、25、30 ℃;d:pH补偿点;不同的大写字母表示相同温度下不同处理间具有显著性差异(P < 0.05);不同的小写字母表示不同温度下相同处理之间具有显著性差异(P < 0.05)
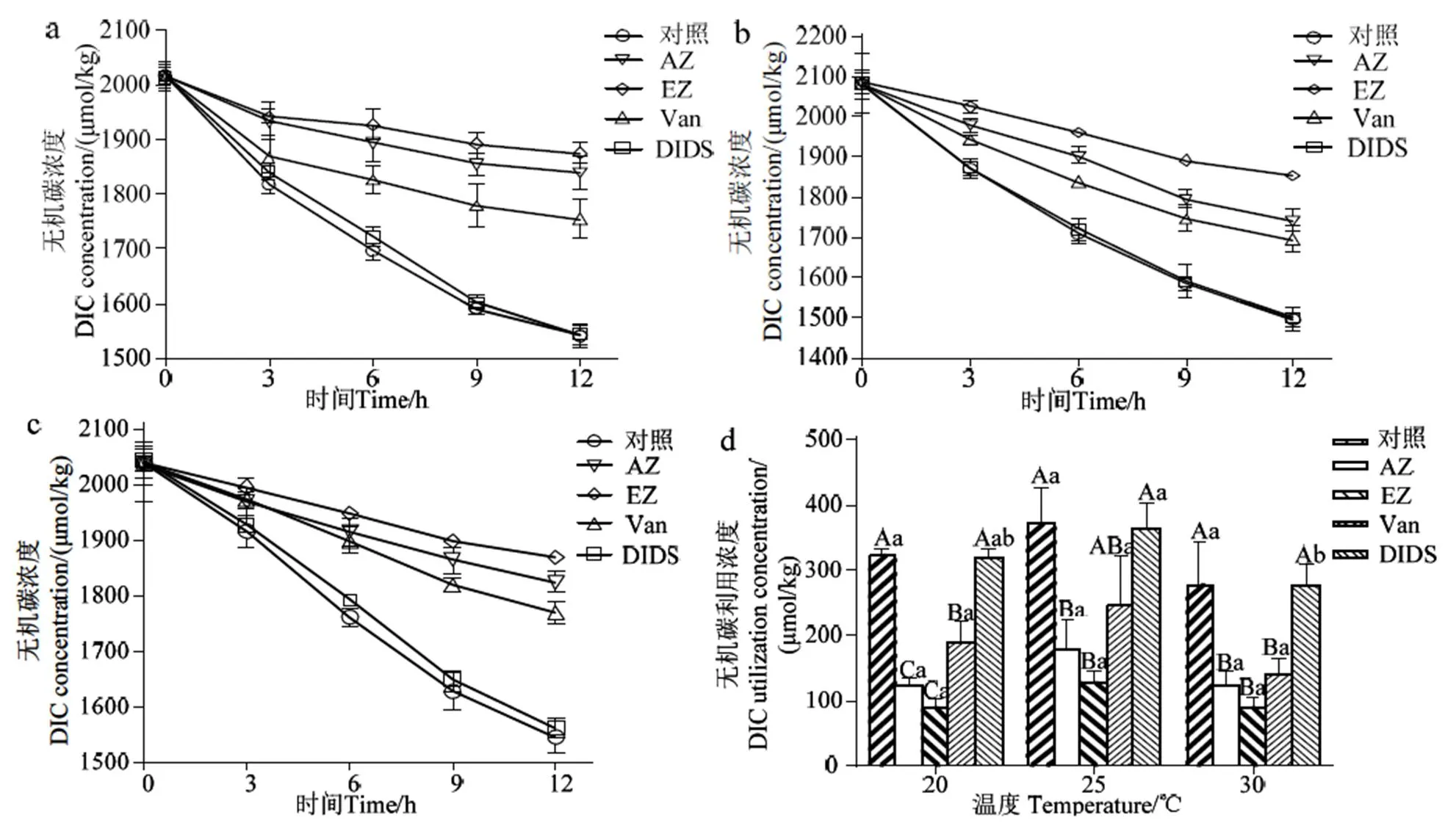
a、b、c表示20、25、30 ℃;d:长茎葡萄蕨藻培养6 h后DIC的利用量;不同的大写字母表示相同温度下不同处理间具有显著性差异(P < 0.05);不同的小写字母表示不同温度下相同处理之间具有显著性差异(P < 0.05)
2.2.3 不同温度下抑制剂对长茎葡萄蕨藻无机碳利用抑制率的影响 在3种温度条件下培养6 h后,DIDS的抑制率分别为0.51%(20 ℃)、2.21%(25 ℃)、0.72% (30 ℃),基本上认为无抑制作用,说明长茎葡萄蕨藻不能通过阴离子交换蛋白机制直接吸收海水中的HCO3-。由图4可知,胞外碳酸酐酶抑制剂AZ、胞内胞外碳酸酐酶抑制剂EZ和ATP酶抑制剂Van对长茎葡萄蕨藻无机碳的利用具有不同程度的抑制作用,抑制率分别为62.13%、 72.85%和41.19% (20 ℃),51.45%、65.83%和33.93% (25 ℃),55.95%、68.92%和49.81% (30 ℃),抑制作用从大到小依次为:EZ>AZ >Van。但3种温度下,AZ和EZ的抑制作用无显著差异(> 0.05),除30 ℃外均与Van有显著性差异(< 0.05)。
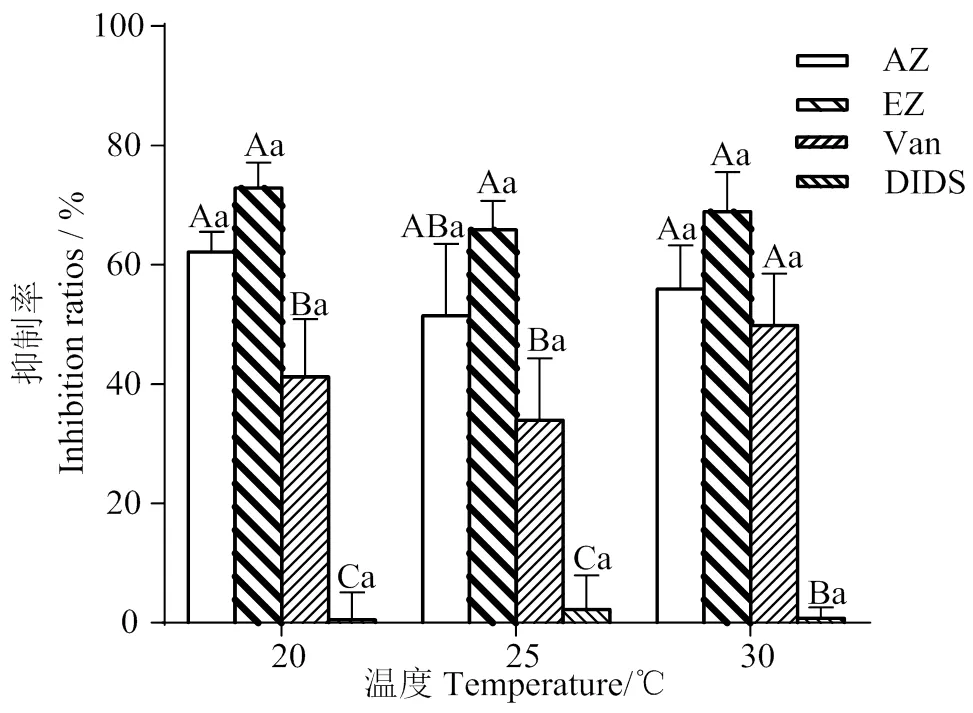
不同的大写表示相同温度下不同处理之间具有显著性差异(P < 0.05);小写字母表示不同温度下相同处理之间具有显著性差异(P < 0.05)
在3种实验温度下,20 ℃时各抑制剂的抑制作用最大,其次为30 ℃,25 ℃最小,但此3种温度下各抑制剂的抑制率均无显著差别(> 0.05),说明3种温度对长茎葡萄蕨藻吸收利用无机碳没有明显影响,但20 ℃和30 ℃抑制作用都比25 ℃大,说明25 ℃是较适宜长茎葡萄蕨藻生长和进行光合作用的温度,且温度变化并不改变长茎葡萄蕨藻利用HCO3-的方式。
3 讨论
3.1 藻体质量、藻体部位、照度以及海水体积对pH补偿点的影响
海水体积、藻体部位、藻体质量、照度均对pH补偿点无显著性影响(> 0.05),但藻体质量和照度会影响达到pH补偿点的时间,在一定范围内藻体质量越大或照度越强,达到pH补偿点时间越短。所以,可以通过适当增加藻体质量或提高照度来缩短达到pH补偿点的时间。本实验结果与岳国峰等[34]的研究结论一致。长茎葡萄蕨藻的直立枝与匍匐茎作为实验材料均对pH补偿点的测定无影响,因此可考虑将生长较快的匍匐茎作为后续实验材料。
3.2 长茎葡萄蕨藻无机碳的利用
在封闭系统中,海藻消耗溶解的DIC导致水体pH上升,测量pH补偿点在一定程度上能反映藻类对无机碳的利用。研究表明,可利用HCO3-进行光合作用的藻类pH补偿点一般都大于9.0[19, 30, 35]。在pH为9左右时,只以CO2为碳源的藻类无法通过利用 HCO3-来进一步提高pH值,相反如果藻类能够利用HCO3-,pH补偿点可以达到相当高的值[40]。在实验的3种温度下(20、25、30 ℃),未添加抑制剂的长茎葡萄蕨藻pH补偿点均大于9,表明长茎葡萄蕨藻能利用HCO3-进行光合作用。
在实验3种温度条件下,DIDS对长茎葡萄蕨藻pH补偿点和无机碳利用均无显著影响(> 0.05),表明长茎葡萄蕨藻不能通过阴离子交换蛋白直接吸收海水中的HCO3-。CARLBERG等[41]研究发现刺松藻()也不能通过阴离子交换蛋白机制直接吸收海水中的HCO3-。这可能与长茎葡萄蕨藻和刺松藻在细胞结构上的类似有关,二者均没有形成这种HCO3-的利用机制,而肠浒苔 () 等多数绿藻一般具有能被DIDS抑制的高pH诱导的直接吸收海水中的HCO3-的光合作用的特征[42-43]。大型绿藻HCO3-直接吸收机制与环境条件有关,在高光强、高pH及富营养的海水条件下或在AZ存在下生长的藻类可诱导出阴离子交换蛋白协助的HCO3-直接吸收(即DIDS敏感机制的HCO3-吸收)[27, 42]。因此,对于长茎葡萄蕨藻在其它条件下是否存在阴离子交换蛋白协助的HCO3-直接吸收途径有待进一步研究。
在不同温度条件下,3种抑制剂的抑制效果强弱为EZ>AZ>Van,说明长茎葡萄蕨藻可以通过胞外CA间接利用HCO3-。此途径也是绝大多数大型海藻如绿藻中的石莼()[44]、缘管浒苔()[19]和浒苔()[28]以及肠浒苔()[42],红藻中的坛紫菜()[24]、菊花心江蓠()[45]、龙须菜()[46]、舌状蜈蚣藻()[32]及褐藻裙带菜()[31]、宣藻()[26]、海黍子(Yendo)[25]、羊栖菜()[47]等利用无机碳的最普遍和最基本的方式。此外,长茎葡萄蕨藻还存在依赖ATP酶主动转运HCO3-的利用途径。绿藻中的刚毛藻()[48]、褐藻中的萱藻丝状体[26]以及掌状海带()和糖海带()[27]也发现此HCO3-利用途径,但其具体机制还有待进一步研究。EZ和AZ的抑制作用统计学上无显著差异(> 0.05),此研究结果与程苗等[25]对海黍子的研究结果一致。造成这一结果的原因可能是EZ抑制胞外CA活性导致进入细胞内部的无机碳减少,使得EZ对胞外CA的抑制效果遮盖了其对胞内CA的抑制效果[25]。综上,长茎葡萄蕨藻能利用HCO3-作为无机碳源进行光合作用,且对HCO3-的利用方式有两种:1)通过胞外碳酸酐酶(CA)催化HCO3-水解为CO2,CO2扩散进入细胞的间接吸收利用方式;2)依赖细胞膜上ATP酶主动转运HCO3-,再由胞内CA水解为CO2的直接利用途径。由于Van的抑制效果最差,长茎葡萄蕨藻主要以方式1)利用HCO3-。
在3种实验温度条件下,20 ℃下各抑制剂的抑制作用最大,其次为30 ℃,25 ℃最小,但3者抑制率无显著差别(> 0.05),这表明温度对长茎葡萄蕨藻吸收利用无机碳没有明显影响,但低温或高温均会降低长茎葡萄蕨藻对无机碳的吸收利用。25 ℃是较适宜长茎葡萄蕨藻生长和进行光合作用的温度,温度变化并没有改变长茎葡萄蕨藻利用HCO3-的方式。徐军田等[19]研究温度(5、10、15、20、25 和 30℃)对两种浒苔无机碳利用机制的影响,得出两种浒苔在不同温度下无机碳的转运方式不同,且存在着明显的种间差异,但浒苔在温度为10~30 ℃时无机碳利用方式相同。本研究结果与其相似,这可能是因为温度变化对参与长茎葡萄蕨藻光合作用过程的各种酶活性影响不大,因此在20~30 ℃长茎葡萄蕨藻的无机碳利用方式相同。
4 结论
海水体积、藻体部位、藻体质量和照度均对长茎葡萄蕨藻的pH补偿点无影响,但藻体质量和照度会影响达到pH补偿点的时间,在一定范围内藻体质量越大或照度越强,达到pH补偿点时间越短。长茎葡萄蕨藻除了可以利用海水中的游离CO2外,还能利用HCO3-作为无机碳源进行光合作用。温度(20~30 ℃)对长茎葡萄蕨藻吸收利用无机碳没有明显影响,且3种温度下长茎葡萄蕨藻无机碳的利用方式相同。
[1] 吴启藩, 刘东超, 丁丹勇, 等. 不同LED光质对长茎葡萄蕨藻生长及光合色素的影响[J]. 广东海洋大学学报, 2017, 37(6): 43-50.
[2] 姜芳燕, 宋文明, 杨宁, 等. 海南长茎葡萄蕨藻的营养成分分析及评价[J]. 食品工业科技, 2014, 35(24): 356-359.
[3] PAUL N A, NEVEUX N, MAGNUSSON M, et. al. Comparative production and nutritional value of “sea grapes” — the tropical green seaweedsand[J]. J Appl Phycol, 2014, 26(4): 1833-1844.
[4] 唐贤明, 刘小霞, 孟凡同, 等. 海马齿和长茎葡萄蕨藻的营养成分分析及评价[J]. 热带生物学报, 2018, 9(2): 129-135.
[5] 王波, 郑风荣, 王欣, 等. 长茎葡萄蕨藻和冈村蕨藻的营养成分分析及评价[J]. 营养学报, 2018, 40(5): 515-517.
[6] REIKO MAEDA T I, IHARA H. Immunbstimulatory activity of polysaccharides isolated fromon macrophage Cells[J]. Biosci Biotechnol Biochem, 2012, 76(3): 501-505.
[7] SHARMA B R, RHYU D Y. Anti-diabetic effects of: stimulation of insulin secretion in pancreatic β-cells and enhancement of glucose uptake in adipocytes[J]. Asian Pac J Trop Biomed, 2014, 4(7): 575-580.
[8] NAGAPPAN T, VAIRAPPAN C S. Nutritional and bioactive properties of three edible species of green algae, genus Caulerpa (Caulerpaceae)[J]. J Appl Phycol, 2014, 26(2): 1019-1027.
[9] APIRATIKUL R, PAVASANT P. Batch and column studies of biosorption of heavy metals by[J]. Bioresource Technol, 2008, 99(8): 2766-2777.
[10] PIMOL P, KHANIDTHA M, PRASERT P. Influence of particle size and salinity on adsorption of basic dyes by agricultural waste: dried Seagrape ()[J]. J Environ Sci, 2008, 20(6): 760-768.
[11] 殷小龙. 马氏珠母贝室内循环养殖系统初步研究[D]. 海南: 海南大学, 2015.
[12] 高桦楠, 李乐, 郑兴, 等. 循环水系统内马氏珠母贝与3种大型藻类的混养状况及水质分析[J]. 热带生物学报, 2016, 7(2): 147-152.
[13] LIU H, WANG F, WANG Q, et al. A comparative study of the nutrient uptake and growth capacities of seaweedsand[J]. J Appl Phycol, 2016, 28(5): 3083-3089.
[14] 叶启旺. 长茎葡萄蕨藻室内水泥池与自然海区养殖对比试验[J]. 水产养殖, 2018, 39(3): 7-9.
[15] 周文川, 赵秋龙, 雷美华, 等. 光照等环境因子对长茎葡萄蕨藻生长的影响[J]. 海洋与渔业, 2017 (6): 70-72.
[16] 王海阳, 唐贤明, 金月梅, 等. 长茎葡萄蕨藻培养条件的研究[J]. 海洋湖沼通报, 2017 (6): 129-136.
[17] 赵岩. 海葡萄人工规模养殖技术的研究[D]. 海南: 海南大学, 2016.
[18] POSCHENRIEDER C, FERNáNDEZ J, RUBIO L, et al. Transport and use of bicarbonate in plants: Current knowledge and challenges ahead[J]. Int J Mol Sci, 2018, 19(5): 1352-1376.
[19] 徐军田, 王学文, 钟志海, 等. 两种浒苔无机碳利用对温度响应的机制[J]. 生态学报, 2013, 33(24): 7892-7897.
[20] FERNáNDEZ P A, HURD C L, ROLEDA M Y. Bicarbonate uptake via an anion exchange protein is the main mechanism of inorganic carbon acquisition by the giant kelp(Laminariales, Phaeophyceae) under variable pH[J]. J Phycol, 2015, 50(6): 998-1008.
[21] GIORDANO M, BEARDALL J, RAVEN J A. CO2concentrating mechanisms in algae: mechanisms, environmental modulation, and evolution[J]. Annu Rev Plant Biol, 2005, 56(1): 99-131.
[22] RAVEN J A, BEARDALL J, GIORDANO M. Energy costs of carbon dioxide concentrating mechanisms in aquatic organisms[J]. Photosynth Res, 2014, 121(2/3): 111-124.
[23] RAVEN J A. Ecophysiology of photosynthesis in macroalgae[J]. Photosynth Res, 2012, 113(1/2/3): 105-125.
[24] 王淑刚, 杨锐, 周新倩, 等. 高温胁迫下坛紫菜()对无机碳的利用[J]. 海洋与湖沼, 2013, 44(5): 1378-1385.
[25] 程苗, 吴海一, 詹冬梅, 等. 海黍子对外源无机碳利用机制的初步研究[J]. 植物生理学报, 2015, 51(5): 679-685.
[26] 王吉, 宫相忠, 高伟, 等. 萱藻丝状体对无机碳的利用[J]. 水产学报, 2017, 41(9): 1400-1406.
[27] KLENELL M, SNOEIJS P, PEDERSéN M. Active carbon uptake inand(Phaeophyta) is driven by a proton pump in the plasma membrane[J]. Hydrobiologia, 2004, 514(1/2/3): 41-53.
[28] 李信书. 浒苔和条斑紫菜光合生理对几种生态因子的响应[D]. 上海: 上海海洋大学, 2012.
[29] 邹定辉, 高坤山. 坛紫菜光合作用对重碳酸盐的利用[J]. 科学通报, 2002, 47(12): 926-930.
[30] ZOU D H. The effects of severe carbon limitation on the green seaweed,(Chlorophyta)[J]. J Appl Phycol, 2014, 26(6): 2417-2424.
[31] ZHANG X, HU H, TAN T. Photosynthetic inorganic carbon utilization of gametophytes and sporophytes of(Phaeophyceae)[J]. Phycologia, 2006, 45(6): 642-647.
[32] JIANG H, ZOU D H, LI X H. Growth, photosynthesis and nutrient uptake by(Halymeniales, Rhodophyta) in response to different carbon levels[J]. Phycologia, 2016, 55(4): 462-468.
[33] KEVEKORDES K, HOLLAND D, HAUBNER N S, et al. Inorganic carbon acquisition by eight species of Caulerpa (Caulerpaceae, Chlorophyta)[J]. Phycologia, 2006, 45(4): 442-449.
[34] 岳国峰, 王金霞, 王建飞, 等. 海带幼孢子体的光合碳利用[J]. 海洋与湖沼, 2001, 32(6): 647-652.
[35] MABERLY S C. Exogenous sources of inorganic carbon for Photosynthesis by marine macroalgae[J]. J Phycol, 1990, 26(3): 439-449.
[36] MILLERO F J, GRAHAM T B, HUANG F, et al. Dissociation constants of carbonic acid in seawater as a function of salinity and temperature[J]. Mar Chem, 2006, 100(1): 80-94.
[37] DICKSON A G. Standard potential of the reaction: AgCl(s)+12H2(g)=Ag(s)+HCl(aq), and the standard acidity constant of the ion HSO4-in synthetic sea water from 273.15 to 318.15 K[J]. J Chem Thermodyn, 1990, 22(2): 113-127.
[38] PIERROT D, LEWIS E, WALLACE D W R.: MS Excel program developed for CO2system calculations, ORNL/CDIAC-105a, Carbon Dioxide Information Analysis Center[CP]. Oak Ridge National Laboratory, US Department of Energy, Oak Ridge, Tennessee, 2006.
[39] 岳国峰, 周百成. 条斑紫菜对无机碳的利用[J]. 海洋与湖沼, 2000, 31(3): 246-251.
[40] MURRU M, SANDGREN C D. Habitat matters for inorganic carbon acquisition in 38 species of red macroalgae (Rhodophyta) from Puget Sound, Washington, USA[J]. J Phycol, 2010, 40(5): 837-845.
[41] CARLBERG S, AXELSSON L, LARSSON C, et al. Inducible CO2concentrating mechanisms in green seaweeds I. Taxonomical and physiological aspects[M]. Current Research in Photosynthesis, 1990: 3323-3326.
[42] CHRISTER L, LENNART A, HANS R, et al. Photosynthetic carbon utilization by(Chlorophyta) from a Swedish rockpool[J]. Eur J Phycol, 1997, 32(1): 49-54.
[43] CHRISTER L,LENNART A. Bicarbonate uptake and utilization in marine macroalgae[J]. Eur J Phycol, 1999, 34(1): 79-86.
[44] AXELSSON L, RYBERG H, BEER S. Two modes of bicarbonate utilization in the marine green macroalga[J]. Plant Cell Environ, 1995, 18(4): 439-445.
[45] 王文磊. 菊花心江蓠无性系构建及其不定芽诱导和固碳机制的研究[D]. 厦门: 厦门大学, 2016.
[46] ZOU D H, XIA J R, YANG Y F. Photosynthetic use of exogenous inorganic carbon in the agarophyte(Rhodophyta)[J]. Aquaculture, 2004, 237: 421-431.
[47] ZOU D H, GAO K S, XIA J R. Photosynthetic utilization of inorganic carbon in the economic brown alga,(Sargassaceae) from the South China Sea[J]. J. Phycol, 2003, 39(6): 1095-1100.
[48] CHOO K S, SNOEIJS P, PEDERSéN M. Uptake of inorganic carbon by(Chlorophyta) from the Baltic Sea[J]. J Phycol, 2002, 38(3): 493-502.
Utilization of Inorganic Carbon ofunder Different Temperature
HUANG Dan1,2, LIU Dong-chao1,2, WANG Xiao-liang1,2, LIN Ting1, HUANG Xiao-jian1, OUYANG Zhao-pan1
(1./ 2.,524088,)
【】To evaluate the utilization of inorganic carbon by.【】The effects of algal weight, algal body parts, irradiance and seawater volume on pH compensation point were explored by using the pH drift technology, and the effects of four inhibitors acetazolamide(AZ), 6-ethoxyzolamide(EZ), 4,4'-diisothiocyano- stilbene-2,2'-disulfonate(DIDS), vanadate(Van)on the utilization of inorganic carbon inunder three different temperatures (20 , 25, 30 ℃)were analyzed.【】The results showed that algae weight, algal body parts, irradiance, and seawater volume had no significant effect on the pH compensation points(> 0.05). The greater the weight of the algae or the greater the irradiance within a certain range, the shorter the time required to reach the pH compensation point which is greater than the pH compensation point 9. The inhibitory effect of each inhibitor was highest at 20 ℃, followed by 30 ℃ and 25 ℃, but there was no significant difference between the inhibitors at different temperatures(> 0.05). Among the four inhibitors, DIDS had no significant effect on the pH compensation point and inorganic carbon utilization of(> 0.05), and the inhibition effects of the remaining three inhibitors were as follows: EZ>AZ>Van.【】The algae weight, algal body parts, irradiance, and seawater volume had no effect on the pH compensation point of.The temperature had no significant effect on the utilization of inorganic carbon by, and HCO3-can be used as an inorganic carbon source for photosynthesis by.
; pH compensation point; inorganic carbon utilization; temperature; inhibitors
S968.4
A
1673-9159(2019)03-0061-09
10.3969/j.issn.1673-9159.2019.03.009
2019-2-12
广东省科技计划项目(2015A020209167)
黄丹(1991—),女,硕士研究生,主要从事藻类生理生态学研究。E-mail: gdouhd@163.com
刘东超(1963—),男,副教授,主要从事藻类生理生态学研究。E-mail: liudc@gdou.edu.cn
黄丹,刘东超,王晓梁,等. 不同温度下长茎葡萄蕨藻无机碳利用[J]. 广东海洋大学学报,2019,39(3):61-69.
(责任编辑:刘朏)
--先进无机材料论坛例记(Ⅰ)

