黑果小檗果实的色素提取与纯化工艺
谭为 张兰兰 庞市宾 孙玉华
基金项目:新疆地产中药民族药新药研发培育项目(项目编号:2017-02-01)。
作者简介:谭为(1983-),女,汉族,硕士,副研究员,研究方向为民族医药与食品研发。E-mail:tw21cn@163.com
通信作者:孙玉华(1965-),男,汉族,硕士,研究员,研究方向为民族医药与食品研发。E-mail:1641636482@qq.com
【摘 要】 目的:研究黑果小檗果实中色素的提取工艺以及大孔树脂分离纯化的工艺条件及参数。方法:采用静态吸附实验和动态吸附实验等考察了大孔树脂AB-8对黑果小檗果实色素纯化效果及影响因素。结果:0.5%HCl-70%乙醇6倍量,超声提取3次,每次0.5 h;采用动态吸附,上样浓度为1.612 g生药/g树脂(湿重),去离子水除杂洗脱6BV后,洗脱剂pH为4的70%乙醇洗脱6BV,流速为1mL/min,进行吸附和洗脱,测定黑果小檗果实中色素的色价可达725.78±9.90,洗脱率可达到95%以上。结论:该方法高效、稳定、可行,为黑果小檗果实中色素分离纯化工业化生产提供基础数据。
【关键词】 黑果小檗果实;色素;色价;大孔吸附树脂;纯化
【中图分类号】R284.2 【文献标志码】 A【文章编号】1007-8517(2019)7-0042-05
Abstract:Objective To study the extraction process of Berberis heteropoda Schrenk fruit pigmentand the technical conditions and parameters for separation ofmicroporous resin.Method Using static adsorption experiment and dynamic adsorption experiment, the effect of AB-8 on Berberis heteropoda Schrenk fruit pigment purification and its influencing factors were investigated.Result 0.5%HCl-70%ethanol 6 times, Ultrasonic extraction 3 times,0.5h each time;Dynamic adsorption; The concentration was 1.612g /g resin (wet weight),6BV deionized water is used to remove impurities.The pH of the eluent is 4, and the concentration of ethanol is 70%, 6BV.The flow rate of 1mL/min, adsorption and elution.The color value of Berberis heteropoda Schrenk fruit pigment was 725.78±9.90, and the elution rate was above 95%.Conclusion The method is efficient, stable and feasible, and provides basic data for Berberis heteropoda Schrenk fruit pigment separation and purification of industrial production.
Keywords: Berberis heteropoda Schrenk fruit;Pigmen;Color value;Microporous Resin; Purification
新疆哈萨克民族药黑果小檗(Berberis heteropoda Schrenk)为小檗科(Berberidaceae) 小檗属 (Berberis L .)多年生灌木[1-2]。主要分布在新疆山区,资源十分丰富,其茎皮及根含小檗碱,果实含葡萄糖、果糖、多种人体所需的维生素、有机酸、微量元素和色素类等物质,在新疆民族药中用于治疗痢疾、肠炎、咽炎、湿疹、高血压、高血脂等疾病。在民间,黑果小檗果实长期以来被哈萨克族和维吾尔族人民晾干泡茶饮用,是一种具有较高经济价值的药食两用的野生植物[3]。由于天然色素类具有一定的营养和生理活性而广泛应用于食品、化妆品和医药领域。因此,本实验拟通过对黑果小檗果实中的色素进行提取与纯化工艺研究,为黑果小檗果实中的色素进一步开发利用提供基础数据。
1 材料与仪器
1.1 材料 黑果小檗果实Berberis heteropoda Schrenk(采集自新疆乌鲁木齐南山的山坡河谷,由新疆药物研究所何江副研究员鉴定为小檗科小檗属落叶灌木黑果小檗)。
1.2 仪器与试剂 岛津UV-2501PC紫外可见分光光度计(日本岛津有限公司);BS124S型电子天平(赛多利斯科学仪器(北京)有限公司);HH-S4數显恒温水浴锅(金坛市医疗仪器厂);AS10200AD超声波清洗器(天津奥特赛恩斯仪器有限公司);202-IES电热恒温干燥箱(北京市永光明医疗仪器厂)。大孔吸附树脂AB-8(青岛海洋化工厂);其余试剂均为分析纯。
2 实验方法
2.1 黑果小檗果实色素提取工艺研究
2.1.1 色素测定方法
2.1.1.1 色素提取 精密称取黑果小檗果实2.00g,加规定量的水在规定温度的水浴中回流提取不同时间,共提取3次,提取液合并,过滤至100mL量瓶中,用提取溶剂定容至刻度,摇匀备用。
2.1.1.2 色价法[4]测定黑果小檗果实色素 精密量取1.0mL提取溶液,加pH3.0的HCl缓冲溶液定容到25mL,混匀,以1.0mL溶剂同法定容至25mL容量瓶做空白,室温下用紫外分光光度计于200~600nm范围内扫描,测定其特征吸收光谱,以确定最大吸收波长。按下式计算:E=A×f/m。式中,E:色价,U/g;A:稀释后峰值下的吸光度;m:取样量,g;f:样品溶液的稀释倍数。
2.1.2 提取溶剂的考察 取黑果小檗果实,粗粉,分别加0.5%HCl-水、0.5%HCl-30%乙醇、0.5%HCl-50%乙醇、0.5%HCl-70%乙醇、0.5%HCl-95%乙醇10倍量,回流提取2次,每次2h,合并提取液,过滤至100mL量瓶中,用提取溶剂定容至刻度,测定吸光度,根据计算色价优选出最佳提取溶剂。
2.1.3 提取方法的考察 取黑果小檗果实,粗粉,加入优选出的最佳提取溶剂,分别采用回流提取、超声提取、浸泡提取2次,每次2h,合并提取液,过滤至100mL量瓶中,用提取溶剂定容至刻度,测定吸光度,根据计算色价优选出最佳提取方法,
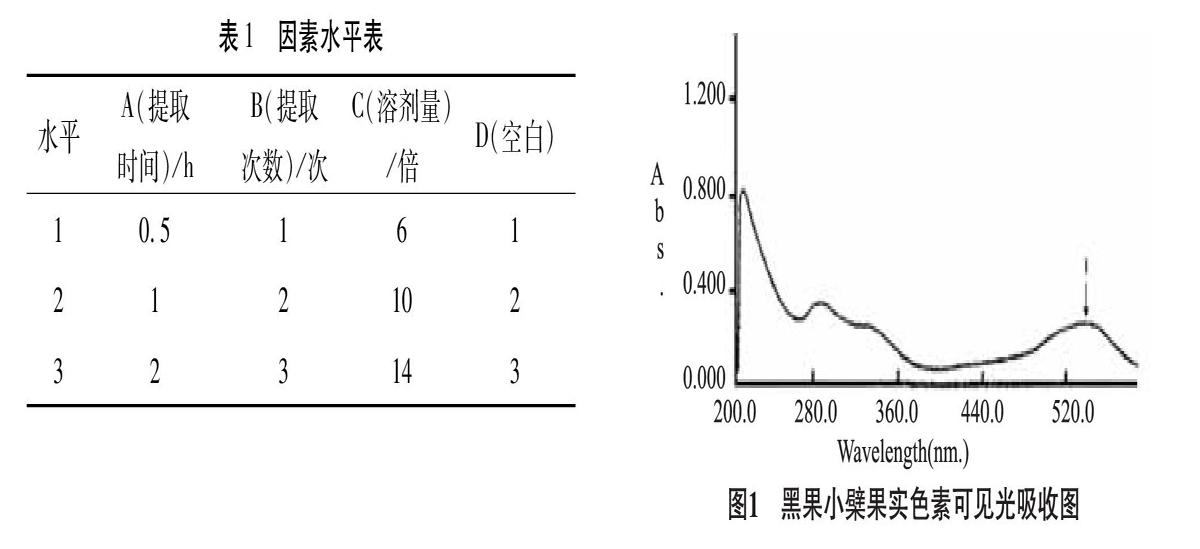
2.1.4 正交试验 拟通过考察不同提取时间、提取次数以及提取溶剂的量对黑果小檗果实色素含量的影响。见表1。
试验方法为称取黑果小檗果实,粉碎,按照优选出的最佳提取溶剂和提取方法以及表1规定的各参数提取,过滤,取滤液测定吸光度,采用方差分析处理数据,优选出最佳提取工艺。
2.1.5 验证试验 按最佳提取工艺操作3次。
2.2 黑果小檗果实色素纯化工艺研究
2.2.1 大孔树脂的预处理 取AB-8大孔树脂分别装柱,用水洗去细小树脂及破碎树脂,然后分别用95%乙醇浸泡24 h,充分溶胀,用乙醇洗至溶液加适量蒸馏水无白色浑浊现象时为止,最后用蒸馏水洗至无醇味备用。
2.2.2 黑果小檗果实色素提取液的制备 取黑果小檗果实,粉碎,按最佳提取工艺提取,过滤,备用。
2.2.3 大孔吸附树脂的静态与动态吸附的筛选
动态吸附:大孔吸附树脂动态吸附实验。精密称取已处理好的树脂10g,装入直径2.0cm的洗脱柱中,各加入100mL样品液,以1.0mL/min的流速上样,上样流出液反复上样5次,收集上样流出液。再以70%乙醇100mL,以1.0mL/min的流速洗脱,收集洗脱液浓缩至干。
静态吸附:称取大孔树脂10g,分别置250mL三角瓶中,加样品溶液100mL,每隔5min振摇10s,持续2h,然后静置24h,充分吸附后,滤过,测定吸附前溶液中黑果小檗果实色素的吸光度值后,将吸附后的树脂装入层析柱中,先以水洗脱除杂,再以100mL 70%乙醇溶液解吸,测定解吸液中黑果小檗果实色素的吸光度值。
2.2.4 纯化工艺参数的筛选 通过上述实验,继续对乙醇浓度、吸附流速、最大上样量、洗脱剂用量、上柱液pH值、洗涤除杂用水量进行考察,选择黑果小檗果实色素的最佳纯化工艺参数。
3 结果与分析
3.1 黑果小檗果实色素提取工藝研究
3.1.1 黑果小檗果实色素可见光吸收特性 据图1可知,黑果小檗果实在可见区535nm处有最大吸收,故选择535nm作为黑果小檗果实色素的测定波长。
3.1.2 提取溶剂的考察 结果表明,采用水提取时色素含量最高,当乙醇浓度大于70%时,色价变小,因此选定0.5%HCl-70%乙醇提取作为黑果小檗果实色素的最佳提取溶剂。见表2。
3.1.3 提取方法的考察 结果表明,采用超声法提取时色素吸光度值最高,因此选定超声提取法作为黑果小檗果实色素的最佳提取方法。见表3。
3.1.4 正交试验 由表4和表5可知,RA>RC>RD>RB,提取时间之间存在显著差异,最佳提取工艺为A1 B3 C1 D2/A1 C1 D2 B3,所以应采用6倍量的0.5%HCl-70%乙醇,超声提取3次,每次提取时间为0.5 h。
3.1.5 验证试验 按最佳提取工艺操作3次。测定色素色价分别为(438.94±1.89)、(435.87±5.10)、(428.52±4.71)U/g,RSD=1.11%。结果表明该提取工艺为:0.5%HCl-70%乙醇6倍量,超声提取3次每次0.5h效果最佳,工艺稳定可行。
3.2 黑果小檗果实色素纯化工艺研究
3.2.1 大孔吸附树脂的静态与动态吸附的筛选 测定动态吸附后的上样流出液测得色素色价为(543.33±7.37)U/g,而静态吸附后解吸液中黑果小檗果实色素的色价为(486.33±3.21)U/g。通过比较色价可知,动态吸附与静态吸附相比,效果更佳。
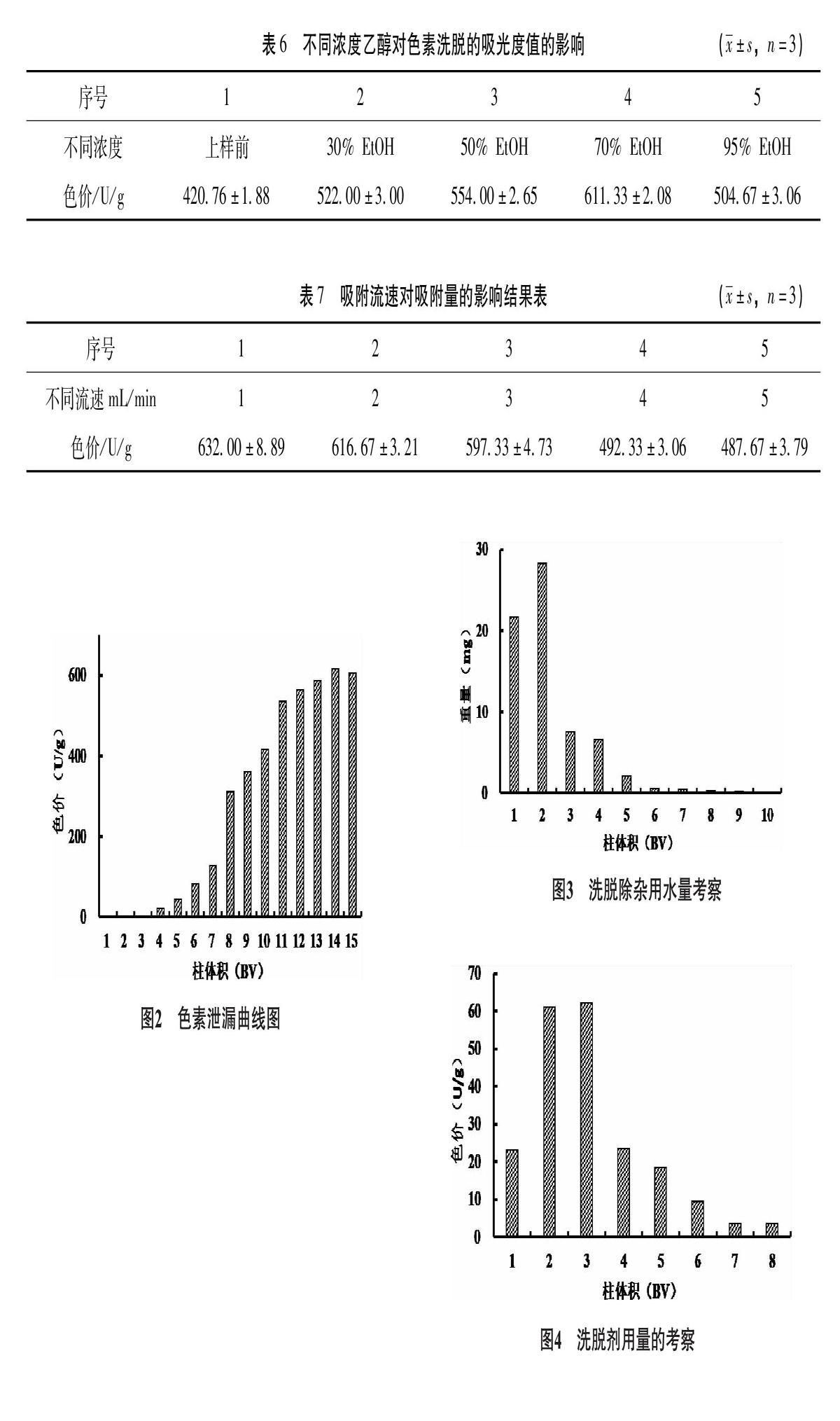
3.2.2 乙醇浓度的确定 精密称取4份优选出的树脂,每份10g,湿法装柱,分别精密吸取一定浓度的提取液分别上柱,以蒸馏水洗至无色,再分别用30%、50%、70%、95%乙醇(V∶[KG-*3/5]V) 150mL洗脱,分别收集洗脱液,由表6可知,70%乙醇洗脱效果更佳。
3.2.3 吸附流速的确定 将一定浓度的黑果小檗果实提取液100mL通过已处理好的装有优选树脂的吸附柱里,分别以1、2、3、4、5mL/min的流速进行动态吸附,以黑果小檗果实色素含量为指标,结果见表7,流速为1mL/min吸光度值最佳。
3.2.4 最大上样量的考察 将一定浓度的黑果小檗果实色素提取液150mL缓慢加入装有优选树脂的玻璃柱中,树脂量为10mL/g,流速为1.0mL/min,每树脂床体积(Bed voLume,BV)即10mL收集1个流分,测定色素含量,结果见图2。由图2可知,从第4流分开始,色素出现少量泄漏,随着流分数的增加至第8BV时色价明显增高,说明AB-8树脂对色素的吸附量达到饱和。考虑到生产工艺中要避免造成色素的泄漏,拟定最大上样量为1.612g生药/g树脂(湿重)。
3.2.5 洗涤树脂用水量的考察 称取AB-8型干树脂10g,置直径为2cm的洗脱柱中,加入100mL样品液,水以1mL/min的速度洗脱,每10mL单独收集;至洗脱液无色,水洗脱液分别浓缩干燥至恒重后称重,见图3。由图3可知,用水量为6BV时,大部分杂质已被洗脱,因此采用6倍量柱体积的去离子水除杂。
3.2.6 洗脱剂用量的考察 将已吸附好的黑果小檗果实提取液的优选树脂10g,用蒸馏水洗脱8BV后,再用70%乙醇洗脱每树脂床体积(10mL)为一个考察单位,至洗脱液近无色,共收集5份,分别测定各BV洗脱液中色素的含量,见图4。由图4可知,前4BV70%乙醇洗脱液可将绝大部分色素洗脱下来,第7BV洗脱液中色素含量已极低。故确定洗脱剂用量为6BV。
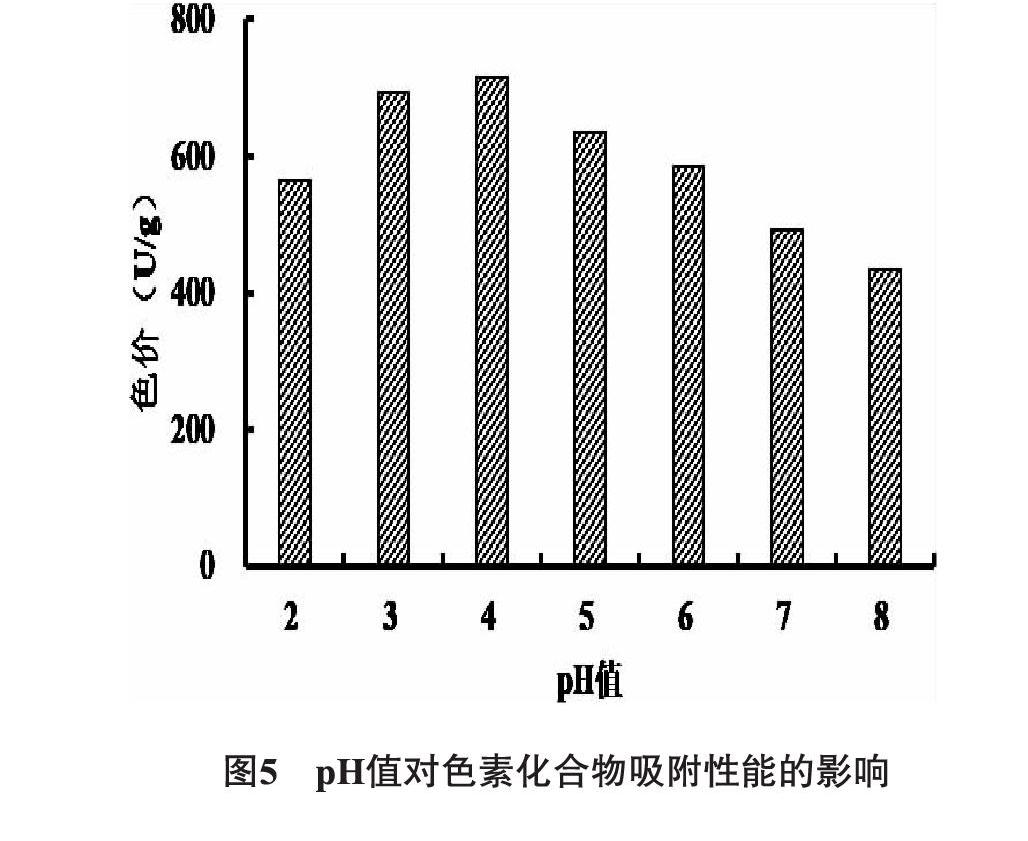
3.2.7 上柱液pH值对动态吸附性能的影响 色素化合物为多羟基酚类化合物,具有一定的极性和酸性,所以上柱液pH值对黑果小檗果实色素化合物的吸附效果会有一定影响。室温25 ℃,采用一定量的黑果小檗样品液上柱,加0.05%盐酸调节上柱液的pH为2.0,3.0,4.0,5.0,6.0,7.0,8.0,在相同条件下以1 mL/min的流速进行动态吸附,见图5。由图5表明,上柱液的pH值对黑果小檗果实色素化合物吸附有较大的影响,pH为2.0时吸附量较低,因为上柱液酸性太强,色素化合物容易转变为佯盐,不易被吸附,从而影响到吸附量;pH-4左右时吸附量最大,因为此时的酸度正好能使色素化合物在溶液中保持分子形式,容易被吸附。因此动态吸附时应调节上柱液pH为4进行吸附。
3.3 验证实验 按上述纯化工艺操作3次,测得黑果小檗果实色素的色价分别为:(717.33±1.53)、(723.33±3.21)、(736.67±3.21),RSD=1.36%。结果表明,方法为:上样浓度为1.612g生药/g树脂(湿重),除杂采用6个柱体积,洗脱剂pH为4的70%乙醇洗脱6个柱体积,流速为1mL/min,方法稳定,工艺可行。
4 结论
本实验首先通过单因素法优选提取溶剂和提取方法,然后通過正交实验法考察不同提取时间、提取次数以及提取溶剂的量对黑果小檗果实色素含量的影响,最终选择了提取工艺为:6倍量0.5%HCl-70%乙醇,超声提取3次,每次0.5h,测定黑果小檗样品中色素的色价可达(434.78±4.80),RSD=1.11%,提取工艺稳定可行。
本实验通过采用静态吸附实验和动态吸附实验等考察了大孔树脂AB-8对黑果小檗果实色素纯化效果及影响因素,优选黑果小檗果实色素的提取工艺为0.5%HCl-70%乙醇6倍量,超声提取3次每次0.5h,优选纯化工艺为动态吸附,最大上样浓度为1.612g生药/g树脂(湿重),去离子水除杂洗脱6BV后,洗脱剂pH为4的70%乙醇洗脱6BV,流速为1mL/min,进行吸附和洗脱,测定黑果小檗样品中色素的色价可达(725.78±9.90),洗脱率可达到95%以上,该方法高效、稳定、可行,为黑果小檗果实中色素分离纯化工业化生产提供基础数据。
参考文献
[1]新疆维吾尔自治区卫生厅. 维吾尔药材标准[M]. 乌鲁木齐: 新疆科技卫生出版社, 1993: 24-26.
[2]新疆植物志编辑委员会. 新疆植物志(第二卷第二分册)[M].乌鲁木齐:新疆科技卫生出版社,1995: 1-5.
[3]王仁. 哈萨克药志(第2册)[M].乌鲁木齐:新疆科学技术出版社,2009: 96.
[4]马自超,庞业珍.天然食用色素化学及生产工艺学[M]. 北京:中国林业出版社,1996:60-92.
[5]于俊林 ,杨文娣. 小檗碱的植物资源[J]. 中草药, 2005,36 (9):1434-1436.
[6]刘嫫心. 沙漠植物志(第一卷)[M]. 北京: 科学出版社, 1985:514.
(收稿日期:2019-01-31 编辑:陶希睿)

