参黄搽剂的质量标准研究Δ
江洁怡,李素梅,胥爱丽,李养学(广东省中医药工程技术研究院/广东省中医药研究开发重点实验室,广州510095)
参黄搽剂为本院院内制剂,由苦参、黄柏、大黄、黄芩、冰片五味中药经水煎浓缩后制备而成,具有清热燥湿、解毒止痒等作用,用于治疗皮炎、接触性皮炎、痤疮及毛囊炎等病,症见皮肤红肿、瘙痒渗液,症属湿热毒蕴者均适用。作为方中君药,苦参具有多种药理活性,如抗病原微生物、抗炎、抗过敏、调节免疫和神经等[1],而苦参碱和氧化苦参碱作为苦参中的主要药效成分,具有抗过敏[2]、抑菌[3-4]、抗病毒[5-6]、抗炎[7]、抗心律失常[8]、抗肿瘤[9]、抗纤维化[10]等作用。黄柏具有降血压、抑菌、抗癌等药理活性[11],大黄具有泻下、止血、抗炎、抗氧化等药理活性[12],黄芩具有抑菌、抗癌、抗氧化、抗病毒、抗炎等药理活性[13-14],以上三药共为臣药,共同发挥增强君药清热解毒、燥湿的作用。冰片为使药,具有抑菌、消炎镇痛等药理活性,且冰片作为常用的佐使药,与其他药味配伍时,能起到提高药物生物利用度的作用[15-16]。本制剂在临床应用多年,疗效确切,但其质量标准较低。现有质量标准仅对苦参、大黄两味药材进行薄层鉴别[17],为了有效地控制该制剂质量,确保临床用药的安全性和有效性,本研究拟采用薄层鉴别法(TLC)对该制剂中苦参、黄柏、大黄、黄芩四味药材进行定性鉴别,同时采用高效液相色谱法(HPLC)测定方中苦参碱和氧化苦参碱的含量,为其质量标准的制订提供参考。
1 材料
1.1 仪器
1260型HPLC仪(美国Agilent公司);TLC SAMPLER 4型自动点样仪、Reprostar 3薄层成像系统(瑞士Camag公司);XS205 DU型电子分析天平(美国Mettler-Toledo公司);HWS-26型电热恒温水浴锅(重庆金控科技有限公司);DHG-9203A型电热恒温鼓风干燥箱(上海精宏实验设备有限公司);Micro 17R型微量离心机(美国Thermo公司);KQ-700DE型超声波清洗器(昆山市超声仪器有限公司);Milli-QAdvantage型A10自动纯水机(美国Millipore公司)。
1.2 药品与试剂
参黄搽剂(由广东省中医药工程技术研究院提供,批号:180604、180605、180606,规格:每瓶装30 mL,每1 mL含生药82 mg);苦参对照药材(批号:121019-201708)、黄柏对照药材(批号:121510-201105)、大黄对照药材(批号:120984-201202)、黄芩对照药材(批号:120955-201309)、苦参碱对照品(批号:110805-201709,纯度:98.7%)、大黄酸对照品(批号:110757-201607,纯度:99.3%)、氧化苦参碱对照品(批号:110780-201508,纯度:92.5%)均购自中国食品药品检定研究院;硅胶G薄层板、硅胶H薄层板(青岛海洋化工厂);乙腈等液相用试剂为色谱纯,其余试剂均为分析纯,水为蒸馏水。
2 方法与结果
2.1 苦参、黄柏、大黄、黄芩的定性鉴别
2.1.1 苦参 取参黄搽剂25 mL,加浓氨水调pH为8~9,然后用三氯甲烷萃取2次,每次30 mL;取萃取后的三氯甲烷液,蒸干后残渣加三氯甲烷1 mL溶解,作为供试品溶液。另取苦参对照药材0.5 g,加水150 mL,加热微沸提取1 h,滤过并浓缩至约25 mL,加浓氨水调溶液pH为8~9,然后照供试品溶液处理法制成对照药材溶液。另取苦参碱对照品适量,加乙醇制成质量浓度为0.2 mg/mL的对照品溶液。按处方工艺制备缺苦参的阴性样品,同供试品溶液处理方法制成缺苦参的阴性对照溶液。照2015年版《中国药典》(后文简称“药典”)(四部)通则0502[18]中TLC法进行测定,吸取上述制备好的4种溶液各10µL,分别点于同一用1%NaOH溶液制备的硅胶G薄层板上,以甲苯-丙酮-甲醇(8∶3∶0.5,V/V/V)为展开剂,展开,取出晾干后,再以甲苯-乙酸乙酯-甲醇-水(2∶4∶2∶1,V/V/V/V,10℃以下放置)上层溶液为展开剂,展开,取出晾干,用碘化铋钾试液显色。结果,在供试品色谱图上,在与对照药材/对照品图谱相同位置上有对应斑点出现,且阴性对照无干扰,结果见图1。
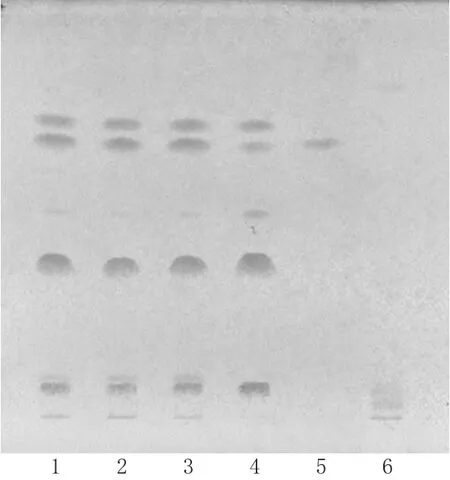
图1 苦参的TLC图Fig 1 TLC chromatograms of S.flavescens
2.1.2 黄柏 取黄柏对照药材0.1 g,加水约150 mL,加热微沸提取1 h,滤过并浓缩至约25 mL,加浓氨水调溶液pH至8~9,同“2.1.1”项下供试品溶液制备方法制成对照药材溶液。按处方工艺制备缺黄柏的阴性样品,同“2.1.1”项下供试品溶液制备方法制成缺黄柏的阴性对照溶液。照药典(四部)通则0502[18]中TLC法进行测定,吸取已制备好的2种溶液和“2.1.1”项下的供试品溶液各5µL,分别点于同一以0.5%羧甲基纤维素钠为黏合剂制备的硅胶G薄层板上,以三氯甲烷-甲醇-水(30∶15∶4,V/V/V,10℃以下放置)下层溶液作为展开剂,置于以氨气熏蒸预饱和的展缸中,展开,取出晾干,置于紫外光灯(波长为365 nm)下检视。结果,在供试品色谱图上,在与对照药材图谱相同位置上有对应斑点出现,且阴性对照无干扰,结果见图2。
2.1.3 大黄 取参黄搽剂15 mL,加盐酸1 mL,水浴回流30 min,立即冷却,用乙醚萃取2次,每次20 mL;取萃取后的乙醚溶液,蒸干后加三氯甲烷1 mL溶解,得供试品溶液。另取大黄对照药材0.3 g,加水150 mL,加热微沸提取1 h,滤过并浓缩至约15 mL,再加盐酸1 mL,然后按供试品溶液制备方法制成对照药材溶液。另取大黄酸对照品适量,加甲醇制成质量浓度为1 mg/mL的对照品溶液。按处方工艺制备缺大黄的阴性样品,然后按供试品溶液制备方法制成缺大黄的阴性对照溶液。照药典(四部)通则0502[18]中TLC法进行测定,吸取制备好的供试品溶液、阴性对照溶液各8µL,对照药材溶液、对照品溶液各4µL,分别点于同一以0.5%羧甲基纤维素钠为黏合剂制备的硅胶H薄层板上,用石油醚(30~60 ℃)-甲酸乙酯-甲酸(15∶5∶1,V/V/V)的上层溶液作为展开剂,展开,取出晾干后,置于氨气中熏至斑点清晰,于紫外光灯(波长为365 nm)下检视。结果,在供试品色谱图上,在与对照药材图谱相同位置上有对应斑点出现,且阴性对照无干扰,结果见图3。
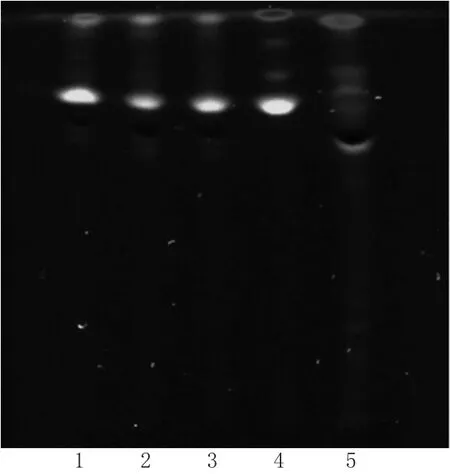
图2 黄柏的TLC图Fig 2 TLC chromatograms of P.chinense
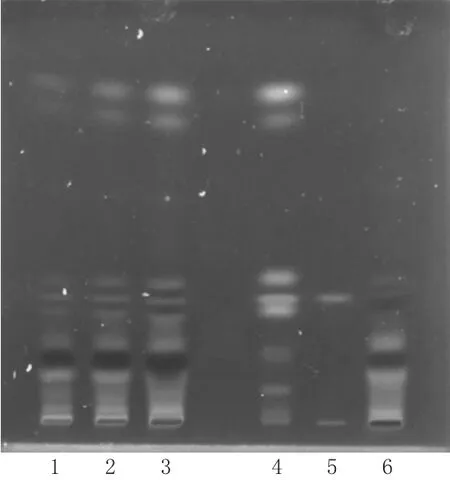
图3 大黄的TLC图Fig 3 TLC chromatograms of Rhei Radix Et Rhizoma
2.1.4 黄芩 取参黄搽剂20 mL,蒸至近干,加硅藻土适量吸附,蒸干,加乙酸乙酯20 mL,超声(功率:700 W,频率:40 kHz)提取30 min,滤过,蒸干后残渣加甲醇2 mL溶解,得供试品溶液。另取黄芩对照药材1 g,加水150 mL,加热微沸提取1 h,滤过并蒸至近干,加硅藻土适量吸附,蒸干,然后按供试品溶液制备方法制成对照药材溶液。按处方工艺制备缺黄芩的阴性样品,按供试品溶液制备方法制成缺黄芩的阴性对照溶液。照药典(四部)通则0502[18]中TLC法进行测定,吸取制备好的3种溶液各2µL,分别点于同一聚酰胺薄膜上,以甲苯-乙酸乙酯-甲醇-甲酸(10∶3∶1∶2,V/V/V/V)混合溶液为展开剂,置于展缸中预饱和30 min,取出晾干,于紫外光灯(波长为365 nm)下检视。结果,供试品色谱图上,在与对照药材图谱相同位置上有对应斑点出现,且阴性对照无干扰,结果见图4。
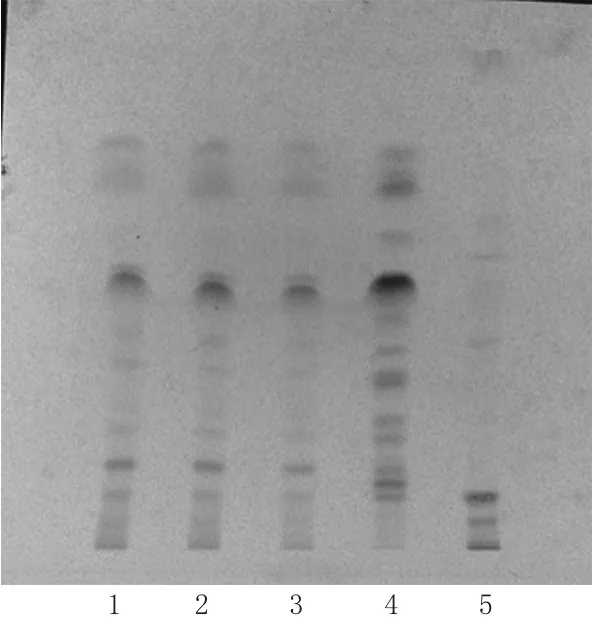
图4 黄芩的TLC图Fig 4 TLC chromatograms of S.baicalensis
2.2 苦参碱、氧化苦参碱的含量测定
2.2.1色谱条件色谱柱:Phenomenex Luna NH2(250 mm×4.6 mm,5 μm);流动相:乙腈-无水乙醇-3%磷酸水溶液(80∶10∶10,V/V/V);流速:1.0 mL/min;检测波长:220 nm;柱温:45 ℃;进样量:5 μL。
2.2.2 溶液的制备 (1)混合对照品溶液:分别精密称取苦参碱、氧化苦参碱对照品适量,用无水乙醇-乙腈(20∶80,V/V)溶液溶解,并制成苦参碱、氧化苦参碱质量浓度分别为407.20、420.15 μg/mL的单一贮备液,备用。分别取苦参碱、氧化苦参碱贮备液适量,加无水乙醇-乙腈(20∶80,V/V)溶液制成苦参碱、氧化苦参碱质量浓度分别为81.44、168.06 μg/mL的混合对照品溶液。(2)供试品溶液:精密量取离心(3 000 r/min,5 min)后的参黄搽剂上清液15 mL,加浓氨水0.5 mL,放置30 min,然后用三氯甲烷萃取5次,每次20 mL,末次萃取后收集萃取液离心破乳,合并三氯甲烷液,蒸干后残渣用无水乙醇溶解,并转移到5 mL量瓶中,加无水乙醇定容至刻度,摇匀,滤过,取续滤液,即得。(3)阴性对照溶液:按参黄搽剂处方工艺制备缺苦参的阴性样品,并按供试品溶液制备方法制成缺苦参的阴性对照溶液。
2.2.3 专属性试验 分别取混合对照品溶液、供试品溶液(样品批号:180604)、阴性对照溶液适量,按“2.2.1”项下色谱条件进样测定,记录色谱图。结果,以苦参碱、氧化苦参碱峰计的理论板数分别为3 333、6 407,分离度均>1.5,且阴性对照无干扰,表明该方法具有良好的专属性,色谱图见图5。

图5HPLC图Fig 5 HPLC chromatograms
2.2.4 线性关系考察 精密量取“2.2.2(1)”项下制备好的对照品贮备液适量,加乙腈-无水乙醇(80∶20,V/V)溶液分别制成每1 mL含苦参碱40.72、81.44、22.16、162.88、203.60、244.32 μg和含氧化苦参碱42.02、63.02、84.03、105.04、168.06 μg的混合对照品溶液。按“2.2.1”项下色谱条件进样测定,记录峰面积。以峰面积(y)对进样量(x)进行线性回归,得到苦参碱的回归方程为:y=0.458 0x-4.980 6(r=0.999 4),氧化苦参碱的回归方程为:y=0.514 2x-5.043 0(r=0.999 7)。结果显示,苦参碱、氧化苦参碱分别在进样量为203.60~1 221.60、210.08~840.30 ng范围内与其峰面积呈现出良好的线性关系。
2.2.5 检测限与定量限考察 采用逐步稀释法测定苦参碱、氧化苦参碱的检测限,以信噪比为3(S/N=3)得出检测限,以S/N=10得出定量限。结果显示,苦参碱、氧化苦参的检测限分别为50.90、57.30 ng,定量限分别为169.67、168.06 ng。
2.2.6 精密度试验 精密吸取制备好的同一供试品溶液(样品批号:180604)5 μL,按“2.2.1”项下色谱条件连续进样测定6次,记录峰面积。结果显示,苦参碱、氧化苦参碱峰面积的RSD分别为1.72%、2.23%(n=6),表明该色谱条件下方法精密度良好。
2.2.7 稳定性试验 精密吸取制备好的同一供试品溶液(样品批号:180604)5 μL,按“2.2.1”项下色谱条件,分别在制备样品后0、5、10、15、20、24 h进样,记录峰面积。结果显示,苦参碱、氧化苦参碱峰面积的RSD分别为1.55%、2.77%(n=6),均<3%,表明供试品溶液在24 h内稳定。
2.2.8 重复性试验 取同一批次参黄搽剂(样品批号:180604),按“2.2.2(2)”项下方法制备供试品溶液,平行6份,按“2.2.1”项下色谱条件进样测定,记录峰面积。结果显示,苦参碱、氧化苦参碱的平均含量分别为47.34、30.64 μg/mL,RSD 分别为 2.84%、2.89%(n=6),均<3%,表明该方法具有良好的重复性。
2.2.9 加样回收率试验 取已知含量的同一批次参黄搽剂(样品批号:180604)7.5 mL,分别按供试品含量的50%、100%、150%加入苦参碱、氧化苦参碱对照品,再按“2.2.2(2)”项下方法制备供试品溶液,每个浓度平行制备3份,按“2.2.1”项下色谱条件进样测定,记录峰面积并计算回收率。结果显示,苦参碱和氧化苦参碱的平均加样回收率分别为96.13%、100.93%,RSD分别为2.55%、2.69%(n=9),表明该方法准确度较好,结果见表1。
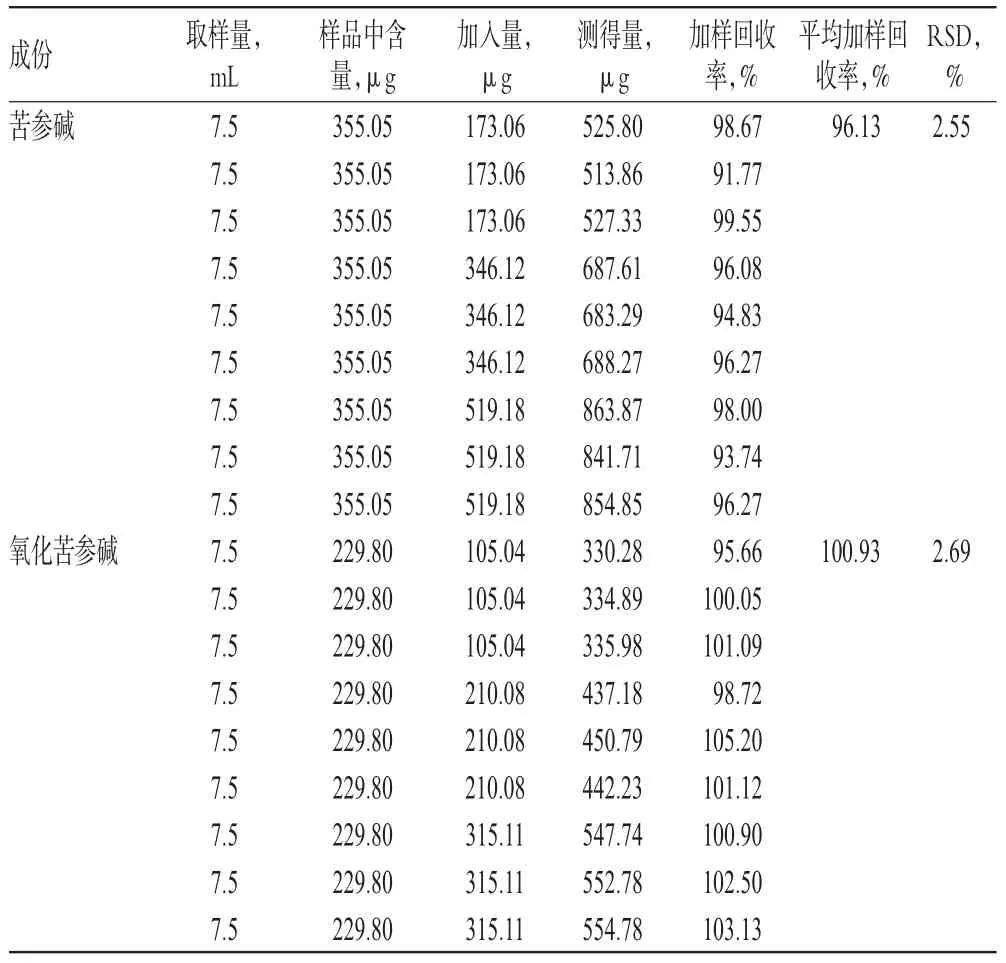
表1 回收率测定结果(n=9)Tab 1Determination results of relovery rate(n=9)
2.2.10 样品含量测定 分别精密吸取3个批次参黄搽剂的供试品溶液及混合对照品溶液各5 μL,按“2.2.1”项下色谱条件进样测定,每个样品测2次,记录峰面积并计算样品中苦参碱和氧化苦参碱的含量。结果显示,3个批次样品中苦参碱、氧化苦参碱的平均含量分别为46.98、31.02 μg/mL,平均总含量为78.00 μg/mL。根据3批样品含量测定结果可知,制剂中苦参碱和氧化苦参碱总量的平均值为2.34 mg/瓶,按平均含量的80%设限[19],初步拟定以苦参碱、氧化苦参碱总量计,每瓶制剂中不得少于1.87 mg。样品中苦参碱、氧化苦参碱含量测定结果见表2。
3 讨论
3.1 TLC鉴别方法的确定
本研究对参黄搽剂中苦参、黄柏、大黄、黄芩分别进行了TLC鉴别,所建立的鉴别方法分离度良好、无拖尾现象,且阴性对照无干扰,专属性强,能实现方中各药味的快速鉴别。苦参的鉴别方法笔者参考了药典(一部)[20]苦参项下收载的TLC法并有所调整,药典(一部)中采用加氨水和三氯甲烷放置过夜进行药材提取,笔者考虑到本制剂为经提取过的液体,故将方法调整为加氨水调pH后用三氯甲烷萃取。另外,笔者曾采用在10℃以下放置的三氯甲烷-甲醇-浓氨(5∶0.6∶0.3,V/V/V)的下层溶液为展开剂进行展开,但斑点比移值(Rf)较高,改为本研究中所用二次展开系统展开后,斑点Rf值适中且分离度好。大黄的鉴别笔者参考了药典(一部)[20]大黄项下收载的TLC法并有所调整,药典(一部)中先加甲醇浸泡提取药材,得甲醇液蒸干后,加水溶解,再加盐酸回流提取,笔者考虑到本制剂为经提取过的液体,故将方法调整为直接加盐酸回流提取;另外,笔者曾用药典展开方法展开,结果TLC图谱中橙黄色荧光斑点不清晰,后改为置于氨气预饱和的展缸中展开,结果斑点清晰。黄柏、黄芩的鉴别分别参考药典(一部)[20]黄柏、黄芩项下收载的TLC法。

表2 参黄搽剂中苦参碱、氧化苦参碱含量测定结果(n=2,μg/mL)Tab 2 Determination results of matrine and oxymatrine in shenghuang liniment(n=2,μg/mL)
3.2 HPLC含量测定中供试品溶液制备方法的确定
参黄搽剂中苦参为君药,笔者参考药典(一部)[20]苦参项下收载的含量测定方法,考虑到本品为液体制剂,药材已经经水煮提取,故选择采用萃取的方法对样品中有效成分进行提取。萃取时又发现样品乳化较严重,如果不破乳会影响含量测定结果,经离心破乳后,测定结果重复性高、稳定性好,故采用离心的方法对末次萃取后的混合液进行破乳处理。测定样品时笔者另发现,样品测定结果平行性较差,经排除人为误差影响后,怀疑是处理过程中加氨水将待测生物碱成分游离出来了,该过程需要一定的反应时间,故笔者对加氨水后的放置时间进行了考察,发现加氨水后直接测定时结果平行性较差,而放置30 min后含量测定结果平行性好,且放置60 min与放置30 min比结果相差不大,故确定加氨水放置30 min后再进行测定。此外,笔者对萃取次数还进行了考察,发现苦参碱、氧化苦参碱的含量随萃取次数的增加而增加,但萃取5次后,含量增加不明显,表明萃取5次对苦参碱、氧化苦参碱的提取较完全,故选萃取5次作为样品的提取次数。
3.3 HPLC色谱条件的确定
笔者曾参考药典(一部)[20]苦参项下收载的含量测定方法,在药典规定流动相的基础上,对色谱柱、柱温、流速进行了考察。在色谱柱方面,笔者分别考察了Waters Spherisorb NH2、Thermo Syncronis Amino、Phenomenex Luna NH2这3种不同色谱柱对分离效果的影响,发现该方法对不同色谱柱适应性良好,但Phenomenex Luna NH2色谱柱的色谱峰峰形更好、保留时间适中,故最终选则Phenomenex Luna NH2作为含量测定的色谱柱。在柱温方面,笔者分别考察了35、40、45℃这3种不同柱温对分离效果的影响,结果当柱温为35℃时,苦参碱和氧化苦参碱的分离度均低于1.5,当柱温高于40℃后,苦参碱和氧化苦参碱的分离度均在1.5以上,且其分离度均随柱温的增加而升高,故最终选柱温为45℃。在流速方面,笔者考察了0.8、1.0、1.2 mL/min这3种流速对分离效果的影响,结果流速对分离效果影响不大,综合分析时间及仪器耐用性后,选择1.0 mL/min作为分析流速。最终所建立的含量测定方法专属性强、分离度好。
综上所述,本研究建立了参黄搽剂中苦参、黄柏、大黄、黄芩四味药材的TLC鉴别方法,在建立方法下测得的样品斑点清晰、分离度高,且阴性对照无干扰。此外,本研究还建立了方中苦参碱和氧化苦参碱含量测定的HPLC法,并初步拟定了以苦参碱、氧化苦参碱总量计,每瓶中不得少于1.87 mg的质量标准。本研究所建立的方法可行性高、重复性好,可用于参黄搽剂的质量控制。

