大米蛋白与米渣蛋白对镉结合能力的对比研究
尹仁文,陈正行,李 娟,王 韧
(江南大学食品学院,江南大学食品科学与技术国家重点实验室, 江南大学粮食发酵工艺与技术国家工程实验室,江苏无锡 214122)
镉是一种重金属,不易降解,食用镉会造成人体各种疾病,如神经痛、胃痛、骨质疏松症等疾病[1-2]。而大米因水稻植株根部吸收镉离子,经镉结合转运蛋白运输至籽粒并被蛋白结合而可能会含有镉元素,食用镉大米会造成镉在人体内积累,因此镉大米的问题越来越引起社会的关注,我国南方部分地区,如湖南、广西、江西等地的大米镉超标现象较为严重[3]。研究指出,镉主要结合在大米的蛋白部分,杨居荣等[4]研究了水稻籽粒中镉的结合形态,指出大米中8%的蛋白富集了60%以上的镉。赵新民[5]将镉与蛋白质形成的络合物定义为镉结合蛋白。Stone等[6]提出镉结合蛋白中的硫元素含量较高,何笃修等[7]纯化出玉米根的镉结合蛋白中含硫的半胱氨酸,其含量达29.6%。此外,镉与羧基的结合存在特异性,翟齐啸[8]研究表明,掩蔽乳酸菌菌体表面羧基,则乳酸菌对镉的吸附能力下降18%。许多研究提出,镉与大米蛋白的结合能力受大米蛋白种类的影响,这应该是大米蛋白中的羧基(-COOH)与巯基(-HS)共同作用结果所致。Liu等[9]研究了大豆分离蛋白与重金属镉的结合作用,在最优化条件下对镉的最大结合量达到83.36 mg/g,并指出大豆蛋白与重金属的结合的位点为巯基和羧基等亲水性基团。
“镉大米”的核心挑战就是土壤污染,土壤中的镉通过钙离子通道,以离子交换的形式结合在植物根表面,进入根系后,由于植物螯合肽(PCs)的作用,镉大部分累积在根系,少部分先通过转运体进入共质体,再进入中柱进行木质部装载,然后通过蒸腾作用被运输至地上部器官[10]。土壤镉污染造成镉在农作物中积累,因此研究者提出土壤镉钝化修复是解决镉大米的根本途径[11]。这种途径是:施用钝化剂在镉污染的农田中,与镉结合,钝化镉活性,减少农作物对镉的吸收。上述研究发现,镉与大米蛋白的结合能力较强,因此,寻找一种与镉结合能力强且廉价易得的大米蛋白作镉钝化剂是很有必要的。
米渣是大米在加工过程中产生的副产品,我国每年生产淀粉糖等产生副产品米渣3000多万吨[12],米渣中含有40%~65%的蛋白[13]。米渣蛋白来源于大米蛋白且廉价,目前大部分米渣用作动物饲料,但工业附加值低;少部分米渣用作生产大米蛋白粉或蛋白肽,但是各种生产工艺均存在缺陷,如成本高、操作复杂、产品质量差等;还有少量的米渣被直接丢弃,造成了严重浪费[14-15]。因此,研究米渣蛋白与镉的结合能力,探讨其应用价值,能够在一定程度上减少米渣资源的浪费,充分利用米渣资源。本研究对比研究大米蛋白与米渣蛋白与镉的结合能力,为米渣蛋白在镉钝化方面的研究提供依据,拓宽米渣的应用范围,为其在农业上应用提供理论基础。
1 材料与方法
1.1 材料与仪器
大米蛋白质 含量7.9%,产自江西的先农早籼米;米渣蛋白质 含量57.58%,江西恒天实业有限公司;高温淀粉酶 20000 U/mL,Novozyme公司;复合纤维素酶 10000 U/g,Novozyme公司;氯化镉、盐酸、氢氧化钠、EDTA(乙二胺四乙酸)、DTNB(5,5′-二硫代-2-硝基苯甲酸)、TCA(三氯乙酸)、尿素(Urea)、Tris(三羟甲基氨基甲烷)、甘氨酸(Gly)、盐酸胍、巯基乙醇等、四丁基氢氧化胺、四氢呋喃、甲基碘等 均为市售分析纯。
胶体磨 江阴新诺粉体设备有限公司;XY-1型氧气机 深圳宏鑫源电子有限公司;BT-9300S型激光粒度分布仪 丹东百特仪器有限公司;AA-240原子吸收分光光度计 美国Varian公司;LXJ-IIB离心机 上海安亭科学仪器厂;Sigma1-14微量高速离心机 德国Sigma公司;SH-1000紫外-可见分光光度计 日本Corona公司;Himac CR21G型冷冻干燥机 日本HITACHI公司;Quanta 200扫描电镜 荷兰Fei公司;MOS-450圆二色光谱仪 法国Biologic公司;傅立叶红外光谱仪 美国Nicolet公司;250XI X射线光电子能谱仪 日本Shimadzu公司。
1.2 实验方法
1.2.1 大米蛋白和米渣蛋白的制备
1.2.1.1 大米蛋白制备 大米用去离子水以1∶8的固液比,浸泡15 h后打浆,40 ℃条件下用2 mol/L的NaOH浸提2 h,浸提液4000 r/min离心15 min,取上清液,加2 mol/L的HCl调pH至5.5进行酸沉,然后在4 ℃静置过夜,离心(4000 r/min,15 min),取沉淀,去离子水洗3次,再用0.5 mol/L的NaOH调pH至中性,4000 r/min离心15 min,取沉淀进行冷冻干燥,得大米蛋白[16],干燥保存备用。
1.2.1.2 米渣蛋白去杂 米渣用正己烷预先脱脂后干燥,脱脂米渣中加入去离子水,固液比1∶8,用1.0 mol/L的NaOH溶液调节提取液pH至6.0,加入1.0%高温淀粉酶,90 ℃下反应1 h,冷却后调pH至4.5,添加1.2%纤维素酶于55 ℃下反应2 h,冷却至室温,4000 r/min离心15 min,收集沉淀,去离子水洗3次,4000 r/min离心15 min,取沉淀物,冷冻干燥,得米渣蛋白[17],干燥保存备用。
1.2.2 原料大米、米渣及制备的大米蛋白、米渣蛋白中各组分的含量测定 蛋白质含量用凯氏定氮法测定[18];脂肪含量用索氏抽提法测定[19];灰分按国标GB 5009.4-2016[20]测定;粗纤维含量参考GB/T 5009.10-2003[21]测定;淀粉含量参考GB 5009.9-2016[22]中酸水解法测定;水分的测定参考GB 5009.3-2016[23]测定。
1.2.3 大米蛋白、米渣蛋白对镉的结合能力试验
1.2.3.1 蛋白质与镉结合试验 用氯化镉配制100 mg/L的镉溶液,取两份1 L上述镉溶液于1.5 L塑料瓶中,向镉溶液中各添加大米蛋白和米渣蛋白5.0 g,在磁力搅拌器上搅拌混匀后,气浴恒温摇床内振荡(180 r/min,25 ℃)反应。分别在蛋白样品加入后的2、5、10、30、60、90、120、180、240、300和360 min时取样0.5 mL,离心(10000 r/min,2 min),取上清液,稀释到适宜的浓度,用原子吸收分光光度计测定溶液中镉浓度。
1.2.3.2 镉脱除试验 已结合镉的大米蛋白与米渣蛋白在-50 ℃条件下,冷冻干燥72 h后,作为镉脱除试验的样品,用稀盐酸溶液脱除,料液比1∶2,盐酸浓度为0.04 mol/L,反应时间120 min、反应温度25 ℃、分别在2、5、10、30、60、90、120和180 min取样0.5 mL,离心(10000 r/min,2 min),取上清液,稀释到适宜的浓度测定溶液中镉浓度。
1.2.3.3 镉结合量和镉脱除率 计算公式如式(1)和(2)所示。
式(1)
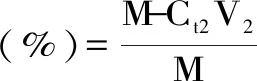
式(2)
式(1)中,C0:氯化镉初始浓度,mg/L;Ct1:取样时试液中镉浓度,mg/L;V1:反应体系的体积,L;m:加入蛋白样品的质量,g;式(2)中,M:蛋白样品中镉的质量,mg;Ct2:取样时试液中镉浓度,mg/L;V2:反应体系的体积,L。
1.2.4 蛋白质粉末粒径测定 粒径测定用水做介质,背景校准后,取适量结合镉前后的大米蛋白粉和米渣蛋白粉加入样品池中,分散均匀后用粒度分布仪测定样品的粒径分布。
1.2.5 巯基及二硫键的测定 采用Ellman’s试剂比色法,用分光光度计在412 nm处测定吸光度,计算结合镉前后的大米蛋白和米渣蛋白中巯基和二硫键的含量,具体方法参见Damodaran等[24]和张来林等[25]的测定方法。
1.2.6 蛋白质二级结构的测定 将样品溶于0.05 mol/L、pH为7.5磷酸盐缓冲液中,离心取上清液。圆二色光谱仪测定参数:远紫外区190~250 nm范围的光谱,蛋白质浓度为0.15 mg/mL,比色皿光径0.1 cm,分辨率0.2 nm,谱带宽度为1.0 nm,灵敏度20 mdeg,响应时间0.25 s,得CD谱图。并用CDSSTR软件分析蛋白质二级结构。
1.2.7 红外光谱(FTIR)分析 将2 mg镉结合前后的大米蛋白粉与米渣蛋白粉样品,与适量溴化钾混合,研磨数分钟并用压片机压成透明小块。然后,在分辨率2 cm-1、扫描范围4000~400 cm-1、扫描次数32的条件下进行FTIR谱图采集。最后,以溴化钾作空白背景,进行结果校正[26]。
1.2.8 扫描电镜(SEM)分析 分别取适量的结合镉前后的大米蛋白、米渣蛋白样品放置于导电胶上,固定后喷金,采用电子束对样品进行微观形貌拍摄,探针电压为30 kV,电流为50 pA,电子束加速电压为5 kV,放大倍数为20000倍[27]。
1.2.9 X射线光电子能谱(XPS)分析将结合镉后的大米蛋白、米渣蛋白样品干燥,并用结合镉前的大米蛋白、米渣蛋白作为对照。使用Al Ka X射线源在0~1300 eV的电压范围内进行光谱扫描。
1.2.10 蛋白羧基及巯基在镉结合中的作用
1.2.10.1 羧基的掩蔽 分别取10.0 g上述制备的两种蛋白样品于500 mL烧瓶中,加入34 mL的1 mol/L四丁基氢氧化胺、100 mL四氢呋喃和18 mL甲基碘,25 ℃下搅拌反应至pH试纸检测不到碱性为止。抽真空过滤,用蒸馏水清洗过滤3遍。将甲基化的蛋白样品置于50 ℃真空干燥箱24 h后,得到掩蔽羧基的蛋白样品[28-29]。
1.2.10.2 巯基氧化 分别取10.0 g上述制备的两种蛋白样品,置于pH为8.0的去离子水中,磁力搅拌,向水溶液中持续通氧24 h,氧气流量3 L/min。反应完成后,蒸馏水水洗过滤三次后,样品置于50 ℃真空干燥箱24 h后,得到巯基氧化的蛋白样品。
1.2.10.3 结合镉试验 分别用羧基被掩蔽的、巯基被氧化的大米蛋白和米渣蛋白做结合镉试验,方法参见1.2.3,蛋白与镉结合试验,并通过公式(1)计算蛋白与镉的最大结合量。
1.3 数据分析
样品进行3次平行试验,结果用平均值±标准差的形式表示。用Origin 8.5软件图形化处理。
2 结果与分析
2.1 原料大米、米渣及制备的大米蛋白、米渣蛋白中基本成分的含量
样品中各基本成分及含量如表1所示,米渣是大米淀粉糖厂生产淀粉糖之后的副产品,米渣来源于大米,在加工过程中,淀粉被脱除,因此蛋白质、脂肪、粗纤维等成分富集,尤其是蛋白质,米渣中的蛋白质含量达到54.58%。利用淀粉糖厂同一批次的大米原料和米渣制备得到的大米蛋白和米渣蛋白中蛋白质含量分别90.20%和88.40%,两种蛋白样品的纯度相差仅为1.80%。

表1 不同样品中各基本成分的含量Table 1 Contents of basic components in different samples
2.2 大米蛋白与米渣蛋白对镉的结合能力分析
大米蛋白与米渣蛋白对镉的结合量如图1所示。由图1可知,前30 min内米渣蛋白与镉结合的曲线斜率大,表明米渣蛋白对镉结合反应速率快,因为米渣蛋白结合位点多,所以初始反应速度快[30];30~90 min内,大米蛋白与镉结合的曲线斜率大,表明大米蛋白的对镉结合速率快,因为大米蛋白对镉结合的累积量比米渣蛋白少,反应体系中剩余镉离子浓度更高,镉与大米蛋白结合的机会更多[31],所以这段时间内大米蛋白与镉结合的速度快。大米蛋白在180 min内与镉的结合接近饱和,对镉的最大结合量为8.85 mg/g。米渣蛋白在300 min内与镉的结合达到饱和,最大结合量为12.08 m/g。米渣蛋白与镉结合达到最大时的反应时间较长,与米渣蛋白对镉的结合量多有关[32]。
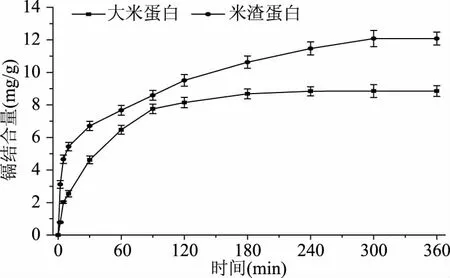
图1 大米蛋白与米渣蛋白与镉结合量随时间的变化Fig.1 Effects of reaction time on the binding behavior of cadmium to rice proteins and rice dreg proteins
两种已结合镉的蛋白在稀盐酸溶液中镉的脱除率如图2所示。由图2可知,盐酸对镉的脱除效果较好,脱除率达93%以上。从脱除时间上看,大米蛋白结合的镉在60 min内达到最大脱除率,米渣蛋白上结合的镉则需要120 min才能达到最大脱除率,说明镉在米渣蛋白中结合更牢固,脱除较难。综合图1~图2的分析,米渣蛋白与镉的结合能力比大米蛋白对镉的结合能力更强。
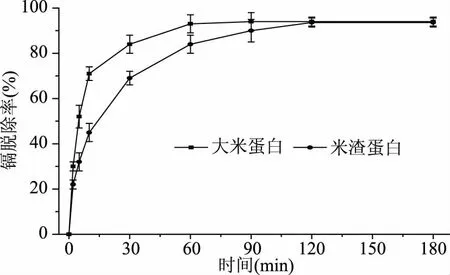
图2 大米蛋白与米渣蛋白的镉脱除率随时间的变化Fig.2 Effects of reaction time on the removal rate of cadmium from rice proteins and rice dreg proteins
2.3 大米蛋白和米渣蛋白的粒径分布
大米蛋白和米渣蛋白的粒径分布和粒径参数如图3和表2所示,大米蛋白的平均粒径为51.98 μm,米渣蛋白的平均粒径为75.53 μm。由于大米制糖过程中高温液化引起的美拉德反应以及蛋白质中高含量的天冬酰胺和谷氨酰胺通过氢键等结合,会使蛋白质聚集[33],所以米渣蛋白的粒径比大米蛋白的粒径大。粒径较小的大米蛋白拥有较大的比表面积,为0.144 m2/g,米渣蛋白的比表面积仅为0.081 m2/g,大米蛋白的比表面积比米渣蛋白大77.8%。大米蛋白的比表面积大,但是与镉的结合量小,则比表面积不是影响镉结合量的主要因素。可见蛋白与镉的结合不仅是简单的物理吸附作用。与镉结合后的大米蛋白和米渣蛋白的平均粒径均增大,D50分别增加21.24、8.21 μm,可能因为镉引起蛋白质颗粒聚集,导致了粒径增加。
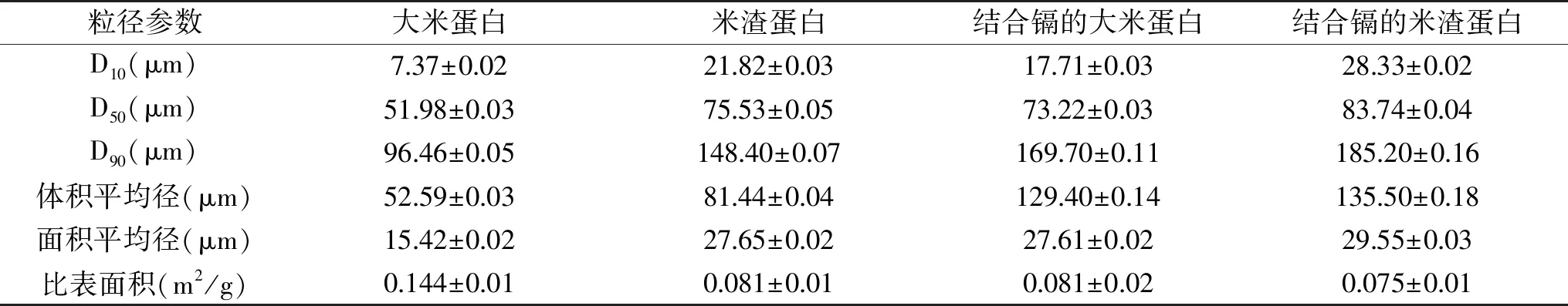
表2 结合镉前后大米蛋白和米渣蛋白的粒径参数Table 2 Particle size parameters of rice protein and rice dreg protein before and after cadmium bound
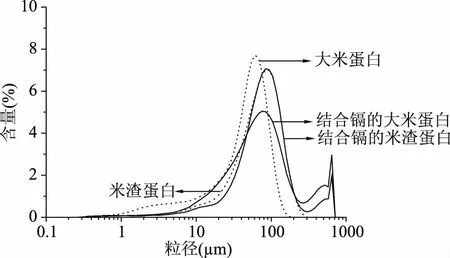
图3 结合镉前后大米蛋白和米渣蛋白的粒径分布图Fig.3 Size distribution of rice protein and rice dreg protein before and after cadmium bound
2.4 大米蛋白和米渣蛋白的巯基、二硫键及二级结构分析
结合镉前后大米蛋白和米渣蛋白的CD图谱如图4所示,通过软件计算出的二级结构含量如表3所示。从表3中数据得出,大米蛋白的α-螺旋含量(77.2%)较高,有序结构(α-螺旋、β-折叠、β-转角)占84.6%,而米渣蛋白的(α-螺旋含量较低,为35.9%,与大米蛋白相比,其无规则卷曲结构显著提高,含量为55.3%,有序结构含量明显降低,仅占44.7%,这与赵殷勤等[17]的研究结果一致。米渣蛋白经过高温变性,二级结构发生变化,有序结构向无序结构转变,无序结构的增加会使得蛋白质结构变得松散[34],从而会暴露出一些基团,如巯基。表3中,米渣蛋白的巯基含量较高,比大米蛋白的巯基含量高35.9%。文献报道,巯基(-SH)所含的硫原子的给电子能力强,易与金属发生配位反应[35]。米渣蛋白中巯基含量高于大米蛋白的巯基含量,且前者对镉的结合量高,结合的镉较难脱除。此外,结合镉后的大米蛋白和米渣蛋白的巯基含量均比结合镉前降低,因此巯基的存在可能是米渣蛋白比大米蛋白对镉的结合能力强的一个因素。结合镉之后蛋白的二级结构发生变化,由α-螺旋向β-折叠转变,这与Feng等[36]的研究结果一致。
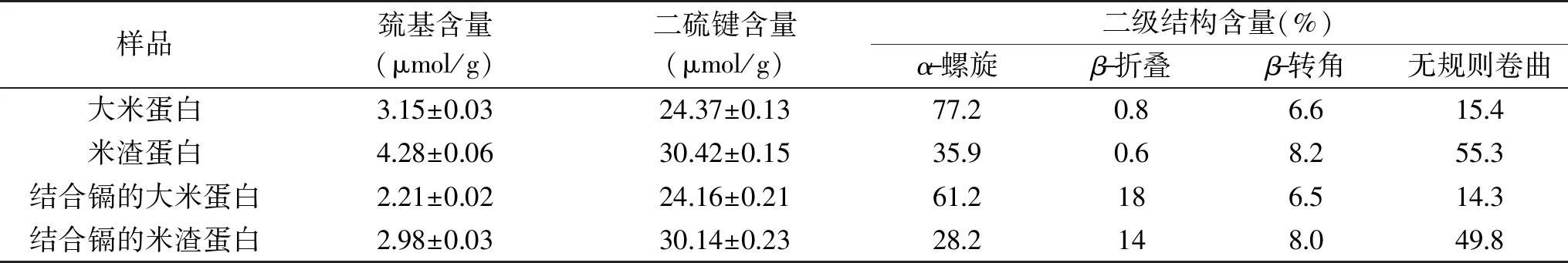
表3 结合镉前后大米蛋白和米渣蛋白的巯基、二硫键及二级结构含量变化Table 3 Changes of content of sulfhydryl,disulfide bond and secondary structure of rice protein and rice dreg protein before and after cadmium bound
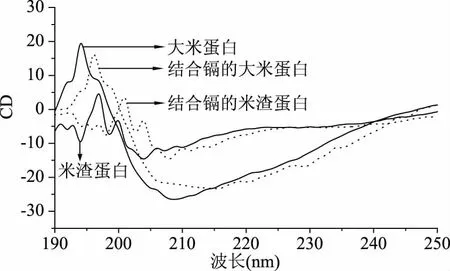
图4 结合镉前后的大米蛋白和米渣蛋白的CD图谱Fig.4 CD map of rice protein and rice dreg protein before and after cadmium bound
2.5 红外光谱(FTIR)分析
大米蛋白较大的比表面积并没有使其对镉的结合量变大,说明镉与蛋白的结合不是简单的物理吸附作用,与镉的结合可能是蛋白质上的结合位点的作用。因此对与镉结合前后的两种蛋白质做FTIR分析,红外图谱如图5所示。
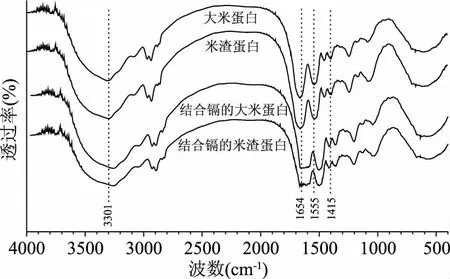
图5 与镉结合前后的大米蛋白和米渣蛋白的红外光谱图Fig.5 FTIR of of rice protein and rice dreg protein before and after cadmium bound
蛋白质酰胺Ⅰ带(C=O伸展振动)和酰胺Ⅱ带(N-H弯曲振动与C-N伸展振动叠加)吸收峰出现在1655~1555 cm-1处[37],图5中结合镉之后,两种蛋白的酰胺Ⅱ带峰位发生移动(1555~1510 cm-1),说明酰胺基团起作用。虽然制备得到的两种样品的蛋白纯度不是100%,但是结合镉的是酰胺基团,由此得出与镉结合的不是淀粉、纤维素等其他物质,而是蛋白质。蛋白质N-H或O-H的伸缩振动吸收峰出现在3750~3000 cm-1处。比较结合镉前后两种蛋白质的峰位,在3301 cm-1处,峰位发生红移,说明O原子参与镉的结合,导致O-H键长增加,O-H的伸缩振动向低波数移动41 cm-1。此外,C=O的吸收峰在1654 cm-1处由锐锋变成钝峰,C-O的吸收峰在1415 cm-1处发生红移,峰的变化是由于蛋白质上的-COOH与镉结合后减少了-COOH含量[38],因此蛋白在与镉的结合过程中羧基具有重要作用。
2.6 扫描电镜(SEM)结果
与镉结合前后的大米蛋白与米渣蛋白微观形态如图6所示。由图6可知,两种蛋白质结合镉后均出现聚集现象,由于蛋白上的结合位点被镉结合之后,表面电荷发生变化,分子间静电斥力减小[39],导致大米蛋白颗粒的聚集,这与粒径的测定结果一致。与镉结合后的米渣蛋白表面变成了连续凹凸不平、不规则、多层次的片状结构,说明镉在米渣蛋白的表面发生结合。大米蛋白在结合镉前后,微观形貌未见明显变形,米渣蛋白与镉结合后微观形态发生变化,形态的变化有可能是镉导致米渣蛋白发生变性,结构发生变化。这与翟齐啸研究结果类似,镉会导致乳酸菌表面蛋白变性,使得乳酸菌出现凝结和聚集现象[8]。

图6 蛋白与镉结合前后SEM图(1200×)Fig.6 SEM of protein before and after cadmium bound(1200×)注:(A)和(B)分别表示与结合镉前后的大米蛋白,(C)和(D)分别表示与结合镉前后的米渣蛋白。
2.7 X射线光电子能谱(XPS)分析
大米蛋白和米渣蛋白结合镉前后的XPS图谱如图7所示。由图7可知,结合能在163.8 eV位置是巯基的出峰位置,图(A)和(B)中观察出,大米蛋白与米渣蛋白结合镉后,巯基峰值强度均变弱,表明镉与蛋白的巯基结合后,降低了巯基含量[40]。结合能在404~405 eV和411~412 eV位置是镉出峰位置,图(C)和(F)中表明,大米蛋白和米渣蛋白上均结合了镉,且与大米蛋白相比,米渣蛋白中镉的峰值较大,表明米渣蛋白对镉的结合量大[41-42],这与实验1.2.3的结果一致。
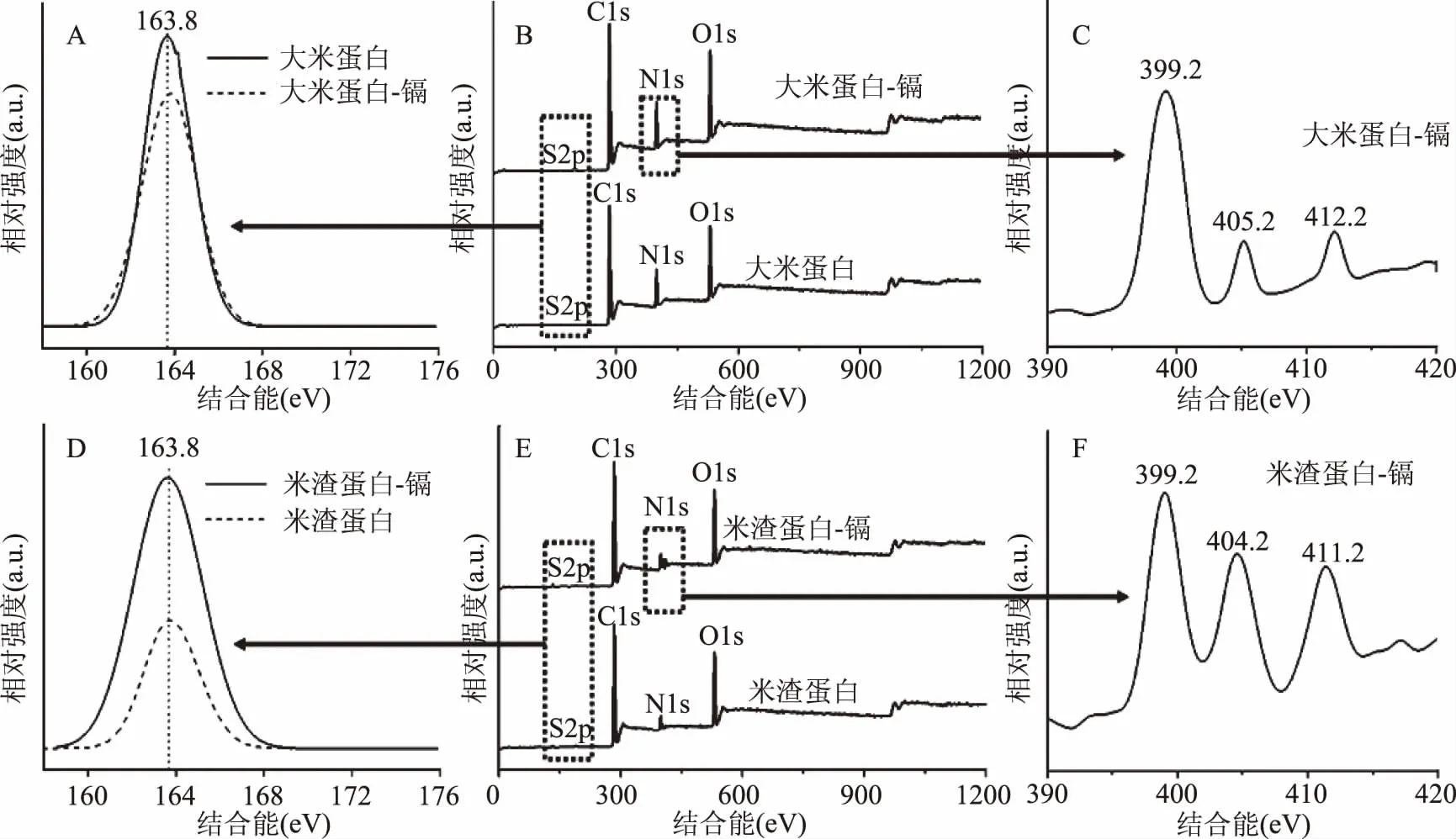
图7 蛋白与镉前后X射线光电子能谱图Fig.7 XPS of protein before and after cadmium bound注:(A)、(B)、(C)分别表示大米蛋白与镉结合前后的巯基峰、全波段扫描峰、镉峰; (D)、(E)、(F)分别表示米渣蛋白与镉结合前后的巯基峰、全波段扫描峰、镉峰。
2.8 蛋白质羧基、巯基对镉结合的作用
掩蔽羧基、氧化巯基后的两种蛋白与镉的最大结合量与各自未处理的蛋白相比,对镉结合量显著性降低(p<0.05),结果如图8所示。羧基被甲基化,氢原子被置换,从而失去了离子交换的能力,这种处理后,大米蛋白和米渣蛋白对镉的最大结合量与各自未被处理的蛋白均减小,均降低18%。这与翟齐啸[8]的研究结果一致。巯基被氧化后,大米蛋白和米渣蛋白与各自未被处理的蛋白相比,对镉的最大结合量分别降低40%和50%。因为硫元素最外层电子排布是3s23p4,因此蛋白质巯基上的硫外层丰富的孤对电子导致它具有很强的亲核性,易与金属阳离子发生配位反应[43]。当巯基被氧化后,亲核性降低,与镉结合量降低。
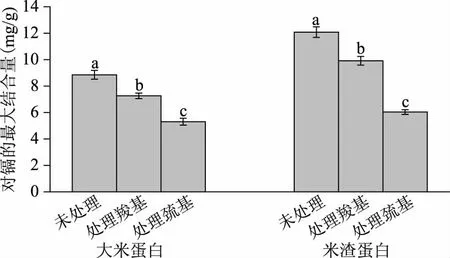
图8 大米蛋白和米渣蛋白质羧基、巯基对镉结合量的影响Fig.8 Effects of carboxyl and sulfhydryl groups on maximum cadmium binding capacity of rice protein and rice dreg protein注:不同小写字母表示差异性显著(p<0.05)。
3 结论
与大米蛋白相比,米渣蛋白对镉的最大结合量为12.08 mg/g(大米蛋白对镉的最大结合量为8.85 mg/g),且被米渣蛋白结合的镉,用稀盐酸脱除所需时间长,脱除相对较难,因此米渣蛋白对镉的结合能力更强。XPS图谱、蛋白质粒径分布及羧基掩蔽、巯基氧化等试验结果表明,两种蛋白对镉的结合不仅是简单的物理吸附过程,与大米蛋白相比,米渣蛋白二级结构发生变化,无序结构增加,且暴露出更多的巯基。在对镉的结合过程中,巯基、羧基起着重要作用,尤其是巯基对镉的结合作用强。另外,结合镉后会引起蛋白质相互聚集。以上研究为大米蛋白和米渣蛋白吸附镉的研究和应用提供了依据。

