纳豆激酶微胶囊制备及其释放与Caco-2细胞模型吸收的评价
邓柳艳,张建华
(上海交通大学农业与生物学院,上海 200240)
纳豆激酶(Nattokinase)最初分离自日本发酵食品纳豆,是一种由枯草芽孢杆菌产生的碱性丝氨酸蛋白酶[1],由275个氨基酸组成,具有很好的溶栓效果[2]。研究发现,纳豆激酶口服摄入后[3],主要在小肠部位被吸收[4],但纳豆激酶作为生物大分子,易被胃肠道中蛋白酶水解、在小肠中不易被吸收,因此,生物利用度低[5]。为提高纳豆激酶在人体胃肠道中的稳定性,有研究者采用明胶、阿拉伯胶或海藻酸钠等传统天然壁材制备纳豆激酶微胶囊,但粒径多为微米级,很少能够达到纳米级别(10~1000 nm)[6-7]。纳米级微胶囊具有肠胃刺激小、稳定性高、可靶向运输等优点,是促进包埋物吸收的有效方式。
此外,小肠绒毛壁的受体转运吸收等也是常见的吸收促进方式。人体小肠绒毛上皮细胞、肿瘤细胞等可表达叶酸(folic acid,FA)受体[8-9],叶酸可通过与上皮细胞表面受体结合转运进入机体,如果能将其与高聚物连接作为微胶囊壁材,则有望促进其包埋物的吸收。研究发现,通过化学修饰可将叶酸分子的羧基与聚乙二醇-聚乳酸-羟基乙酸共聚物(PEG-PLGA)中PEG的氨基端连接[10],得到叶酸靶向壁材FA-PEG-PLGA。PEG-PLGA是由聚乙二醇(PEG)和聚乳酸-羟基乙酸(PLGA)经化学合成得到的高分子聚合物,无免疫原性[11],且具有很好的生物降解性及缓释特性,是纳米级靶向微胶囊壁材的理想选择[12],已成功用于抗肿瘤药物[13]及胰岛素[14]等蛋白类物质的装载及靶向运输。
因此,本实验将以PEG-PLGA为壁材,以包封率为指标,通过正交试验探索双重乳液蒸发法制备纳豆激酶微胶囊的最适条件,然后在此条件下制备PEG-PLGA和FA-PEG-PLGA两种纳豆激酶微胶囊,并测定两者表征参数及体外缓释效果;最后,采用Caco-2细胞对两种纳豆激酶微胶囊的细胞毒性、释放及细胞吸收效果进行评价,以期对制备纳米级叶酸靶向纳豆激酶微胶囊的可行性及其促进细胞吸收的效果进行评价。
1 材料与方法
1.1 材料与仪器
纳豆激酶(100,000 FU/g) 广州双骏生物科技有限公司馈赠;叶酸-聚乙二醇-聚乳酸-羟基乙酸共聚物(FA-PEG-PLGA) 西安瑞禧生物科技有限公司;聚乙二醇-聚乳酸-羟基乙酸共聚物(PEG-PLGA) 济南岱罡生物工程有限公司;聚乙烯醇(PVA) 上海麦克林生化科技有限公司;Caco-2细胞系 实验室冻存;胎牛血清 上海碧云天生物技术有限公司;BCA试剂盒 上海生物技术有限公司;碱性磷酸酶试剂盒 上海碧云天生物技术有限公司;Hank’s平衡盐溶液(HBSS)、Dulbecco’s Phosphate Buffered Saline(DPBS)缓冲液、Dulbecco’s Modified Eagle Medium(DMEM)细胞培养液 美国Gibco公司;香豆素-6、荧光素钠等 均为国产分析纯。
KMO2磁力搅拌器 德国IKA公司;Nano S90纳米粒度分析仪 英国Malvern公司;Omni纳米粒度Zeta电位仪 美国BrookHaven公司;L5S棱光紫外可见分光光度计 上海仪电分析仪器有限公司;5424R低温高速离心机 德国Eppendorf公司;LGJ-10真空冷冻干燥机 北京松源华兴科技发展有限公司;Innova 44恒温摇床 德国Eppendorf公司;311恒温二氧化碳培养箱 美国Thermo公司;STED 3X活细胞超高分辨率多光子激光共聚焦显微镜 德国Leica公司。
1.2 实验方法
1.2.1 双重乳液蒸发法制备纳豆激酶微胶囊 初级乳液制备:取一定量的FA-PEG-PLGA和PEG-PLGA两种多聚物分别溶解于乙酸乙酯/氯仿(1∶1,v/v)中,备用;取纳豆激酶粉末溶于Tris-HCl缓冲液(pH7.4),得10 mg/mL 纳豆激酶溶液;分别取1 mL纳豆激酶溶液加入5 mL上述两种多聚物溶液中,1200 r/min磁力搅拌5 min;接着将两种混合液分别于10000 r/min条件下均质5 min,得W/O型初级乳液。
二级乳液制备:将上述两种初级乳液分别逐滴加入至一定浓度的PVA溶液(pH7.0)中,并于1200 r/min、4 ℃条件下磁力搅拌5 min;接着于一定转速下均质一定时间,得到两种W/O/W型二级乳液[16];最后将所得乳液搅拌至有机试剂完全挥发,多聚物及PVA成膜形成微胶囊。
纳豆激酶微胶囊粉末:分别将上述所得乳液于35250×g条件下4 ℃离心30 min,收集沉淀;接着用蒸馏水重悬沉淀、离心,重复三次;收集三次的上清液采用BCA试剂盒测定蛋白含量,收集沉淀进行真空冷冻干燥,即得FA-PEG-PLGA和PEG-PLGA两种纳豆激酶微胶囊粉末[15]。
根据蛋白质含量按下式计算纳豆激酶的包封率。
包封率(%)=(M0-M1)×100/M0
式中:M0为纳豆激酶初始含量(mg),M1为上清液中未包埋的纳豆激酶含量(mg)。
1.2.2 正交试验优化微胶囊制备条件及微胶囊表征 以壁材(PEG-PLGA)浓度A、聚乙烯醇(PVA)浓度B、二级均质转速C和二级均质时间D为因子,PEG-PLGA纳豆激酶微胶囊包封率为指标,采用如表1所示正交实验设计L9(34)探究最适制备条件。
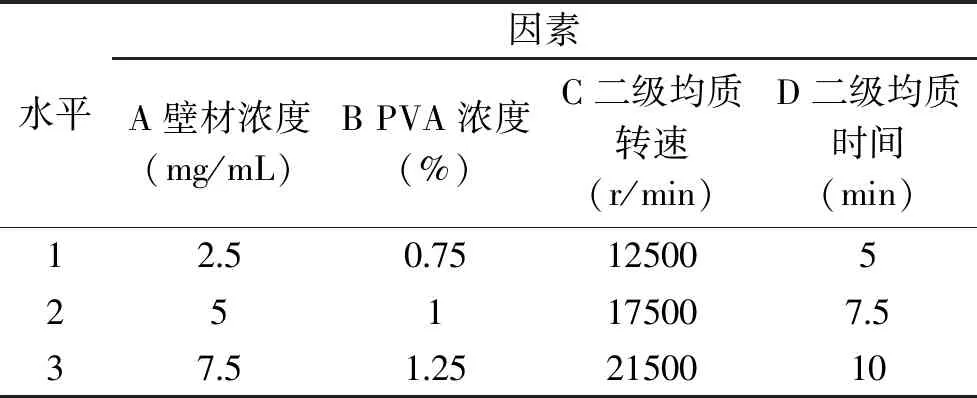
表1 L9(34)正交实验设计表Table 1 The orthogonal experimental designTable L9(34)
参考Chen等[13]和Jain等[14]的研究结果,叶酸的结合与否对微胶囊的制备及物理性质无显著影响。因此,采用PEG-PLGA所得制备条件分别以PEG-PLGA、FA-PEG-PLGA为壁材制备两种纳豆激酶微胶囊,最后分别采用纳米力度测定仪测定微胶囊平均粒径和多分散系数(PDI),纳米粒度Zeta电位仪测定ζ电位。
1.2.3 香豆素-6示踪纳豆激酶微胶囊制备 采用1.2.2中所得条件分别以PEG-PLGA和FA-PEG-PLGA为壁材,以香豆素-6为荧光探针制备两种纳豆激酶示踪微胶囊[16]。其中,香豆素-6与多聚物按质量比1∶200溶解于乙酸乙酯/氯仿(v∶v=1∶1)中,其余步骤与1.2.1相同,制备所得香豆素-6示踪纳豆激酶微胶囊用于Caco-2吸收实验。
1.2.4 微胶囊体外模拟缓释 人体胃环境模拟[14]:分别将两种纳豆激酶微胶囊溶于Tris-HCl缓冲液(pH2.0),置于37 ℃摇床(50 r/min)中孵育2 h。分别于0.5、1和2 h时取出1 mL缓释液,26475×g离心15 min,收集上清测定纳豆激酶含量(M1),按下式计算纳豆激酶微胶囊的释放率:
释放率(%)=(M1/M)×100,其中:M为微胶囊中纳豆激酶初始质量。
人体肠道环境模拟:取上述酶解液,调节pH至7.0,并加入PBS缓冲液(pH7.0)至100 mL,置于37 ℃摇床中继续孵育,并分别于2、3、5、9、12、15、18、21和24 h取1 mL上述反应液,测定纳豆激酶含量并计算纳豆激酶释放率。
1.2.5 纳豆激酶微胶囊细胞毒性评价 以Caco-2细胞存活率为指标,在樊佳新等[17]所建立的方法,采用MTT比色法对两种纳豆激酶微胶囊的细胞毒性进行评价。
1.2.6 Caco-2单层细胞模型的建立与评价
1.2.6.1 Caco-2单层细胞模型的建立 取对数期Caco-2细胞,按105个/孔分别接种于12孔的Transwell小室顶侧(apical,AP)和基底侧(basolateral,BL),加入1.5 mL DMEM培养基(10%胎牛血清);严格按照21 d培养规程,前两周隔天更换培养基,之后每天更换培养基[18]。
1.2.6.2 Caco-2单层细胞模型评价 为评价Caco-2单层细胞模型建立效果,实验以细胞跨膜电阻值(transepithelial electrical resistance,TEER)、标志物(荧光素钠)透过率和细胞极性(碱性磷酸酶活性)为指标,评价单层细胞模型的完整性及分化状况。其中,采用跨膜电阻仪测定TEER值;按照袁秀妍等[19]方法,分别测定AP→BL和BL→AP两个方向上荧光素钠的累积透过率;采用碱性磷酸酶试剂盒分别测AP侧和BL侧碱性磷酸酶的活性,并计算两侧(AP/BL)的酶活比值。
1.2.7 Caco-2单层细胞转运吸收实验 转运吸收实验[20]:AP→BL方向,AP侧加入0.5 mL相同浓度不同种类的香豆素-6示踪纳豆激酶微胶囊溶液,BL侧分别加入1.5 mL HBSS缓冲液;BL→AP方向,AP侧加入1.5 mL HBSS缓冲液;BL侧分别加入0.5 mL相同浓度不同种类的香豆素-6示踪纳豆激酶微胶囊溶液。分别于培养30、60、120和180 min时收集AP、BL两侧反应液,采用分光光度法[21]测定其中香豆素-6的含量,计算AP→BL方向的顶侧表观渗透系数Papp(AP→BL)、BL→AP方向基底侧表观渗透系数Papp(BL→AP)及两个方向上表观渗透系数比值Papp(AP→BL)/Papp(BL→AP)。其中,表观渗透系数(Papp)计算公式如下[22]:
式中,dQ/dT:单位时间内香豆素-6的透过量(μg/s);A:Transwell小室有效膜面积(cm2),本实验所用12孔Transwell小室有效膜面积为1.12 cm2;Co:初始加入微胶囊中香豆素-6浓度(μg/mL)。
1.2.8 激光共聚焦显微镜观察细胞摄取 为更直观的展示两种向微胶囊在Caco-2单层细胞中的吸收分布情况,利用香豆素-6的荧光特性,采用活细胞超高分辨率多光子激光共聚焦显微镜,对1.2.7中转运180 min时的Caco-2单层细胞进行观察,具体步骤为:转运180 min后,弃去AP与BL两侧培养液,先用DPBS缓冲液多次冲洗两侧,并小心将单层细胞连同Transwell聚碳酸酯膜一同剥离后,AP侧朝上平铺在载玻片上,采用激光共聚焦显微镜进行观察,条件:激发波长488 nm、扫描方式xyz、扫描速度400 Hz、光谱分光速度100 nm·ms-1。
1.3 数据处理
实验结果采用SPSS 19软件进行统计分析,p<0.05表示有显著差异。
2 结果与分析
2.1 正交试验及微胶囊表征
以PEG-PLGA为壁材,以纳豆激酶微胶囊的包封率为指标进行正交实验设计,实验结果如表2和表3所示。
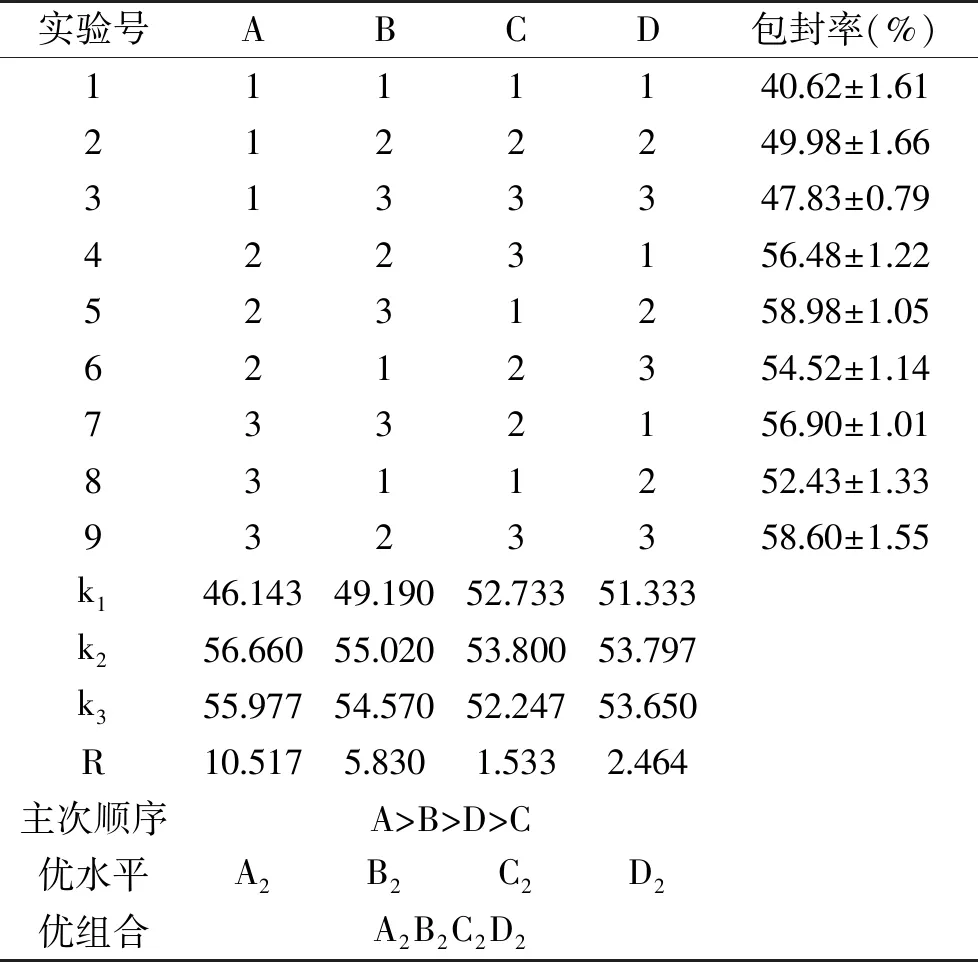
表2 PEG-PLGA纳豆激酶微胶囊制备的正交试验设计与结果Table 2 Design and results of orthogonal experiment for nattokinase loaded PEG-PLGA microcapsules preparation
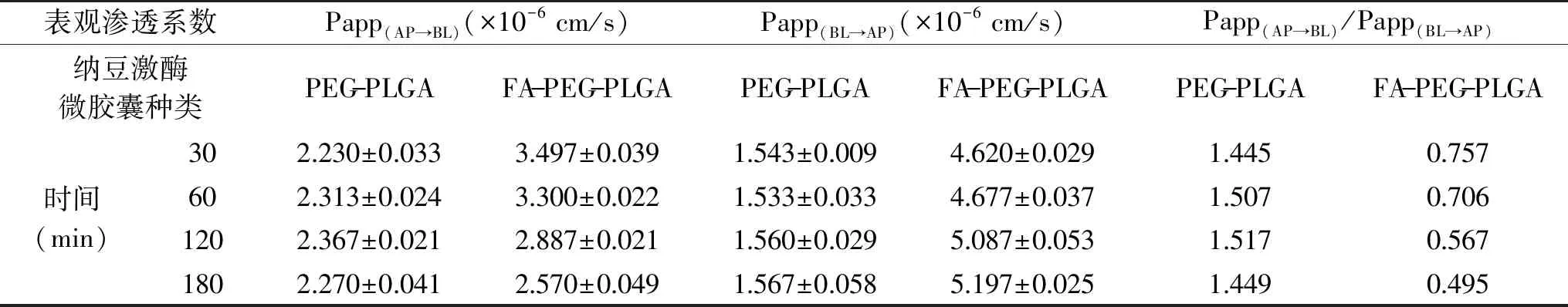
表3 纳豆激酶微胶囊在Caco-2单层细胞中转运吸收结果Table 3 Transportation and absorption of nattokinase loaded microcapsules in Caco-2 cell
由表2中极差值(R)可知,影响纳豆激酶微胶囊包封率大小的四个因素顺序为:壁材浓度>PVA浓度>二级均质时间>二级均质转速;由四个因素不同水平所对应的包封率大小可知,当壁材浓度、PVA浓度、二级均质转速和二级均质时间分别取5 mg/mL、1%、17500 r/min和7.5 min时可得到最大包封率。
采用上述制备条件制得PEG-PLGA和FA-PEG-PLGA两种纳豆激酶微胶囊,表征结果如下:包封率分别为61.54%±2.36%和58.76%±2.54%,平均粒径分别为(271.33±7.1) nm和(255.75±3.3) nm,PDI分别为(0.263±0.023)和(0.231±0.014),ζ电位分别为(-20.17±1.42)和(-24.73±2.36) mV。与采用传统壁材阿拉伯胶和明胶[6]所制备纳豆激酶微胶囊相比,本实验所制备的两种纳豆激酶微胶囊粒径为纳米级,这一性质可能赋予微胶囊进入血液循环的功能[23]。两种微胶囊纳豆激酶包封率较高,分散性良好,且采用优化后参数制备所得两种微胶囊各项表征参数无明显差异。
2.2 微胶囊体外模拟缓释
微胶囊体外模拟缓释结果如图1所示。2 h时,PEG-PLGA和FA-PEG-PLGA微胶囊两种微胶囊的纳豆激酶累积释放率分别为36.2%±3.2%和39.3%±3.9%;在肠道环境中,两种微胶囊的纳豆激酶累积释放率均增加缓慢,24 h时,两微胶囊的累积释放率分别为71.7%±3.8%和78.6%±2.9%,两者的缓释率变化趋势一致。Jain等[14]制备了PEG-PLGA和FA-PEG-PLGA两种胰岛素微胶囊,0~2 h(pH1.6),累积释放率分别为37%±2.86%和40%±2.46%,24 h时累积释放率分别为52%±3.51%和56%±3.17%,与之相比,本实验制备的微胶囊在胃环境中释放率相差不大,但在肠道环境具有更高的释放率,即有更好的肠溶效果。综合分析,两种微胶囊在胃环境中2 h纳豆激酶的释放率均小于40%,即纳豆激酶仍有超60%被完整保留下来进入肠道环境,且在肠道环境下表现出一定的缓释效果,因而除叶酸靶向及纳米促吸收外,还有望通过延长吸收时间而提高吸收量[24]。
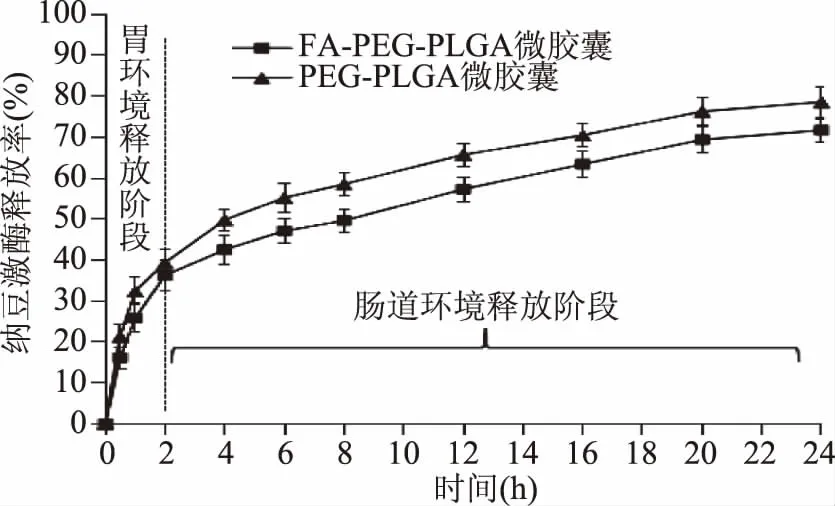
图1 两种纳豆激酶微胶囊在体外模拟胃肠环境中的释放Fig.1 Gastrointestinal release curve in vitro of two kinds of nattokinase loaded microcapsules
2.3 MTT法评估纳豆激酶微胶囊的细胞毒性
两种微胶囊的细胞毒性结果如图2所示,由图可知当浓度小于500 μg/mL时,Caco-2细胞存活率均高于98%,且各组间无显著差异;当浓度为750 μg/mL时,PEG-PLGA纳豆激酶微胶囊实验组的细胞存活率显著下降(p<0.05),说明此浓度下,PEG-PLGA纳豆激酶微胶囊对Caco-2细胞有一定的细胞损伤;而使细胞存活率显著(p<0.05)下降的FA-PEG-PLGA纳豆激酶微胶囊浓度为1000 μg/mL。所有实验组的细胞存活率均大于85%,细胞毒性分级为0或1级,即两种微胶囊无细胞毒性[26]。根据实验结果,选择不引起明显细胞损伤的500 μg/mL为两种微胶囊的最高添加量,并用于后续转运吸收实验中。
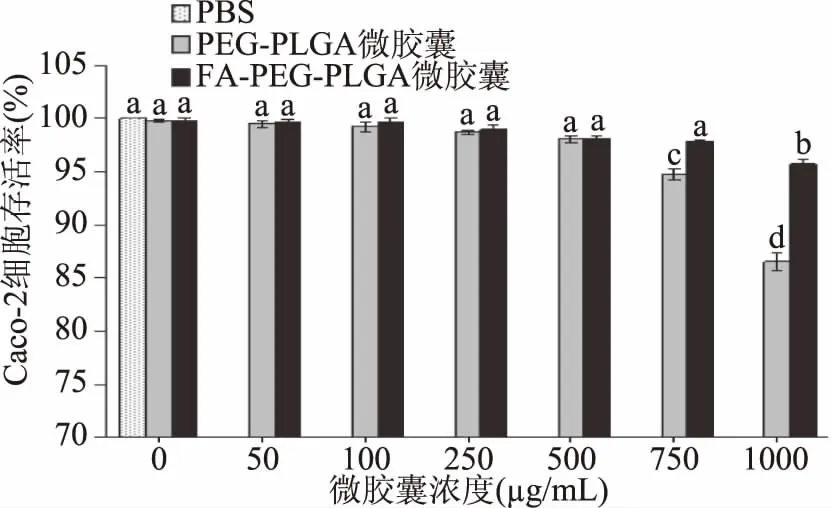
图2 两种纳豆激酶微胶囊对Caco-2细胞存活率的影响Fig.2 Effects of two kinds of nattokinase loaded microcapsules on the survival rate of Caco-2 cell注:不同小写字母表示差异性显著(p<0.05)。
2.4 Caco-2单层细胞模型建立与评价
经21 d培养后,分别对Caco-2单层细胞模型的TEER值、碱性磷酸酶活性、荧光素钠透过率进行测定。一般认为,单层细胞TEER值在200~1000 Ω·cm2之间,即认为所建立的细胞具有良好的完整性[26]。TEER值及极性分化测定结果如图3所示。培养前期,TEER值无明显变化,从第6 d至第11 d,TEER值迅速从83.6 Ω·cm2增大至约600 Ω·cm2,从第12 d开始,TEER值增速减缓并最终稳定在750 Ω·cm2左右,说明Caco-2单层细胞完整性良好。此外,随着培养时间延长,AP、BL两侧碱性磷酸酶活力比逐渐增大,21 d时达11.8,说明Caco-2单层细胞出现极性分化现象。
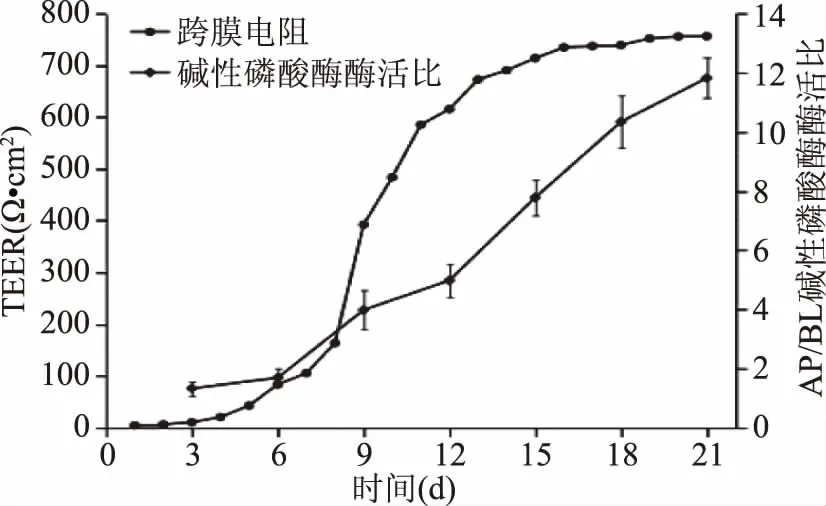
图3 Caco-2单层细胞模型TEER值变化及AP、BL两侧碱性磷酸酶酶活比值变化Fig.3 Change of TEER and ratio of alkaline phosphatase enzyme activity(AP and BL)in Caco-2 monolayer cells
转运2.5 h后,若AP→BL和BL→AP两个方向上荧光素钠的累积透过率均不超过1%,即可认为单层细胞的完整性和紧密性良好,所建单层细胞模型可用于转运吸收实验。荧光素钠透过率测定结果如图4所示,实验结果表明,AP→BL方向上,2.5 h荧光素的累积透过率不超过1%,BL→AP方向上,2.5 h的累积透过率不超过0.1%,说明单层细胞之间连接紧密。
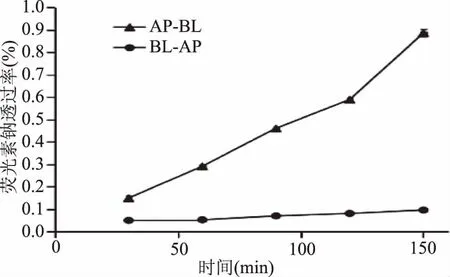
图4 荧光素钠透过率Fig.4 Sodium fluorescein transmittance
综合评价,本实验培养的Caco-2单层细胞之间连接紧密,具有良好的致密性和完整性,且已极性分化,可用于跨膜转运吸收实验。
2.5 Caco-2单层细胞转运吸收实验
一般认为,Papp>1.0×10-5cm/s表明物质在人体中能够被完全吸收,Papp在0.1×10-6~1.0×10-6cm/s之间,物质的吸收率为1%~100%,当Papp≤1.0×10-7cm/s时,即可视为物质不能被吸收[27];若两个方向上Papp比值Papp(AP→BL)/Papp(BL→AP)在0.5~2.0之间,则表明物质转运吸收机制主要为被动转运[28]。
PEG-PLGA和FA-PEG-PLGA两种纳豆激酶微胶囊在Caco-2单层细胞中转运吸收实验结果如表3所示。由表3可知,在AP→BL方向上,两种纳豆激酶微胶囊的顶侧表观渗透系数Papp(AP→BL)均大于1.0×10-6cm/s,最高分别可达2.367×10-6和3.497×10-6cm/s,说明Caco-2单层细胞对两种微胶囊均有很高的吸收率,可能是由于微胶囊为纳米级,且良好的生物相容性,从而促进了纳豆激酶微胶囊在小肠细胞中吸收[29];相同的转运时间,FA-PEG-PLGA纳豆激酶微胶囊的Papp(AP→BL)均显著(p<0.05)高于PEG-PLGA微胶囊,说明前者在Caco-2单层细胞中具有更高的吸收率,推测可能是壁材FA-PEG-PLGA中的叶酸分子与Caco-2细胞表面的叶酸受体结合而将微胶囊内吞进入细胞,从而促进跨膜转运作用[30]。随着时间的延长,PEG-PLGA微胶囊Papp(AP→BL)未出现明显的变化,且两侧Papp比值Papp(AP→BL)/Papp(BL→AP)稳定在1.4~1.5之间,由此推测该种微胶囊的转运吸收方式主要为被动转运。随着时间的延长,FA-PEG-PLGA微胶囊的Papp(AP→BL)值逐渐降低,且两个方向上的Papp比值从0.757减小至0.495,由此推测转运吸收过程除了被动转运之外,还可能存在P-糖蛋白等介导的外排机制[31],也可能是因为叶酸受体与叶酸的结合作用趋于饱和,从而导致比值下降。
2.6 激光共聚焦观察Caco-2细胞对微胶囊的摄取
采用激光共聚焦显微镜观察Caco-2单层细胞吸收两种纳豆激酶微胶囊后示踪剂香豆素-6的分布情况,结果如图5和图6所示。白光扫描结果显示,细胞表面均完整且无明显凸起或凹陷,说明细胞完整性良好;488 nm波长扫描结果显示,荧光主要分布在细胞之间与细胞边缘,且FA-PEG-PLGA纳豆激酶微胶囊在Caco-2细胞中荧光强度及分布范围明显大于PEG-PLGA纳豆激酶微胶囊,这一结果与2.5中FA-PEG-PLGA纳豆激酶微胶囊的Papp(AP→BL)显著高于PEG-PLGA纳豆激酶微胶囊的结果一致。
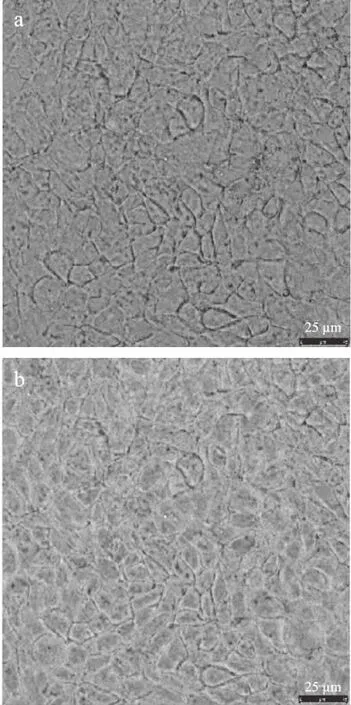
图5 香豆素-6示踪PEG-PLGA纳豆激酶微胶囊在Caco-2单层细胞中吸收情况的激光共聚焦显微镜观察图Fig.5 LSCM observation of coumarin-6 traced PEG-PLGA nattokinase microcapsules absorbed in Caco-2 monolayer cells注:a:白光;b:488 nm。
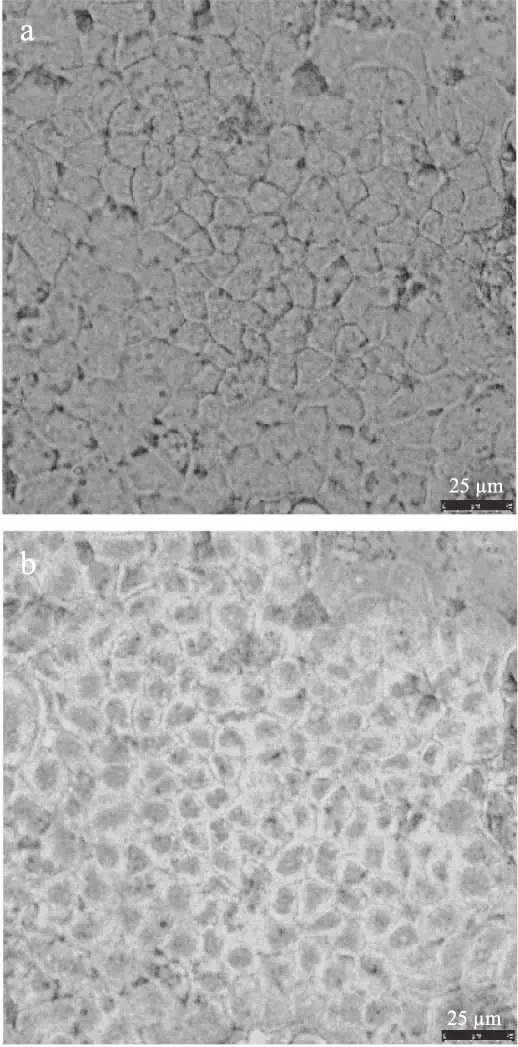
图6 香豆素-6示踪FA-PEG-PLGA纳豆激酶微胶囊在Caco-2单层细胞中吸收情况的激光共聚焦显微镜观察图Fig.6 LSCM observation of coumarin-6 traced FA-PEG-PLGA nattokinase microcapsules absorbed in Caco-2 monolayer cells注:a:白光;b:488 nm。
综上,细胞吸收实验结果表明,Caco-2单层细胞对两种微胶囊均有很好的吸收,其中对PEG-PLGA微胶囊的吸收方式主要是被动扩散,对于FA-PEG-PLGA微胶囊的吸收方式除被动扩散之外还可能存在主动转运方式,因而表现出更高的吸收效果,但是否是由叶酸与Caco-2细胞表面的叶酸受体结合而促进吸收,以及是否存在P-糖蛋白等介导的外排作用均有待进一步研究。
3 结论
本实验以PEG-PLGA为壁材,通过正交试验确定PEG-PLGA纳豆激酶微胶囊双重乳液蒸发法制备的最适条件为:壁材浓度5 mg/mL、PVA浓度1%、二级均质转速17500 r/min、二级均质时间7.5 min;在此条件下制备的PEG-PLGA和FA-PEG-PLGA两种纳米级纳豆激酶微胶囊的平均粒径分别为(271.33±7.1)和(255.75±3.3) nm,包封率分别为61.54%±2.36%和58.76%±2.54%,并以香豆素-6为荧光探针制备得PEG-PLGA和FA-PEG-PLGA两种香豆素-6示踪的纳豆激酶微胶囊;两胶囊的体外模拟释放结果表明在胃环境中2 h,纳豆激酶仍有超60%不被释放,且在肠道环境下表现出一定的缓释效果。两种微胶囊对Caco-2细胞均无明显细胞毒性;两种微胶囊在Caco-2细胞中的Papp(AP→BL)均大于2.0×10-6cm/s,激光共聚焦显微镜观察结果同样显示两者吸收良好,且FA-PEG-PLGA纳豆激酶微胶囊具有更好的吸收,但FA-PEG-PLGA是否存在叶酸受体介导的转运尚有待进一步研究。
综上,PEG-PLGA和FA-PEG-PLGA均可用于纳米级纳豆激酶微胶囊的制备,具有胃环境保护及肠道缓释作用,无明显细胞毒副作用,细胞吸收效果良好,本实验为通过叶酸靶向作用促进纳豆激酶的细胞吸收研究提供了依据。

