小鼠核糖核酸酶抑制剂异源高效可溶性表达、纯化及活性研究
付大伟,孙莹莹,徐 伟
(哈尔滨商业大学食品科学与工程重点实验室,黑龙江哈尔滨 150076)
核糖核酸酶抑制剂(Ribonuclease Inhibitor,RI)是一种能够调节核糖核酸酶活性的酸性胞浆蛋白[1],广泛应用于涉及RNA的分子生物学实验中。它与核糖核酸酶(RNase)以1∶1的比例结合抑制RNase活性[1]。它是一个在任何应用中对付潜在RNase污染的十分有效的试剂。
目前,虽然市面上有较多商品化的RI出现,但是价格较为昂贵。以大肠杆菌为宿主的重组蛋白原核表达方法由于成本降低而被广泛使用[1]。但是,重组RI的表达很难在大肠杆菌的细胞质中以可溶性的形式大量存在[2]。因此提高目的蛋白可溶性表达极为重要。
本研究旨在获得MRNI在大肠杆菌中的高效可溶性表达。通过构建含SUMO、IF2、GST等不同融合标签的八种重组表达载体,以大肠杆菌BL21(DE3)作为宿主菌自诱导表达及利用MagNi磁珠纯化,采用低温诱导提高重组蛋白表达量。进一步研究该酶是否具有抑制RNase A,防止RNA被降解的作用,为核糖核酸酶抑制剂的生产及应用提供理论基础。
1 材料与方法
1.1 材料与仪器
E.coliBL21(DE3)菌株、E.coliTrans I菌株 本实验室提供;HiFi DNA聚合酶、DNA Marker(15000 bp)、蛋白质Marker(120 kDa)、核糖核酸酶抑制剂 北京全式金生物技术有限公司;T4 DNA连接酶、限制性内切酶BamHI、NotI NEB公司;二硫苏糖醇(DTT)、氨苄青霉素(Ampr)、三羟甲基氨基甲烷(Tris) Taraka公司;NP40 Sigma公司;溶菌酶 Amresco公司;核糖核酸酶A 北京沁源惠帜生物技术有限公司;MagNi Protein Purification Kit 北京诺贝奥生物技术有限公司;裂解缓冲液、ZYP+5052自诱导培养基[3](碳源为葡萄糖和α-乳糖) Thermo公司;实验所用质粒均由本实验室之前构建,特性[4]如表1所示。
T100 TM Thermal Cycler PCR仪 美国BIO-RAD公司;H2050R台式离心机 湖南湘仪实验室仪器开发有限公司;Gds8000凝胶成像仪 美国Uvp公司;DK-8D电热恒温水槽、DHP-9162恒温培养箱 上海一恒科技有限公司;DZP-102恒温振荡器 哈尔滨东联电子技术开发有限公司。
1.2 实验方法
1.2.1 MRNI基因的扩增引物的设计 通过MRNI基因在Genbank数据库中报道的序列及所用载体的序列决定。分别于上、下游引物的5′端插入了BamHI和NotI酶切位点。上游引物P1:5′-TCCAGGG GCCCCTGGGATCCATGAGTCTTGACATCCAGTGTGAG
-3′,下游引物P2:5′-GGTGGTGCTCGAGTGCGG CCGCTCAGGAAATGATCCTCAGGGAAG-3′,引物被送到上海生工生物有限公司进行合成。以全基因合成的MRNI基因为模板,利用P1、P2引物进行PCR扩增。通过1%琼脂糖凝胶电泳检测得到的产物,并通过胶回收重新获取基因片段,经BamHI和NotI 酶切后进行柱回收。
1.2.2 重组表达载体的构建 通过T4DNA连接酶将其与经BamHI和NotI酶切后的pNBE3C Ⅰ~Ⅷ表达载体相连,得到重组载体pNBE3C Ⅰ~Ⅷ-MRNI,并将其转化至E.coliTrans I克隆感受态细胞中,于Ampr抗性平板涂布培养。经过菌落 PCR 和酶切鉴定筛选阳性单克隆菌落,同时送至上海生工生物有限公司进行序列测定。
1.2.3 重组菌的自诱导表达 将测序成功的八种重组载体热激转化到表达感受态细胞E.coliBL21(DE3)中,于Ampr抗性平板涂布培养,挑取单菌落,于Ampr抗性的 1 mL LB液体培养基中接种,37 ℃摇床培养16 h,再以1‰接种量于10 mL自诱导培养基[5-8]中接种,37 ℃150 r/min自诱导6 h,20 ℃ 150 r/min培养24 h,离心收集菌体[9],12% 聚丙烯酰胺凝胶电泳观察蛋白条带。
1.2.4 重组蛋白的可溶性表达检测 取1 mL 1.2.3中获得的菌液,12000 r/min 5 min离心,收集菌体,加入含50 mmol/L Tris-HCl pH8.0的裂解缓冲液及浓度1 mg/mL的溶菌酶,悬浮菌体,过夜冻存,取出于37 ℃融化30 min,加入1%的500 mmol CaCl2、1%的1 mg/mL DNase,混匀后放于37 ℃水浴30 min,取出后加入1/10的5 mol NaCl,12000 r/min,离心5 min。向上清中加入少量磁珠,目的蛋白与其结合5 min后于磁力架上吸附,收集穿透峰;加入含10 mmol咪唑的Tris-HC1缓冲液漂洗杂蛋白,重复5次;加入含500 mmol咪唑的Tris-HC1缓冲液,结合5 min后洗脱目的蛋白[10]。将离心得到的沉淀、上清,纯化的穿透峰及洗脱液[3]在12%聚丙烯酰胺凝胶点样分析,选出高效表达的菌株。
1.2.5 融合蛋白MRNI的自诱导表达条件的优化
1.2.5.1 自诱导温度对可溶性蛋白表达量的影响 向4瓶10 mL灭菌后的ZYP+5052自诱导培养基中加入Ampr,以1‰接种量将菌液分别接种,37 ℃摇床培养测得600 nm分光光度值0.2左右时,将其分别放至16、20、25、30 ℃摇床培养[11]至分光光度值达1.5左右时,离心收集菌体,按照1.2.4中方法纯化检测可溶性MRNI及12%聚丙烯酰胺凝胶分析。
1.2.5.2 自诱导时间对可溶性蛋白表达量的影响 向20 mL灭菌后的ZYP+5052自诱导培养基中加入Ampr,以1‰接种量将菌液分别接种,37 ℃摇床培养至600 nm分光光度值为0.2左右时,放置20 ℃分别摇床培养12、14、16、17、18、20、21、22、23、24、26 h时,收集菌体磁珠纯化后取洗脱液进行12%聚丙烯酰胺凝胶电泳分析。
1.2.6 裂解菌体及MagNi磁珠纯化 向100 mL灭菌后的ZYP+5052自诱导培养基中加入Ampr,以1‰接种量将菌液分别接种,37 ℃摇床培养6 h,20 ℃培养24 h,离心得到沉淀。加入含50 mmol/L Tris-HC1 pH8.0的裂解缓冲液及1 mg/mL的溶菌酶,悬浮菌体。放于-20 ℃过夜冻存,取出于37 ℃融化30 min,加入1%的500 mmol/L CaCl2,1%的1 mg/mL DNase[12],混匀后放于37 ℃水浴30 min,取出后加入1/10的5 mol/L NaCl[13],12000 r/min离心5 min。收集上清按照1.2.4中的磁珠纯化说明书操作步骤进行纯化。
1.2.7 纯化后的IF2-MRNI的浓度测定 将纯化后的蛋白通过PEG 2000浓缩,再经透析除盐,用BCA蛋白浓度测定法对IF2-MRNI浓度进行测定,取20 μL待测样品及标准蛋白样品,加入200 μL BCA染色液,于37 ℃静置30 min后,用酶标仪测得562 nm处吸光值,以测得的蛋白标准品BSA作标准曲线。获得的蛋白加入储存液,冻存至-20 ℃。
1.2.8 融合蛋白IF2-MRNI的活性检测 通过使用基于琼脂糖凝胶的测定来测量在RI存在下的核糖核酸活性。以购买的RI作对照,将不同体积的融合蛋白IF2-MRNI加入到含有50 mmol/LTris-HCl缓冲液(pH7.4)、50 mmol/L NaCl、10 mmol/L DTT的反应混合物中[2],加入5 ng RNase A,在室温孵育10 min,加入1 μg提取的植物总RNA。将混合物20 μL在室温下孵育10 min。用1%琼脂糖凝胶进行RNA电泳,并通过溴化乙锭染色核实。如果RNA条带完好,未降解,说明其具有抑制RNA酶降解RNA 的作用,证明其具有一定活性。
1.3 数据处理
本研究中涉及的实验内容均重复3次;蛋白浓度标准曲线绘制均采用 Microsoft Office Excel(2007)软件;蛋白浓度测定采用SoftMax Pro 6.3.1软件,应用 Adobe Photoshop CC 2014软件作图。
2 结果与分析
2.1 目的基因的扩增
以全基因合成的MRNI基因为模板通过PCR扩增,在1%琼脂糖凝胶电泳上可以看到一条清晰条带大小约1383 bp(图1),同预期目的片段大小相符。
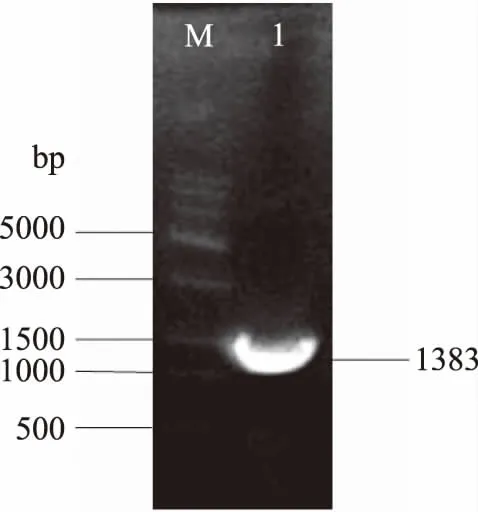
图1 PCR扩增MRNI基因Fig.1 PCR amplification of MRNI gene注:M:DNA Marker;1:MRNI基因PCR产物。
2.2 重组质粒的鉴定
分别将pNBE Ⅰ~Ⅷ表达载体(图2)及扩增出的MRNI基因经BamHI和NotI酶切后,经T4DNA连接酶连接,转化到E.coliTrans I中,于Ampr抗性平板涂布培养,37 ℃过夜培养,每种载体选取4个阳性菌落做菌落PCR检测(图3),确定重组表达载体构建成功。
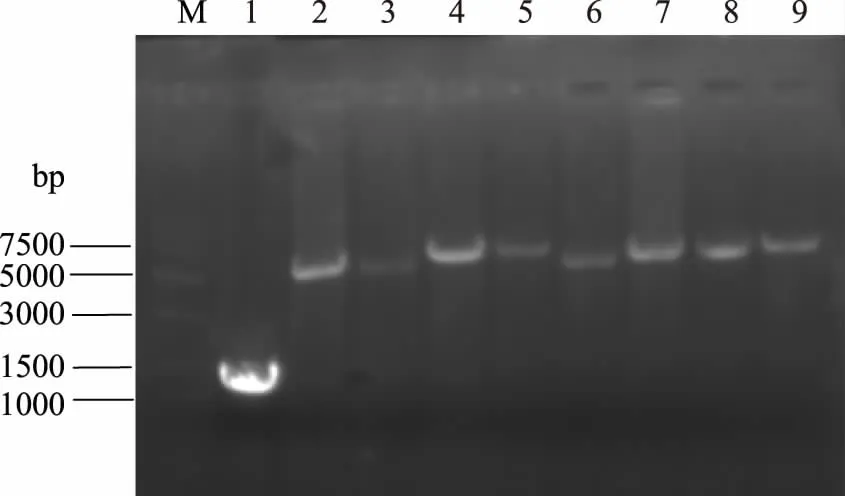
图2 酶连重组表达载体Fig.2 Enzyme-linked recombinant expression vector注:M:DNA marker;1:PCR 扩增的MRNI基因; 2~9:重组载体pNBE Ⅰ~Ⅷ。
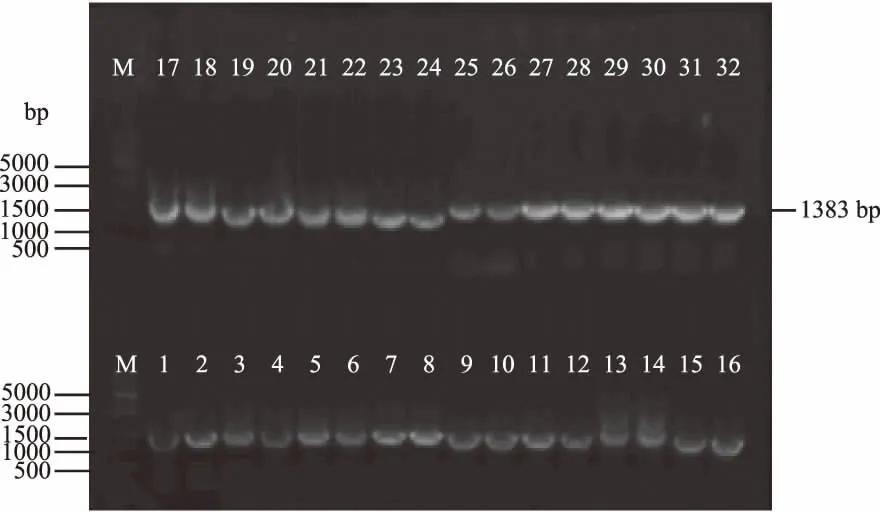
图3 菌落PCR鉴定重组表达载体Fig.3 Detection of the recombinant expression vector by PCR注:M:DNA marker;泳道1~4:重组质粒pNBE I-MRNI;泳道5~8:重组质粒pNBE II-MRNI;泳道9~12:重组质粒pNBE IIII-MRNI;泳道13~16:重组质粒pNBE IV-MRNI;泳道17~20:重组质粒pNBE V-MRNI;泳道21~24:重组质粒pNBE VI-MRNI;泳道25~28:重组质粒pNBE VII-MRNI;泳道29~32:重组质粒pNBE VIII-MRNI。
2.3 重组菌的自诱导表达
挑选检测成功的菌株,按照质粒提取试剂盒方法提取质粒,将其转化至表达感受态细胞E.coliBL21(DE3)中,筛选菌株接种后自诱导培养,收集沉淀,12%聚丙烯酰胺凝胶电泳显示(图4),pNBE I和pNBEVI载体并未表达目的蛋白,重组菌BL21(DE3)/pNBE II-MRNI、BL21(DE3)/pNBE III-MRNI、BL21(DE3)/pNBE IV-MRNI、BL21(DE3)/pNBE V-MRNI、BL21(DE3)/pNBE VII-MRNI、BL21(DE3)/pNBE VIII-MRNI表达的融合蛋白与期望基本一致,大小分别为69.6、90.0、105.0、66.1、67.3、90.0 kDa。
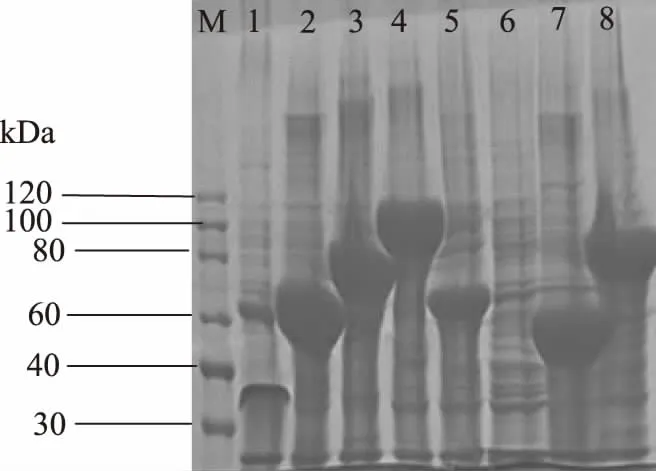
图4 MRNI诱导表达的12%聚丙烯酰胺凝胶分析Fig.4 Analysis of MRNI induced expression of 12% polyacrylamide gel注:M:蛋白质 Marker;1~8:分别为载体 pNBE Ⅰ~Ⅷ的自诱导表达的重组菌。
2.4 重组蛋白的可溶性表达鉴定
对1.3.3中得到的沉淀通过MagNi磁珠纯化,对各重组菌表达可溶性MRNI的状况进行检测,通过12%聚丙烯酰胺凝胶电泳可以看出(图5),重组菌BL21(DE3)/pNBE II-MRNI、BL21(DE3)/pNBE III-MRNI、BL21(DE3)/pNBE V-MRNI、BL21(DE3)/pNBE VII-MRNI 经过洗脱后蛋白条带与期望值大小相符,分别是69.6、90、66.2、67.3 kDa。而从条带上看杂蛋白含量最少的是重组菌BL21(DE3)/pNBE II-MRNI,重组蛋白IF2-MRNI表达量偏高,大小约69 kDa,同期望的分子质量大小基本一致。接下来优化此重组菌的培养条件,使其表达量提高。

图5 MRNI可溶性表达的12%聚丙烯酰胺凝胶分析Fig.5 Analysis of soluble expression of MRNI by 12% polyacrylamide gel注:M:蛋白Marker;1~4:表达载体pNBE I的重组菌裂解的沉淀、上清、纯化后的穿透和洗脱;5~8:表达载体pNBE II的重组菌裂解的沉淀、上清、纯化后的穿透和洗脱;9~12:pNBE II的重组菌裂解的沉淀、上清、纯化后的穿透和洗脱;13~16:pNBE III的重组菌裂解的沉淀、上清、纯化后的穿透和洗脱;17~20:pNBE IV的重组菌裂解的沉淀、上清、纯化后的穿透和洗脱;21~24:pNBE V的重组菌裂解的沉淀、上清、纯化后的穿透和洗脱;25~28:pNBE VI的重组菌裂解的沉淀、上清、纯化后的穿透和洗脱;26~29:pNBE VII的重组菌裂解的沉淀、上清、纯化后的穿透和洗脱;30~32:pNBE VIII的重组菌裂解的沉淀、上清、纯化后的穿透和洗脱。
2.5 重组蛋白IF2-MRNI自诱导表达条件优化
2.5.1 自诱导温度对可溶性蛋白表达量的影响 诱导温度不仅影响菌体的生长,同时也影响着重组蛋白的诱导表达[11]及包涵体的形成[14]。低温诱导可以促进蛋白的可溶性表达[15]。通过12%聚丙烯酰胺凝胶可以看出,如图中标注所示,20 ℃时形成的包涵体较少,洗脱液中蛋白含量最高,所以在20 ℃时表达量相对较高,条带单一。确定最佳诱导温度是20 ℃(图6)。
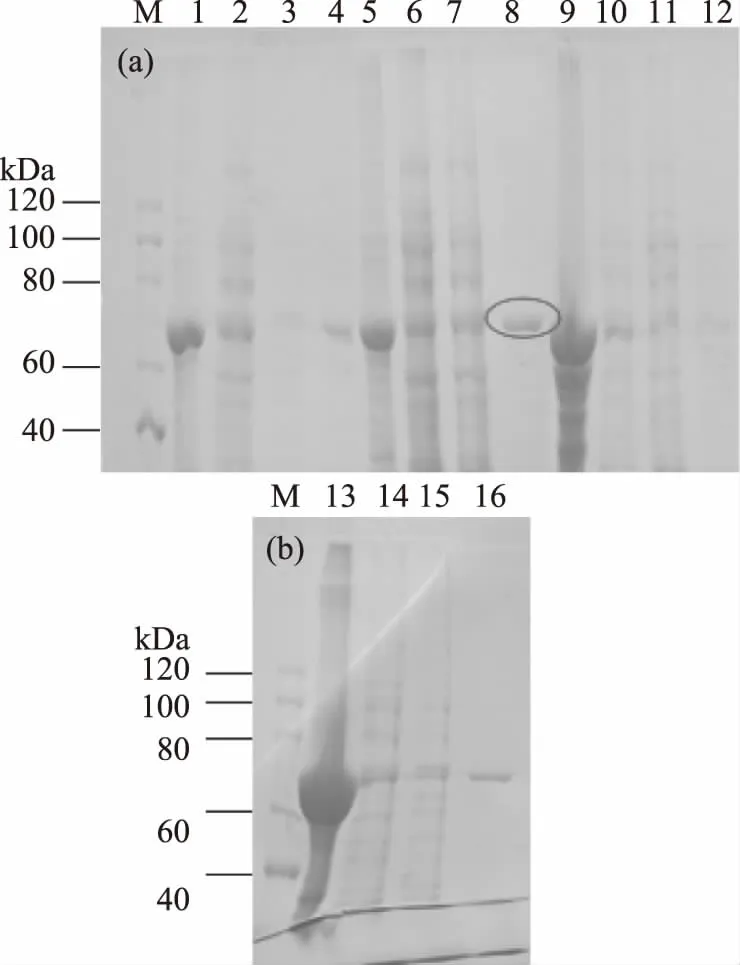
图6 诱导温度对可溶性MRNI浓度的影响Fig.6 Effects of induced temperature on soluble MRNI concentration注:M:预染蛋白质 Marker;1~4:16 ℃时诱导的重组菌裂解的沉淀、上清、纯化后的穿透和洗脱;5~8:20 ℃时诱导的重组菌裂解的沉淀、上清、纯化后的穿透和洗脱;9~12:25 ℃时诱导的重组菌裂解的沉淀、上清、纯化后的穿透和洗脱;13~16:30 ℃时诱导的重组菌裂解的沉淀、上清、纯化后的穿透和洗脱。
2.5.2 自诱导时间对可溶性蛋白表达量的影响 通过12%聚丙烯酰胺凝胶可以看出,诱导后菌体表达量因时间增加而变多[11],如图7,在诱导 24 h 时,MRNI 表达量最高,同时菌体内的蛋白酶对重组蛋白的降解也会增加,所以过长时间的诱导对重组蛋白的表达反而有害[11],MRNI 的表达量也会降低,确定最佳诱导时间是24 h。

图7 不同表达时间对MRNI表达的影响Fig.7 Effect of different expression time on MRNI expression注:M:蛋白质 Marker;1~11:诱导表达时间分别为 12、14、16、17、18、20、21、22、23、24、26 h的菌体。
2.5.3 MagNi磁珠纯化 如图8所示,穿透中有极少量IF2-MRNI,但漂洗中几乎看不到蛋白条带,证明蛋白与磁珠结合情况较好,收集洗脱蛋白只有一条大小为是69.6 kDa的清晰带,同期望一致,纯化量高。
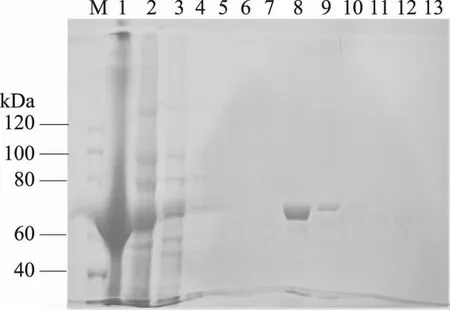
图8 磁珠纯化MRNI的12%聚丙烯酰胺凝胶分析Fig.8 12% polyacrylamide gel analysis of MRNI purified by magnetic beads注:M:蛋白质Marker;1:菌体裂解后的沉淀;2:菌体裂解后的上清;3:纯化穿透峰;4~7:纯化杂蛋白漂洗;8~13:第1次到第6次分批次洗脱得到的MRNI。
2.5.4 重组蛋白 IF2-MRNI 的浓度测定 用酶标仪测得562 nm处吸光值为2.9248,根据蛋白浓度标准曲线(图9),可计算出所测蛋白浓度为3621.3 mg/L。
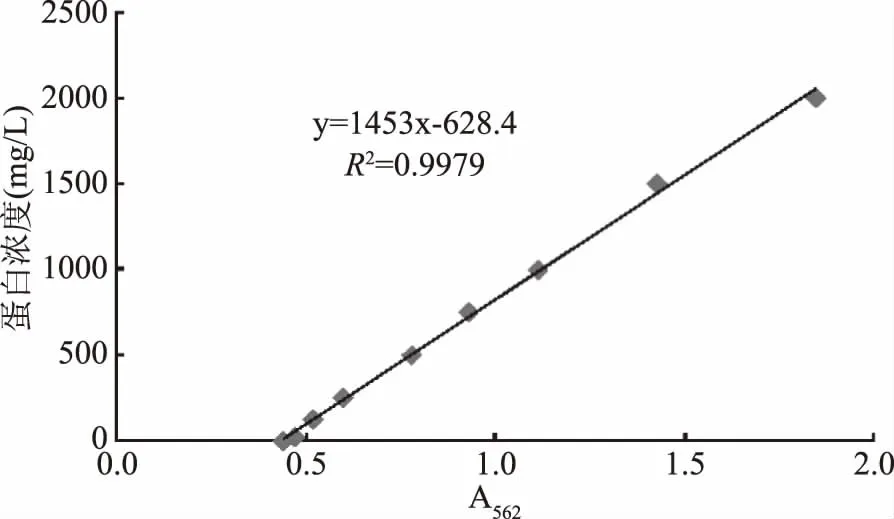
图9 BCA蛋白浓度测定标准曲线Fig.9 BCA protein concentration determination standard curve
2.5.5 融合蛋白IF2-MRNI的活性检测 如图10,泳道2、3、6、7、8的RNA均降解;由泳道4、5看出,加入购买的RI超过0.8 μL时,RNA不会降解,由泳道9、10看出,纯化后的IF2-MRNI加入超过1 μL时,RNA不会降解。与购买的RI对比,可得酶活力大约为40 U/μL。
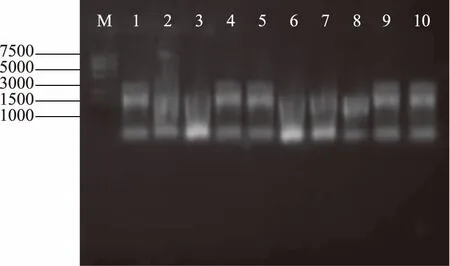
图10 MRNI酶活性检测Fig.10 Detection of MRNI enzyme activity注:M:DNA marker;泳道1:提取的植物叶片RNA;泳道2~5:加入体积为0.4、0.6、0.8、1.0 μL购买的RI;泳道6~10:加入体积分别为0.4、0.6、0.8、1.0、1.2 μL IF2-MRNI。
3 结论
本实验构建了含SUMO、IF2、GST、NusA、MsyB、Trx和MBP融合标签的重组表达载体,通过磁珠纯化法检测可溶性表达情况,最终筛选出表达量高的重组菌BL21(DE3)(pNBEII-MRNI),通过优化温度和时间确定最佳自诱导条件:37 ℃培养6 h,20 ℃培养24 h。通过磁珠纯化法检测并得到表达量高的融合蛋白IF2-MRNI,浓缩脱盐后利用BCA法测定其浓度为3621.3 mg/L。利用IF2-MRNI抑制RNA酶水解RNA的能力测定其活性,得到的融合蛋白酶活约为40 U/μL。为了实现IF2-MRNI的可溶性表达,利用融合标签构建表达载体,选取BL21(DE3)作为宿主菌及采用低温诱导。但因蛋白质性质不同,促进可溶性表达的方法自然不同,所以使MRNI达到最高表达量的方法还需深入探索。通过上述实验可知,低温条件更有利于蛋白的正确折叠及可溶性表达。

