甘蔗内生菌分离鉴定及功能多样性研究
刘鲁峰 寸海春 何鹏飞 狄义宁 吴毅歆 何丽莲 李富生 何月秋
摘 要 為探究甘蔗内生菌多样性组成及相关特性,本研究采用稀释涂板法分离并结合形态观察和分子标记(gyrB, rpoB, ITS, 16S rDNA)进行鉴定。结果表明,从12个栽培品种(系)和5个野生种无性系的根、茎、叶组织中共分离到细菌589株、放线菌34株和真菌46株;细菌中固氮菌有41株,溶磷菌有98株,解钾菌有52株,对黄曲霉和禾谷镰刀菌具有拮抗作用分别有44株和35株。内生细菌分属21个属,其中芽孢杆菌属、伯克氏菌属、肠杆菌属和泛菌属为优势属;内生真菌分属于枝顶孢属、链格孢属、曲霉属、镰刀菌属、枝孢属等17个属,而放线菌仅为链霉菌属。具有潜在植物益生功能的菌株主要集中在芽孢杆菌属、伯克氏菌属、肠杆菌属、假单胞菌属、不动杆菌属、类芽孢杆菌属及泛菌属。本研究显示甘蔗栽培品种(系)和野生种无性系均含有丰富的内生菌资源,且栽培品种(系)所含内生菌在数量和多样性上均高于野生种无性系;12个栽培品种(系)间所分离到的内生细菌大部分相同,但也存在差异。通过初步的功能鉴定,筛选出一些具有应用潜力的益生微生物,为开发相应功能的生物菌剂奠定基础。
关键词 甘蔗;内生菌;分离;鉴定;功能多样性
中图分类号 S566.1 文献标识码 A
Abstract To investigate the diversity composition of sugarcane endophytes and the beneficial characteristics, dilution-plating, morphological observation and molecular marker (gyrB [gyrase beta-subunit], rpoB [RNA polymerase beta-subunit], ITS [integrated transcribed space], 16S rDNA) were used in the combination and several room assays such as phosphate-, potassium-solubilizations and antagonistism tests. The results showed that 589 bacterial, 34 actinomycetic and 46 fungal strains were isolated from the root, stem and leaf tissues of 12 sugarcane varieties and 5 wild species, of which 41 strains could fix nitrogen, 98 and 52 strains solubilize phosphate and potassium respectively, 44 and 35 strains were antagonistic to Aspergillus flavus and Fusarium graminearum, respectively. The endophytic bacteria belonged to 21 genera, among them Bacillus, Burkholderia, Enterobacter and Pantoea were the dominant. The endophytic fungi were classified into 17 genera, Acremonium, Alternaria, Aspergillus, Ceriporia, Cladosporium, etc., while actiomycetes was Streptomyces only. The strains with plant beneficial potentials were mainly clustered into Bacillus, Burkholderia, Enterobacter, Pseudomonas, Acinetobacter, Paenibacillus and Pantoea. The study showed rich endophyte resources both in the sugarcane varieties and wild species interior, and the number and diversity of endophytes in the cultivated varieties were higher than that of wild species. Most of the endogenous bacteria isolated from 12 sugarcane cultivars were the same, but there were differences. Through preliminary functional identification, some probiotics with application potential were screened out, which laid a foundation for the development of biological agents with corresponding functions.
Keywords sugarcane; endophytic microbe; isolation; identification; functional diversity
DOI 10.3969/j.issn.1000-2561.2019.06.016
植物内生菌是指生活史中某一段生活在植物组织内,对植物没有明显病害症状的一类微生物,主要包括内生细菌、内生真菌和内生放线菌[1-2]。19世纪中期,人们就开始了对植物内生菌的初步探索和研究,直到1977年Bacon等发现高羊茅内生真菌与牛的中毒症状有关之后[3],植物内生菌的研究工作才引起广泛的关注。特别是1993年Stierle首次报道了从短叶紫杉的韧皮部分中分离出一株内生真菌(Taxomyces andreanae)能产生紫杉醇[4],再次掀起了研究植物内生菌的热潮。目前各国科研人员已在80多个属中290多种禾本科植物发现有内生菌,在农作物和经济作物中的内生细菌已超过129种,54个属被报道,发现的内生细菌主要集中在芽孢杆菌属(Bacillus)、假单胞菌属(Pseudomonas)、克雷伯氏菌属(Klebsiella)、肠杆菌属(Enterobacter)等[5]。内生真菌则主要集中在子囊菌类(Ascomycet)及其无性型[6],内生放线菌则以链霉菌属(Streptomyces)、诺氏卡菌属(Nocardia)、小单胞菌属(Micromonospora)为主[7]。
植物内生菌可以通过提高营养物质及矿物质的循环利用促进植物生长,改善土壤条件,提高化肥利用率,保护植物免受病原菌的侵害。目前研究表明植物内生菌具有固氮、溶磷和解钾功能,尤其是固氮作用研究较多,而内生固氮菌多为内生固氮细菌,大多分离自健康植物组织器官中,主要包括固氮螺菌(Azospirillum spp.)、重氮营养醋杆菌(Acetobacter diazotrophicus)、多黏类芽孢杆菌(Paenibacillus polymyxa)、克雷伯氏菌(Klebsiella spp.)、成团肠杆菌(Enterobacter agglomerans)、阴沟肠杆菌(Enterobacter cloacae)、草螺菌(Herbaspirillum spp.)、固氮弧菌(Azoarcus spp.)、粪产碱菌(Alcaligenes faecalis)、伯克霍尔德氏菌(Burkholderia spp.)等[8]。而溶磷和解钾微生物更多的是从植物根际土壤中进行筛选分离得到,从植物中分离溶磷和解钾内生菌的研究相对较少。Chen等[9]从北京官厅水库的水生植物芦苇、菹草、睡莲和茨藻中分离获得了36株具有溶磷作用的细菌;郭莹等[10]从寒区富营养化水体中的健康穗花狐尾藻植株内分离获得了一株具有溶磷作用的沙雷氏菌属内生菌SP5。有时也能分离到兼具固氮溶磷解钾的多功能菌株,如阳洁等[11]从广西药用野生稻(Oryza officinalis)中筛选出4株具有高效溶磷解钾的内生固氮菌。
植物内生菌在拮抗病原菌方面的研究也取得了长足进展。Strobel团队和Li团队分别证实了从雷公藤分离到的内生真菌Cryptosporiopsis cf. quercina对核盘菌、灰葡萄孢和稻瘟病菌等多种植物病原微生物有拮抗作用[12-13]。何红等从辣椒中分离到的108株内生细菌有约1/4的菌株对香蕉枯萎病菌、黄瓜枯萎菌有拮抗作用,其中1株枯草芽孢杆菌对植物炭疽病菌和番茄青枯病菌等有强烈的抑制作用[14-15]。袁军等从马铃薯中分离到40株内生细菌对环腐病菌有不同程度的拮抗作用[16]。Mitchell等从野生凤梨中分离的内生真菌Muscodor crispans不仅对植物病原菌腐霉、樟疫霉、核盘菌、球腔菌有抗菌活性,对人的病原菌鼠疫杆菌、结核分枝杆菌和葡萄球菌也有抗菌活性[17]。王霞等从植物菘蓝中对分离到4株对植物病原菌禾谷镰刀菌、链格孢霉、大斑凸脐蠕孢有很强拮抗活性的内生细菌[18]。研究人员还从棉花、大蒜、酸枣等植物中分离到大量对病原菌有拮抗作用的内生菌。
甘蔗是重要的糖料作物和能源作物,甘蔗内生菌最早发现于1961年,迄今已有10种以上的内生菌种属在美洲、澳洲和亞洲甘蔗体内被分离,国内外甘蔗内生菌研究大部分集中在固氮菌方面[19-21],与甘蔗有关的溶磷解钾菌大多分离自甘蔗根际土壤[22]。学者们主要从甘蔗的根际土或根或茎叶中分离甘蔗内生细菌[23-25],对于甘蔗内生真菌及放线菌的分离研究较少,同时从甘蔗野生种及栽培种分离内生菌鲜有报道。我国甘蔗内生菌相关研究起步较晚,迄今为止未分离到适合我国生态条件下的稳定高效甘蔗内生菌互作模式菌株,而从国外引进的具良好特性的甘蔗品种在我国种植也难以获得在其原产地同样的高促生效率[26]。因此本研究从12个栽培品种(系)及5个野生种无性系的根、茎、叶中分离内生真菌、细菌、放线菌,并对分离到的内生菌进行分子鉴定,初步探讨甘蔗野生种及栽培种根、茎、叶部内生菌的多样性,并获得具有应用价值的益生微生物,为后续甘蔗的病虫害防治以及促生抗逆提供优良的菌种资源储备。
1 材料与方法
1.1 材料
植物材料:12个甘蔗栽培品种/系——新台糖10、新台糖22、粤糖86-368、粤糖93-359、桂糖11、云蔗99-91、闽糖69-421、崖城89-9、滇蔗01-47、滇蔗01-58、滇蔗04-14、滇蔗09-38,代号分别设为ROC10、ROC22、YT86、YT93、GT11、YZ99、MT69、YC89、DZ47、DZ58、DZ14、DZ38;5个甘蔗野生资源无性系——割手密(Saccharum spontaneum)、斑茅(Saccharum arundinaceum)、蔗茅(Erianthus fulvus)、五节芒(Miscanthus floridulus)、河八王(Saccharum narenga),代号分别设为SS、SA、EF、MF、SN。这些材料均种植于云南农业大学甘蔗研究所资源圃。
菌株:植物病原真菌禾谷镰刀菌(Fusarium graminearum)及黄曲霉菌(Aspergillus flavus)、洋葱伯克霍尔德氏菌(Burkholderia cepacia)1-2菌株,均保存于本实验室。
培养基:LB固体及液体培养基、PDA培养基、高氏一号培养基[27]、察氏(Czapek)培养基[27]、NBRIP培养基[10]、Pikovskaya(简称PVK)培养基[28]、Ashby无氮培养基[29]及Aleksandrov培养基[30]分别用于细菌、真菌及放线菌分离扩繁,以及解无机磷、固氮、解钾和拮抗试验。
1.2 方法
1.2.1 内生菌的分离纯化及形态观察 采用研磨稀释涂板法分离不同甘蔗品种和野生无性系植株健康组织内部的微生物。从一年生宿根甘蔗分蘖期植株上分别剪取健康的根、茎及叶组织,用毛笔轻轻刷除其上所附着的土壤颗粒,随后使用自来水冲洗2~3 min以去除表面多余的杂质,滤纸吸干表面水分。取上述预处理过的各组织1.0 g,用75%酒精浸泡根组织3 min,茎、叶组织1 min;再用1% NaClO溶液消毒根组织6 min,茎、叶组织3 min;再用无菌水各漂洗6次以除去消毒剂;最后使用无菌滤纸吸干残留的水分。吸取最后一次漂洗的无菌水100 μL涂布于PDA、LB和高氏一号培养基平板,验证消毒效果。将消毒好的组织样品放入无菌研钵中,并向其内加入9 mL无菌水,研磨至成匀浆状,然后10倍梯度稀释,取一定体积的适当梯度稀释液至PDA、LB和高氏一号固体培养平板上,均匀涂布,最后置于适宜的温度下培养。挑选菌落形态不同的单菌落纯化,并将形态大部分相似的菌落划归为同一类,保存菌株备用。
1.2.2 具有溶磷、解钾或固氮活性内生细菌的平板筛选 从–80 ℃冰箱中取出内生细菌的甘油贮液,室温放置,待其呈熔融状态。在超净台上用无菌牙签蘸取少许甘油菌液,分别点接于无氮Ashby、PVK溶磷或解钾固体平板上,置于30 ℃恒温箱中倒扣培养4~5 d;以溶磷细菌洋葱伯克霍尔德氏菌1-2菌株为正对照,观察菌落周围有无水解圈的出现,测量菌落直径的大小并将其与对照菌株作比较,初步判断内生细菌的固氮、溶磷及解钾能力,并做好相关记录和拍照留存。
1.2.3 拮抗禾谷镰刀和黄曲霉菌的内生细菌筛选 (1)平板点菌初筛。从–80 ℃冰箱中取出粘有禾谷镰刀菌菌丝或黄曲霉菌分生孢子的滤纸片,分别置于PDA平板中央,25~28 ℃培养3~5 d以活化病原真菌;使用无菌接种针在活化菌落的边缘挑取含有菌丝的琼脂块,转接于盛有20 mL液体Czapek培养基的50 mL规格三角瓶中,28 ℃,150 rpm振摇培养5 d;血球计数板计数,使用无菌水将其孢子浓度调整为106 CFU/mL,用移液器吸取200 μL上述调整后的菌丝体(或分生孢子)溶液,均匀涂布于PDA平板;用无菌牙签蘸取少许内生细菌的甘油菌液,点接于上述PDA平板,每株細菌点取3次;28 ℃恒温培养3~5 d,观察点菌处有无明显的抑菌圈。根据抑菌圈的有无及大小初筛出具有拮抗活性的内生细菌。(2)平板对峙复筛。仿上述操作活化禾谷镰刀菌或黄曲霉菌。使用0.5 mm打孔器打取菌丝块,无菌接种针挑取菌丝块转接并倒贴于新鲜制备的PDA平板(9.0 cm)中央处,同时用无菌牙签蘸取初筛出的甘油菌液,四点法点接于距离病原菌丝块中心3.0 cm处;28 ℃培养3~5 d后,测量病原真菌的菌落直径及内生细菌的菌落大小,进一步复筛出具有较强拮抗活性的内生细菌。以未接内生细菌的病原真菌平板为空白对照。
1.2.4 甘蔗内生菌的分子鉴定 内生细菌基因组DNA的提取参考Cheng[31]提出的方法,内生真菌的基因组DNA提取方法采用EDTA-SDS方法[29],内生放线菌鉴定所用的DNA模板按如下步骤制备:用一无菌牙签挑取单菌落,转入含有27 μL TE缓冲液的无菌离心管内,充分分散混匀;随后向离心管内加入27 μL KOH(0.4 mol/L)- EDTA(10 mmol/L)裂解液,70 ℃水浴5 min;水浴结束后,向上述混合反应液加入3 μL Tris-HCl(pH 4.0)以中和裂解液,12000 r/min室温离心5 min,此时的上清液即可作为PCR的DNA模板。
使用gyrB和rpoB基因PCR及测序鉴定内生细菌的种属地位[32],真菌和放线菌鉴定所用的分子标记则分别是ITS[33]和16S rDNA[34]。除了扩增引物有所差异外,三者鉴定所配制的PCR体系完全相同,具体如下(以20 μL为例):无菌ddH2O
13.7 μL,10×EasyTaq buffer (+Mg2+)2.0 μL, dNTPs 1.6 μL,上下游引物各1.0 μL,EasyTaq DNA聚合酶 0.2 μL,基因组DNA模板0.5 μL。PCR程序参数如下:94 ℃预变性270 s,30个循环体(94 ℃变性30 s,52 ℃退火40 s,72 ℃延伸90 s,真菌ITS扩增的延伸时间为45 s),72 ℃最终延伸10 min,16 ℃保存。PCR结束后,点样于0.8%琼脂糖凝胶上,90 V电泳40~50 min,凝胶成像观察条带有无及正确与否。最后送交符合预期的PCR产物样品至昆明硕擎生物公司测序。将测序结果与NCBI的GenBank数据库中的相关同源序列比对,根据序列的一致性,确定内生菌的种属分类。
2 结果与分析
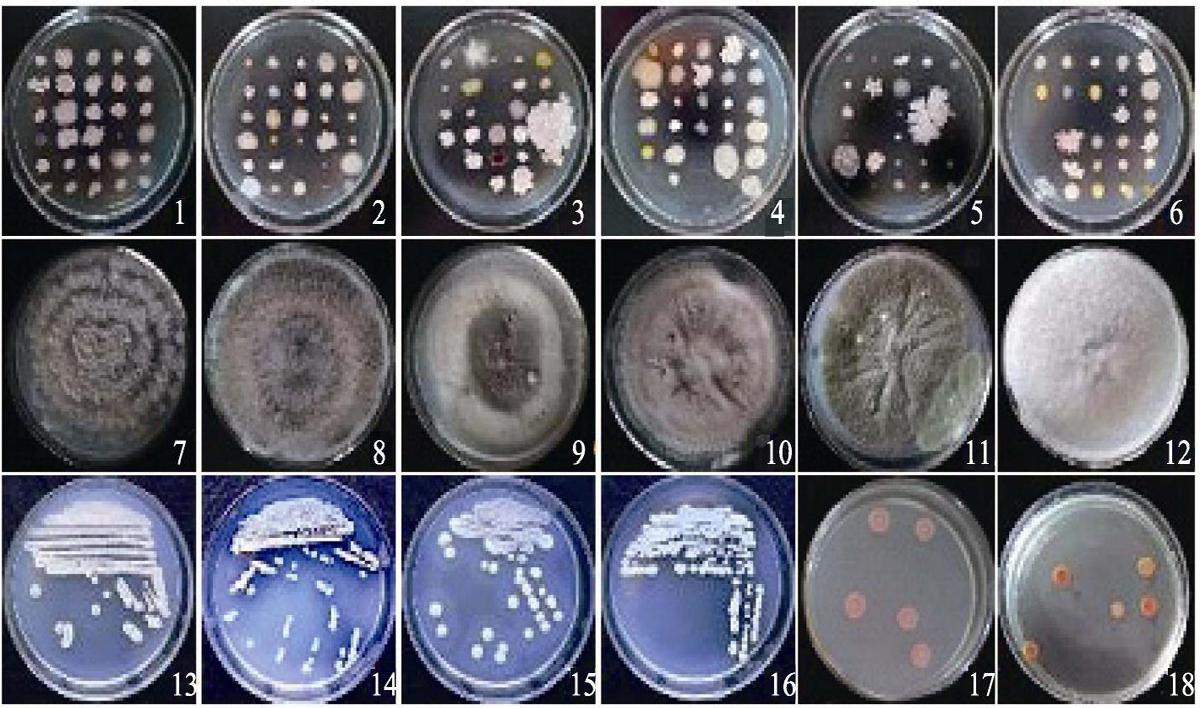
2.1 内生菌的分离纯化及形态观察通过组织表面消毒及研磨稀释的分离与后续纯化操作,从包括野生资源在内的17份甘蔗材料中共计分离到589株细菌、34株放线菌和46株真菌。从不同组织分离的内生菌数量表现为根>茎>叶。根据菌落形态、背面色泽等指标,初步将所分离到的589株细菌划归为161类,放线菌划分成6类。部分内生菌的室内培养形态如图1所示。
2.2 具有溶磷、解钾或固氮活性内生细菌的平板筛选通过在上述相应的检测平板上点菌,发现部分甘蔗内生菌至少有溶磷、固氮或解钾活性的一种或多种。根据平板点菌结果,显示具有溶磷、
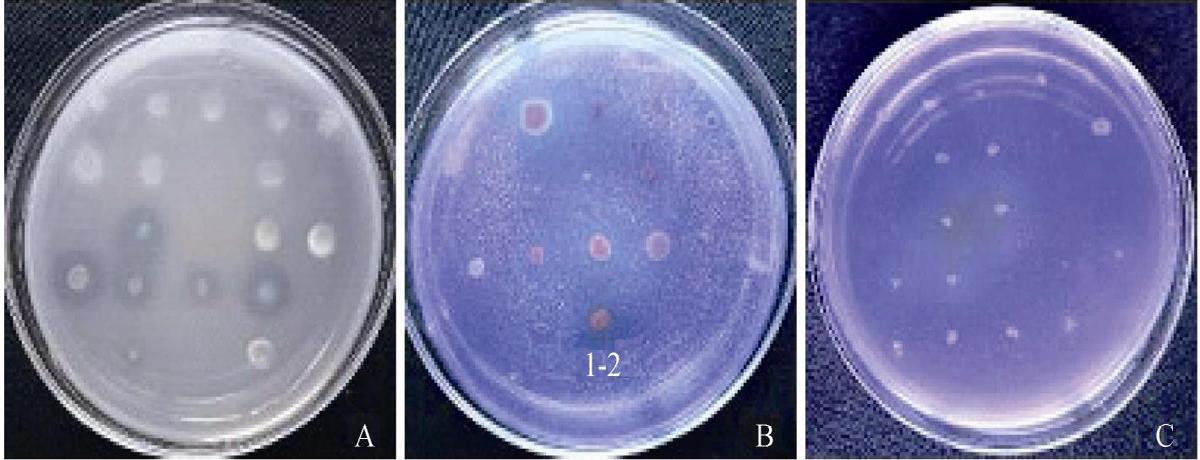
1~6:生长于LB平板的内生细菌; 7~12:生长于PDA平板的内生真菌; 13~18:高氏培养基上的内生放线菌。固氮或解钾活性的内生细菌分别有98、41及52株。与伯克霍尔德氏1-2菌株相比,某些甘蔗内生细菌的溶磷圈直径与之相当(图2 B)。另外还有些细菌虽无法在NBRIP、Ashby或Aleksandrov平板上形成透明圈,但是菌落直径较大或隆起,生物累积量较大,显示其可能也具有一定的溶磷、固氮或解钾活性(图2)。
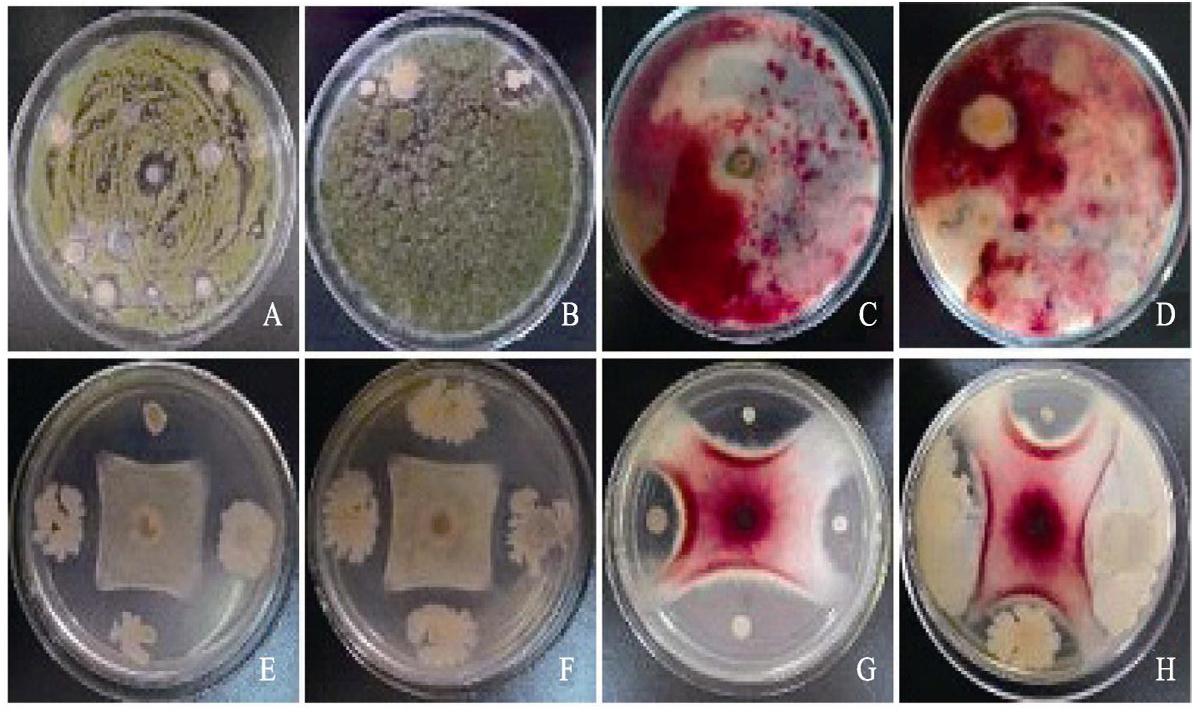
2.3 拮抗禾谷镰刀和黄曲霉菌的内生细菌筛选通过在含有相应病原真菌培养基的平板上点菌,初步统计,能抑制黄曲霉的有44株,能抑制禾谷镰刀菌的35株(图3)。
2.4 甘蔗内生菌的分子鉴定序列扩增后均得到单一且明亮的条带,与预期大小一致。将所获得的所有序列片段与NCBI中已知序列进行Blast比对,内生细菌有21个属(表
1)。内生真菌有17个属,分别为枝顶孢属(Acremonium)、链格孢属(Alternaria)、曲霉属(Aspergillus)、腊孔菌属(Ceriporia)、枝孢属(Cladosporium)、粉红粘帚霉(Clonostachys rosea)、鬼伞属(Coprinellus)、间座壳属(Diaporthe)、镰刀菌属(Fusarium)、赤霉菌属(Gibberella)、耙齿菌属(Irpex)、青霉菌属(Penicillium)、平革菌属(Phanerochaete)、射
A:Ashby无氮平板;B:含有25 mg/L溴酚蓝的PVK平板;C:含有25 mg/L溴酚蓝的解钾平板。
2.5 甘蔗内生菌在不同品种(系)中分布情况在细菌的21个属中,芽孢杆菌属为优势属,其次为伯克氏菌属,紧接着为肠杆菌属和泛菌属;栽培种分离到的菌株多于野生种,且分离频次平均高35.8%(表1)。分离到的17个内生真菌属中镰刀菌属为优势属,甘蔗栽培种中分离到的菌株也是多余野生种,其中从崖城89-9栽培种中分离到的属种类最多(表2)。氮的有11株,解磷的有16株,解钾的有8株;芽孢杆菌属固氮、溶磷、解钾的分别有5、32、11株,抑制黄曲霉的有32株,抑制禾谷镰刀菌的有15株。
3 讨论
在甘蔗中,只是单方面的从栽培品种或甘蔗植株中的某一个组织中分离内生菌,大部分的研究主要是集中在固氮菌以及促生长的研究上[35],尽管现在大家对微生物的兴趣日益浓厚,但大多数研究仅限于土壤和根系样本或茎部,此外都是比较有目的性的分离内生细菌,对于真菌及放线菌的分离报道也比较少。本研究为了尽可能多分离到多样性的可培养内生菌,采用了非选择性和选择性培养基相结合的方法同时对野生种及栽培种内生菌进行分离、纯化。获得的内生细菌和真菌分属于21个属和17个属,显示了较为丰富的多样性,而内生放线菌仅为单一的链霉菌属。栽培品种(系)所含内生菌在数量和多样性上均高于野生种无性系,但野生种中也分离到栽培种中没有的短波单胞菌属。这些差异将有助于推动对野生种内生菌的研究。这与谭志远等[36]、王丽等[23]、胡春锦等[26]分离到的内生菌存在一定差异,可能是所用的培养基、生长地域、采样时间、种质资源、宿根年限、采样部位等不同所造成的。今后还有待于对原生境中的野生种内生菌进行分离鉴定,与资源圃保种中的进行比较研究,从而进一步认识内生菌在不同地域环境中的联系和变化。同时下一步有必要研究亲本和后代之间的内生菌的关联,从而从遗传关系上寻找内生菌与甘蔗互作的规律。当然要比较客观反映内生菌群多样性,还需借助宏基因组学等方法对不可培养的内生菌群进行分析研究[37-38]。
在生防菌中,芽孢杆菌属是非常有应用前景的[39-41]一大类。特别是枯草芽孢杆菌和解淀粉芽孢杆菌对环境安全,具有良好的定殖能力且能保护植物免受病原真菌的侵害[42],还有促生长的作用[43]。目前伯克霍尔德氏菌属在内生菌中占据着很重要的位置。Luvizotto 等[44]从巴西甘蔗根部分离到的内生细菌中有39株为伯克氏菌属细菌,它们在固氮、溶磷、产吲哚乙酸及产嗜铁素方面至少占有双重功能。Lin等[45]研究表明肠杆菌属细菌可以固定空气中游离氮以及促进甘蔗生长并提高甘蔗产量。Mehnaz等[46]发现巴基斯坦的甘蔗中分离出的内生肠杆菌属占据主导地位。Taulé等[47]也证明乌拉圭的甘蔗植株中,肠杆菌属也是内生菌中一个重要组成部分。Tam等[48]认为肠杆菌属、无色细菌属及泛菌属内生菌,有利于甘蔗在贫瘠的砖红壤土及强淋溶土中生长。Mendes等[49]从巴西甘蔗根和茎内分离到4个菌属内生菌中以伯克霍尔德菌属为优势菌群。Roci等[50]在墨西哥甘蔗栽培種中分离到伯克霍尔德菌的多个种类,并在促进植物生长方面具有潜能。本研究的结果与前人研究结果相似[51-52],芽孢杆菌属、伯克氏菌属、肠杆菌属、泛菌属、不动杆菌属、土壤杆菌属、假单胞菌属、微杆菌属及根瘤菌属在大部分甘蔗品种均能高频率地分离到。固氮、溶磷、解钾、拮抗等功能菌株也主要集中在芽孢杆菌属、伯克氏菌属、肠杆菌属、假单胞菌属、不动杆菌属、类芽孢杆菌属及泛菌属,可见厚壁菌门和变形菌门中的主要类群可能对植物的生长发育、增强抗性等发挥较大的作用,也是甘蔗生产上最有应用潜力的类群。本研究分离获得的功能菌株大多数生长速度较快,有部分菌株兼具固氮、溶磷、拮抗等功能,其在根际土壤中的存活定居的可能性大,将来有可能开展这些菌株对甘蔗的实际促生长效应、生态安全评估和最佳的生长条件进行研究,从而为下一步制成可施用于蔗田的菌剂产品储备菌种资源。
参考文献
[1]贾 栗, 陈疏影, 翟永功, 等. 近年国内外植物内生菌产生物活性物质的研究进展[J]. 中草药, 2007, 38(11): 1750-1754.
[2]江 曙, 钱大玮, 段金廒, 等. 植物内生菌与道地药材的相关性研究[J]. 中草药, 2008, 39(8): 1268-1272.
[3]Bacon C W, Porter J K, Robbins J D, et al. Epichloe typhina from toxic tall fescue grasses[J]. Applied and Environmental Microbiology, 1977, 34(5): 576-581.
[4]Stierle A, Strobel G, Stierle D. Taxol and taxane production by Taxo-myces andreanae, an endophytic fungus of Pacific yew[J]. Science, 1993, 260(5105): 214-216.
[5]方珍娟, 张晓霞, 马立安. 植物内生菌研究进展[J]. 长江大学学报(自科版), 2018, 15(10): 41-45.
[6]张婉婷, 张灵枝. 茶树内生真菌的研究进展[J]. 中国茶叶加工, 2011(4): 32-36.
[7]石晶盈, 陈维信, 刘爱媛. 植物内生菌及其防治植物病害的研究进展[J]. 生态学报, 2006, 26(7): 2395-2401.
[8]张祺玲, 杨宇红, 谭周进, 等. 植物内生菌的功能研究进展[J]. 生物技术通报, 2010, 7: 28-34.
[9]Chen W M, Tang Y Q, Mort K, et al. Distribution of culturable endophytic bacteria in aquatic plants and their potential for bioremediation in polluted waters[J]. Aquatic Biology, 2012, 15 (2): 99-110.
[10]郭 莹, 秦玉莹, 鞠天琛, 等. 一株穗花狐尾藻内生菌的分离鉴定及其溶磷特征研究[J]. 环境科学学报, 2016, 36(12): 4352-4360.
[11]阳 洁, 秦莹溪, 王晓甜, 等. 广西药用野生稻内生细菌多样性及促生作用[J]. 生态学杂志, 2015, 34(11): 3094-3100.
[12]Strobel G A, Miller R V, Martinez M C, et al. Cryptocandin, a potent antimycotic from the endophytic fungus Cryptosporiopsis cf.quercina[J]. Microbiology, 1999, 145(8): 1919-1926.
[13]Li J Y, Strobel G, Harper J, et al. Cryptocin,a potent tetramic acid antimycotic from the endophytic fungus Cryptosporiopsis cf. quercina[J]. Organic Letters, 2000, 2(6): 767-770.
[14]何 红, 蔡学清. 辣椒内生细菌的分离及拮抗菌的筛选[J]. 中国生物防治, 2002, 18(4): 171-175.
[15]何 红, 蔡学清, 关 雄, 等. 内生菌BS-2菌株的抗菌蛋白及其防病作用[J]. 植物病理学报, 2003, 33(4): 373-378.
[16]袁 军, 孙福在. 防治马铃薯环腐病有益内生细菌的分离和筛选[J]. 微生物学报, 2002, 42(3): 270-274.
[17]Mitchell A M, Strobel G A, Moore E, et al. Volatile antimicrobials from Muscodor crispans, a novel endophytic fungus[J]. Microbiology, 2009, 156(Pt1): 270-277.
[18]王 霞, 薛林贵, 张晓华, 等. 菘蓝内生细菌的分离、筛选和鉴定[J]. 生物技术通报, 2018, 34(3): 163-169.
[19]胡春锦, 林 丽, 史国英, 等. 广西甘蔗根际高效联合固氮菌的筛选及鉴定[J]. 生态学报, 2012, 32(15): 4745-4752.
[20]魏春燕. 內生固氮菌DX120E与甘蔗互作的生理和分子生物学基础研究[D]. 南宁: 广西大学, 2016.
[21]张洪彬. 甘蔗及其根际土壤固氮菌的分离和特性研究[D]. 广州: 华南农业大学, 2016.
[22]狄义宁, 刘鲁峰, 谢林艳, 等. 一株甘蔗内生菌鉴定及其溶磷能力的研究[J]. 作物杂志, 2018(6): 68-75.
[23]王 丽, 张剑亮, 王继华, 等. 甘蔗茎部内生细菌的分离及分子鉴定[J]. 热带作物学报, 2013, 34(11): 2227-2232.
[24]邢永秀, 杨丽涛, 黄思良, 等. 甘蔗茎内两个内生菌株16SrRNA序列分析及其生长特性[J]. 微生物学报, 2008, 35(11): 1732-1737.
[25]史国英, 魏源文, 林 丽, 等. 1株甘蔗根际促生细菌的鉴定及其生物学功能研究初报[J]. 西南农业学报, 2016, 29(5): 1110-1114.
[26]胡春锦, 史国英, 曾 泉, 等. 两种不同土壤条件下可培养甘蔗内生固氮菌的多样性[J]. 中国土壤与肥料, 2017 (2): 141-148.
[27]沈 萍, 范秀容, 李广武, 等. 微生物学实验[M]. 3版. 北京: 高等教育出版社, 1999: 54.
[28]Gupta R, Singal R, Shankar A, et al. A modified plate assay for screening phosphate solubilizing microorganisms[J]. The Journal of General and Applied Microbiology, 1994, 40(3): 255-260.
[29]Sen M, Sen S P. Interspecific transformation in Azotobacter[J]. Microbiology, 1965, 41(1): 1-6.
[30]Prajapati K B, Modi H A. Isolation and characterization of potassium solubilizing bacteria from ceramic industry soil[J]. Centre for Info Bio Technology Journal of MicroBiology, 2012, 1(2-3): 8-14.
[31]Cheng H R, Jiang N. Extremely rapid extraction of DNA from bacteria and yeasts[J]. Biotechnology Letters, 2006, 28(1): 55-59.
[32]Yamamoto S, Harayama S. PCR amplification and direct sequencing of gyrB genes with universal primers and their application to the detection and taxonomic analysis of Pseudomonas putida strains[J]. Applied and Environmental Microbiology, 1995, 61(3): 1104-1109.
[33]White T J, Bruns T, Lee S, et al. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics[M]//Innis M A, Gelfand D H, Sninsky J J, et al. PCR protocols: a guide to methods and applications, San Diego: Academic Press 1990: 315-322.
[34]王 靖. 十字花科作物根肿病生防放线菌研究[D]. 雅安: 四川农业大学, 2011.
[35]Kruasuwan W, Thamchaipenet A. Diversity of culturable plant growth-promoting bacterial endophytes associated with sugarcane roots and their effect of growth by co-inoculation of diazotrophs and actinomycetes[J]. Journal of Plant Growth Regulation, 2016, 35(4): 1074-1087.
[36]譚志远, 傅琴梅, 彭桂香, 等. 青香茅和五节芒内生固氮菌的分离与生理生化鉴定[J]. 应用与环境生物学报, 2013, 19(4): 643-649.
[37]范念斯, 齐 嵘, 杨 敏. 未培养微生物的培养方法进展[J]. 应用与环境生物学报, 2016, 22(3): 524-530.
[38]Magnani G S, Cruz L M,Weber H., et al. Cuture-independent analysis of endophytic bacterial communities associated with Brazilian sugarcane[J]. Genetics and Molecular Research, 2013, 12 (4): 4549-4558.
[39]Choudhary D K, Johri B N. Interactions of Bacillus spp. and plants-with special reference to induced systemic resistance (ISR)[J]. Microbiological Research, 2009, 164(5): 493-513.
[40]Hobley L, Ostrowski A, Rao F V, et al. BslA is a self-assembling bacterial hydrophobin that coats the Bacillus subtilis biofilm[J]. Proceedings of the National Academy of Sciences, 2013, 110(33): 13600-13605.
[41]Ongena M, Jacques P. Bacillus lipopeptides: versatile weapons for plant disease biocontrol[J]. Trends in Microbiology, 2008, 16(3): 115-125.
[42]Zhao P, Quan C, Wang Y, et al. Bacillus amyloliquefaciens Q‐426 as a potential biocontrol agent against Fusarium oxysporum f. sp. spinaciae[J]. Journal of Basic Microbiology, 2014, 54(5): 448-456.
[43]Turner J T, Backman P A. Factors relating to peanut yield increases after seed treatment with Bacillus subtilis[J]. Plant Disease, 1991, 75(4): 347-353.
[44]Luvizotto D M, Marcon J, Andreote F D, et al. Genetic diversity and plant-growth related features of Burkholderia spp. from sugarcane roots[J]. World Journal of Microbiology and Biotechnology, 2010, 26(10): 1829-1836.
[45]Lin L, Li Z, Hu C, et al. Plant growth-promoting nitrogen-fixing enterobacteria are in association with sugarcane plants growing in Guangxi, China[J]. Microbes and Environments, 2012, 27(4): 391-398.
[46]Mehnaz S, Baig D N, Lazarovits G. Genetic and phenotypic diversity of plant growth promoting rhizobacteria isolated from sugarcane plants growing in Pakistan[J]. Journal of Microbiology and Biotechnology, 2010, 20(12): 1614-1623.
[47]Taulé C, Mareque C, Barlocco C, et al. The contribution of nitrogen fixation to sugarcane (Saccharum officinarum L.), and the identification and characterization of part of the associated diazotrophic bacterial community[J]. Plant and Soil, 2012, 356(1-2): 35-49.
[48]Tam H M, Diep C N. Isolation, characterization and identification of endophytic bacteria in sugarcane (Saccharum spp. L.) cultivated on soils of the Dong Nai province, Southeast of Vietnam[J]. American Journal of Life Sciences, 2014, 2(6): 361-368.
[49]Mendes R, Pizzirani-Kleiner A A. Araujo W L, et al. Diversity of Cultivated Endophytic Bacteria from Sugarcane: Genetic and Biochemical Characterization of Burkholderia cepacia Complex Isolates[J]. Applied and Environmental Microbiology, 2007, 73(22): 7259-7267.
[50]Rocio C G, Lourdes M A, Augusto R T, et al. High diversity of culturable Burkholderia species associated with sugarcane[J]. Plant & Soil, 2011, 345 (1-2) : 155-169.
[51]Magnani G S, Didonet C M, Cruz L M, et al. Diversity of endophytic bacteria in Brazilian sugarcane[J]. Genetics and Molecular Research, 2010, 9(1): 250-258.
[52]Pereira P, Ibá?ez F, Rosenblueth M, et al. Analysis of the bacterial diversity associated with the roots of maize (Zea mays L.) through culture-dependent and culture-independent methods[J]. ISRN Ecology, 2011: 1-9.

