朱砂叶螨转录因子TcNrf2对抗氧化酶基因表达的调控功能初步研究
高锦涛 梁晓 伍春玲 陈青 陈谦
摘 要 转录因子Nrf2对模式生物抗氧化酶的调控起关键作用,但迄今为止尚未见Nrf2具有对害螨抗氧化酶调控功能相关报道。本研究将模式生物研究中已知的Nrf2基因抑制剂、激活剂处理朱砂叶螨,通过抑制、激活其转录因子TcNrf2的表达,研究其对下游调控的抗氧化酶基因TcSOD和TcCAT表达的影响。结果表明,采用抑制剂护鸦胆子苦醇处理时,朱砂叶螨取食抗、感木薯品种1、4、8 d后,TcNrf2、TcSOD和TcCAT的基因表达量均显著降低,而采用抑制剂视黄酸处理时上述基因表达不受影响;采用激活剂特丁基对苯二酚和二噻环戊二烯硫酮分别处理后,朱砂叶螨TcNrf2、TcSOD和TcCAT的基因表达量均显著提高,说明TcNrf2及其调控的TcSOD和TcCAT基因表达量变化趋势具有一致性。本研究从分子水平直接证明TcNrf2基因在木薯抗螨中具有重要作用,为木薯抗螨分子机理研究奠定理论基础。
关键词 木薯;朱砂叶螨;转录因子TcNrf2;调控功能
中图分类号 S433.1;S433.7 文献标识码 A
Abstract The transcription factor Nrf2 plays a key role in the regulation of antioxidant enzymes in model organisms, but up to now, there was a lack of study indicating that Nrf2 can regulate antioxidant enzymes in mites. In this study, the Nrf2 inhibitors and activators were used to treat with the red spider mite (Tetranychus cinnabarinus). The transcription of TcSOD and TcCAT were studied by inhibiting and activating the transcription factor TcNrf2. The results showed that the transcriptions of TcNrf2, TcSOD and TcCAT decreased significantly after feeding on mite-resistant and mite-susceptible cassava cultivars for 1, 4 and 8 d, while were not affected by retinoic acid treatment. However, the transcription of those genes significantly increased after treated by TBHQ (tert-butylhydroquinone) and D3T (1,3-dithiole-2-thione-4,5-dithiolat), respectively, suggesting that the transcriptions of TcNrf2 and its regulated TcSOD and TcCAT genes were consistent. This study directly proves that TcNrf2 gene plays an important role in cassava mite resistance at the molecular level, which would lay a theoretical foundation for the molecular mechanism of mite resistance to cassava.
Keywords cassava; Tetranychus cinnabarinus; transcription factor TcNrf2; regulation function
DOI 10.3969/j.issn.1000-2561.2019.06.018
木薯(Manihot esculenta Crantz)是世界近8億人口赖以生存的主粮和重要的工业原料、饲料、生物质能源和救荒作物[1],在世界粮食安全、生物质能源和食品加工等领域发挥着非常重要的作用,并作为“先锋作物”在服务国家“一带一路”发展战略中的优势日益突出[2]。2018年8月22日国务院召开常务会议,明确加快建设木薯燃料乙醇项目。木薯产业的发展一直受到国家和省部领导的高度重视。
朱砂叶螨(Tetranychus cinnabarinus)是为害木薯最为严重的一种世界危险性害螨[3],主要刺吸植物叶片汁液为害,引起叶片黄化,危害严重时导致整株死亡。目前该螨已在我国木薯种植区地严重发生与成灾,导致减产20%~30%,严重时减产50%~70%,严重制约了我国木薯产业的可持续发展[4]。由于该螨一般在种植后6~8个月成灾,但此时木薯地已封行,化学防治难度很大[5]。因此,寻求新的防治朱砂叶螨的方法已成为当前木薯产业中亟待解决的重要问题。
培育与利用抗虫品种是防治害虫最经济、最有效、最简便的一项带有方向性的防治途径,而研究害螨取食不同木薯种质后对其生理生化的影响能够为抗螨种质资源的鉴定、评价与创新以及害螨的高效防治技术研究提供重要的科学依据。研究表明,氧化应激产生的活性氧(reactive oxygen species,ROS)直接或间接地损伤细胞内蛋白质、脂质、核酸等大分子物质的生理功能,是众多疾病发生的病理生理基础[6-7]。而近年来的研究发现,核因子NF-E2相关因子(nuclear factor erythroid 2-related factor,Nrf2)是外源性有毒物质和氧化应激的感受器,在参与细胞抗氧化应激和外源性有毒物质诱导的主要防御机制中发挥重要的作用[8-9]。Nrf2及其下游的抗氧化蛋白在调节体内氧化水平,改善病理生理变化等方面具有重要作用[10]。
转录因子Nrf2调控抗氧化酶的功能已经在人类[11]、模式生物如大鼠[12]、小鼠[13]、斑马鱼[14]、果蝇[15]有较多研究,研究范畴主要集中在疾病治疗、炎症发生、衰老、细胞凋亡、神经损伤和生殖发育等方面[16]。然而,包括朱砂叶螨在内的农业害螨中,Nrf2基因在朱砂叶螨-寄主植物互作中是否也行使调控抗氧化酶的功能尚缺乏相关报道。因此,本研究将模式生物研究中已知的Nrf2基因抑制剂、激活剂处理朱砂叶螨,通过干预其转录因子TcNrf2的表達,研究其对下游调控的抗氧化酶基因TcSOD和TcCAT表达的影响,从分子水平直接证明TcNrf2基因在木薯抗螨中具有重要作用,为木薯抗螨分子机理研究奠定理论基础。
1 材料与方法
1.1 材料
1.1.1 供试木薯品种 对朱砂叶螨高抗木薯品种C1115和高感木薯品种BRA900由中国热带农业科学院热带作物品种资源研究所国家木薯品种资源圃提供。
1.1.2 供试朱砂叶螨 供试朱砂叶螨由中国热带农业科学院环境与植物保护研究所提供。
1.2 方法
1.2.1 抑制剂、激活剂处理对朱砂叶螨死亡率的影响 用10%丙酮-水溶液依次配制浓度分别为5、10、20、40、80 μmol/L的上述5种化合物处理药剂,以10%丙酮-水溶液为对照;依次将健康的、生长状态一致的BRA900、C1115新鲜木薯叶片完全浸润于上述溶液中10 s后用镊子捞出,待叶片表面液体完全干燥后,按大约30头/叶接种朱砂叶螨;朱砂叶螨为本实验室继代培养的生长状态和龄期一致的雌成螨,每隔1、4、8 d后记录每片叶上朱砂叶螨的累积死亡率。
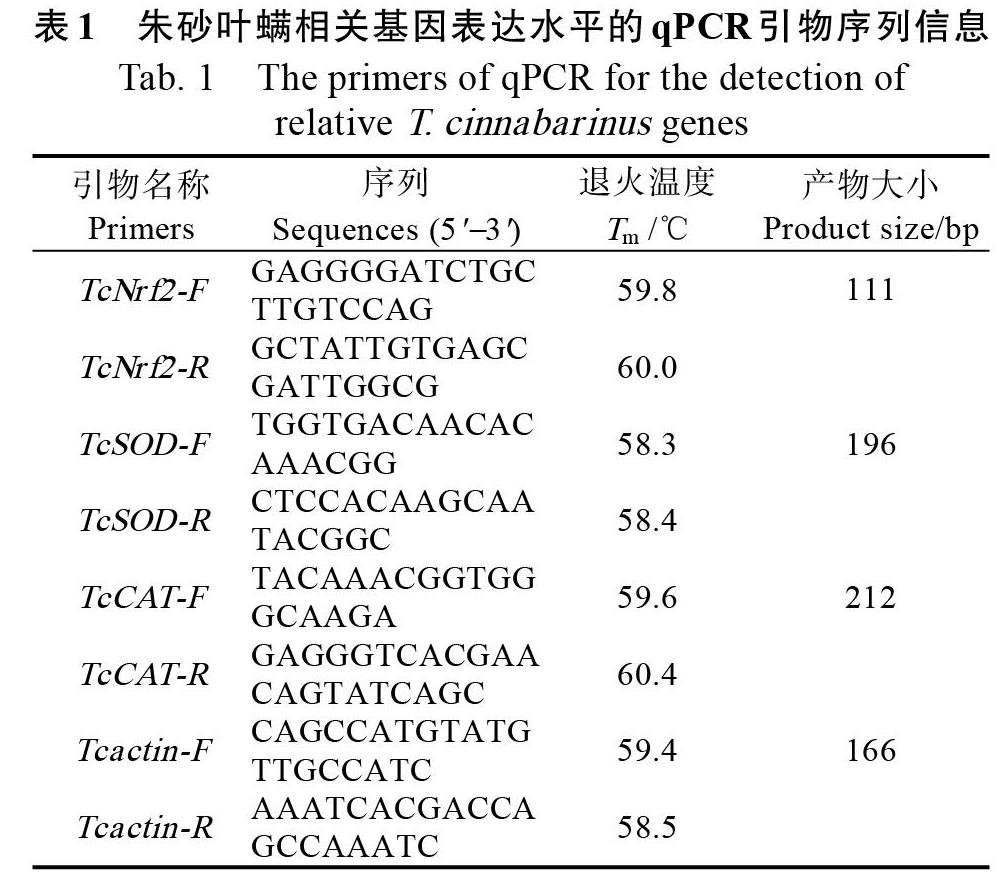
1.2.2 抑制剂、激活剂处理对朱砂叶螨Nrf2及保护酶TcSOD和TcCAT表达量的影响 将1.2.1中与对照相比死亡率差异最小的抑制剂、激活剂浓度分别处理抗、感木薯叶片,并用于朱砂叶螨的室内饲养,每叶50头螨,待其分别取食1、4、8 d后收集存活的试螨用于qPCR测定,同时设置未用抑制剂、激活剂处理的朱砂叶螨作为对照。每个处理设置3个重复。以朱砂叶螨的actin基因(XM_015930131.1)作为内参,朱砂叶螨TcNrf2(XM_015928362.2)基因、抗氧化酶基因TcSOD(XM_015936131.2)和TcCAT(XM_025161768.1)的相对表达量变化情况以处理前的倍数表示,根据Livak的2ΔΔCt方法计算而得[17]。相关基因qPCR引物信息如表1所示。
1.3 数据处理
采用SPSS 软件进行数据分析,显著性差异分析采用One-Way ANOVA-Fisher中的LSD方法和Mann-Whitney U test,所有数据均为3个生物学重复的平均值±标准误,显著性检测水平为P<0.05。
2 结果与分析
2.1 Nrf2抑制剂、激活剂处理对朱砂叶螨死亡率的影响
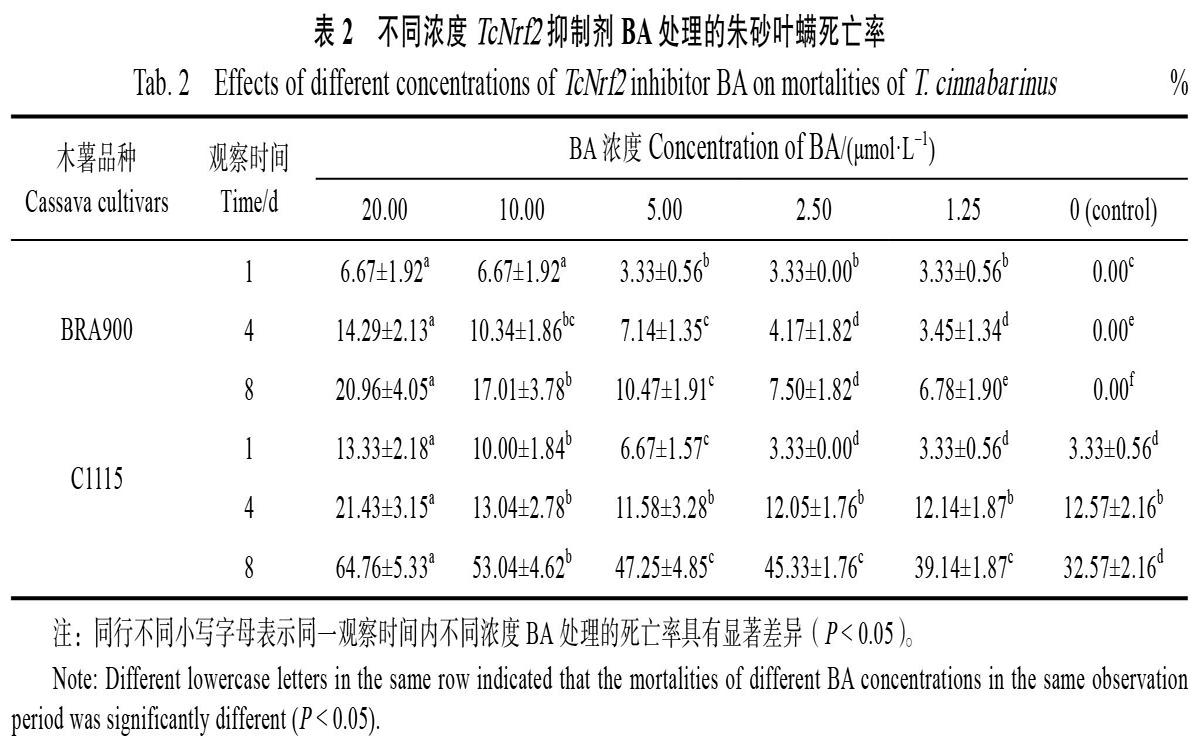
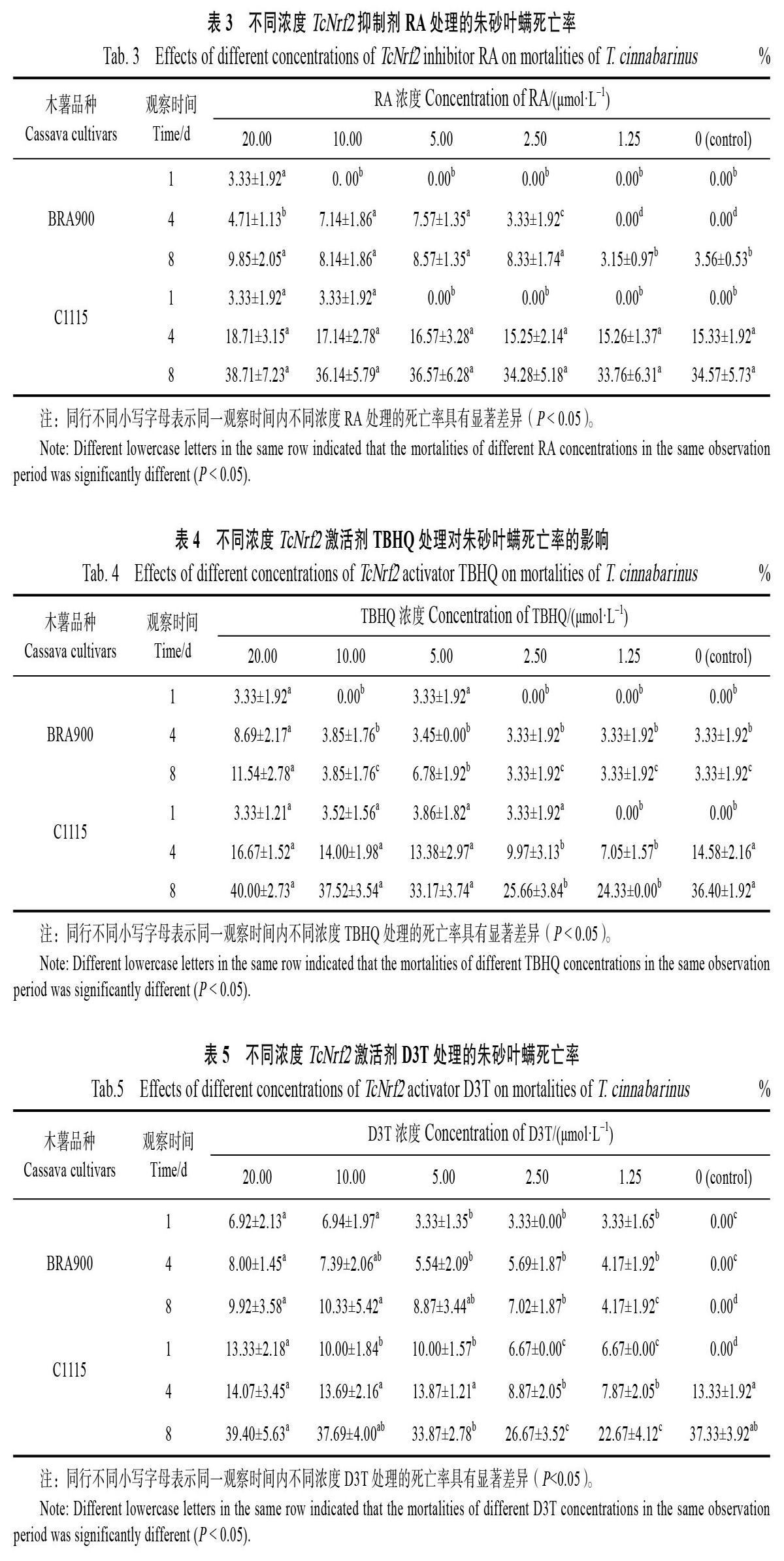
当用抑制剂BA处理后,朱砂叶螨取食感螨木薯BRA900和抗螨木薯C1115 1、4、8 d后的死亡率随处理浓度的升高而升高(表2)。用抑制剂RA处理后,朱砂叶螨取食BRA900的死亡率与对照相比有显著差异(P<0.05),但死亡率维持在低于10%的较低水平,而取食C1115后,除了20.00和10.00 μmol/L处理1 d的死亡率数据和对照有显著差异外,其余各处理浓度死亡率与对照相比无显著差异(表3)。用激活剂TBHQ(表4)和D3T(表5)分别处理时,在最高处理浓度条件下(20.00 μmol/L),朱砂叶螨取食BRA900的死亡率与对照相比虽然有显著差异,但死亡率也仅分别低于13.33%和11.54%,而取食C1115后,除了第4天和第8天的死亡率在1.25和2.5 μmol/L处理浓度下与对照相比显著降低外(P<0.05),其余浓度处理死亡率并无显著差异。最终综合考虑BRA900和C1115的结果,选择与对照相比死亡率差异最小的浓度作为后续qPCR测定的处理浓度,即BA和RA均为1.25 μmol/L, 抑制剂、激活剂处理对朱砂叶螨TcSOD和TcCAT基因表达量的影响
抑制剂BA处理后,朱砂叶螨取食抗、感木薯品种的TcSOD和TcCAT的基因表达量均显著降低(P<0.05),并且取食C1115后降低幅度更大,TcSOD表达量分别达到了对照的0.31倍(1 d)、0.30倍(4 d)和0.26(8 d)倍(图3B),TcCAT表达量分别达到了对照的0.42倍(1 d)、0.38倍(4 d)和0.36(8 d)倍(图4B)。抑制剂RA处理后,朱砂叶螨取食抗、感木薯品种的TcSOD和TcCAT的基因表达量并无显著变化(图3,图4)。而用激活剂TBHQ和D3T分别处理时,朱砂叶螨取食抗、感木薯品种的TcSOD和TcCAT基因表达量均显著提高(P<0.05),并且取食BRA900后提高幅度更大,TBHQ处理TcSOD 表达量提高3.65倍(1 d)、3.68倍(4 d)和3.71(8 d)倍(图3A),TcCAT表达量3.89倍(1 d)、3.92倍(4 d)和3.88(8 d)倍(图4A);D3T处理TcSOD表达量提高3.85倍(1 d)、3.86倍(4 d)和3.82(8 d)倍(图3A),TcCAT表达量提高3.72倍(1 d)、3.76倍(4 d)和3.74(8 d)倍(图4A)。
3 讨论
研究转录因子Nrf2对抗氧化酶的调控功能,能够为揭示和理解害虫(螨)-寄主植物互作规律及其寄主适应性的形成原因,阐明害虫(螨)为害的分子机理提供理论支持。一些研究表明,害虫取食抗虫植物会诱导自身抗氧化酶活性的显著增加。例如Rigsby等[18]发现花曲柳吉丁虫取食抗
A:BRA900;B:C1115;朱砂叶螨取食不同化合物处理过的木薯叶片1、4和8 d后TcNrf2基因表达量以取食未处理对照叶片的相对倍数表示,每个数据均为3次重复的结果,误差线上不同字母表示TcNrf2表达量变化倍数差异显著(P<0.05)。
A:BRA900;B:C1115;朱砂叶螨取食不同化合物处理过的木薯叶片1、4和8 d后TcSOD2基因表达量以取食未处理对照叶片的相对倍数表示,每个数据均为3次重復的结果,误差线上不同字母表示TcNrf2表达量变化倍数差异显著(P<0.05)。
A: BRA900; B: C1115; the changes in TcSOD transcript levels were presented as the fold of the levels in T. cinnabarinus while fed on different chemical-treated cassava leaves for 1, 4 and 8 d relative to those feeding on untreated leaves (controls). Each data is average of three replications, and different letters above the columns indicated significant transcript levels (P<0.05).
A:BRA900;B:C1115;朱砂叶螨取食不同化合物处理过的木薯叶片1、4和8 d后TcCAT基因表达量以取食未处理对照叶片的相对倍数表示,每个数据均为3次重复的结果,误差线上不同字母表示TcNrf2表达量变化倍数差异显著(P<0.05)。
吉丁虫水曲柳后,体内SOD和CAT的活性相比取食感性水曲柳显著提高。胡黎华等[19]研究了橘小实蝇三龄幼虫取食脐橙、桃、香蕉、番茄、黄瓜和西葫芦6种寄主后保护酶SOD和CAT的活性变化,发现SOD和CAT活性在脐橙、桃和香蕉上显著高于番茄、黄瓜和西葫芦,作者认为这些现象是脐橙、桃和香蕉成为橘小实蝇嗜好寄主的主要原因。相反,另外有研究表明抗虫作物能够显著抑制害虫抗氧化酶活性。例如Lu等[20]研究发现朱砂叶螨取食抗螨木薯品种后,抗氧化酶SOD和CAT的基因表达和酶活性与取食感螨木薯品种相比显著降低,同时还导致了其发育与生殖被显著抑制;Lu等[21]在另一项研究中也发现六点始叶螨取食抗螨橡胶树品种(橡胶与木薯同为大戟科作物)后,体内抗氧化酶SOD、CAT和POD(过氧化物酶)活性与取食感螨橡胶树品种相比显著降低。上述研究表明害虫(螨)与寄主植物互作过程中体内抗氧化酶基因表达水平和活性变化情况与取食的植物种类有关,并对害虫(螨)的寄主适应性产生影响。本研究中朱砂叶螨取食抗螨品种后体内TcNrf2基因的表达被显著抑制,而取食感螨品种时则不受影响,这可能与抗螨木薯抑制了朱砂叶螨保护机制的启动,从而对其生理生化也产生了显著抑制相关,这些结果需要通过干预TcNrf2的表达考察其对保护酶基因的调控作用进一步证实。
本研究结果表明朱砂叶螨转录因子TcNrf2基因与保护酶基因的表达量变化趋势相一致,从分子水平初步证实了TcNrf2对保护酶基因的调控功能。抑制剂BA显著抑制了TcNrf2基因的表达,从而也导致朱砂叶螨取食抗、感螨木薯品种后TcSOD和TcCAT的表达量显著降低,由于抗螨木薯C1115本身就对朱砂叶螨具有显著的抑制作用,因此这2个基因被抑制的程度也大于取食感螨木薯。反之,抑制剂RA对TcNrf2未表现出抑制效果,因此TcSOD和TcCAT的表达量与对照相比也无显著差异,而激活剂TBHQ和D3T均能显著提高TcNrf2的表达,直接促进了2个保护酶基因表达量的显著提高。本研究结果与小鼠[13]、果蝇[15]中抑制剂、激活剂处理后转录因子Nrf2及抗氧化酶基因SOD和CAT的表达量同步提高的结果相一致。
Nrf2作为应对外界应激和胁迫的中央转录因子,除了能够调控抗氧化酶,同时也能调控解毒酶例如细胞色素P450酶、谷胱甘肽转移酶以及其他一些保护蛋白表达的酶[22],是潜在的害虫防控新靶点。通过对转录因子Nrf2进行干预,破坏其对保护性酶和蛋白的调控功能,能够最大限度削弱害虫对氧化损伤的修复能力以及对有毒物质的解毒能力。在果蝇Nrf2的研究中,已有学者提出该基因可能在害虫抗药性治理中具有较大应用前景[23],但目前该理论尚缺乏实践基础。本研究仅从转录水平证实抑制和激活转录因子TcNrf2的表达对下游保护酶基因表达的影响,下一步研究应从蛋白水平证实TcNrf2对保护酶活性的调控功能,以及对朱砂叶螨生殖发育的影响,以期为将来把TcNrf2作为害虫(螨)防治靶标和可能的新基因资源应用于作物抗虫(螨)分子设计育种提供理论依据。
参考文献
古 碧, 李开绵, 张振文, 等. 我国木薯加工产业发展现状及发展趋势[J]. 农业工程技术(农产品加工业), 2013, 11: 25-31.
李开绵, 陈 青, 黄 洁, 等. 中国现代农业产业可持续发展战略研究: 木薯分册[M]. 北京: 中国农业出版社, 2016.
程立生. 中国朱砂叶螨各地理种群形态变异研究[J]. 热带作物学报, 1998, 1(1): 83-86.
陈 青, 卢芙萍, 黄贵修, 等. 木薯害虫普查及其安全性评估[J]. 热带作物学报, 2010, 31(5): 819-827.
李 迁, 卢芙萍, 陈 青, 等. 木薯品种对朱砂叶螨的抗性评价[J]. 热带作物学报, 2015, 36(1): 143-151.
Ray P, Huang B W, Tsuji Y. Reactive oxygen species (ROS) homeostasis and redox regulation in cellular signaling[J]. Cell Signal, 2012, 24(5): 981-990.
Gechev T S, Van B F, Stone J M, et al. Reactive oxygen species as signals that modulate plant stress responses and programmed cell death[J]. Bioessays, 2006, 28(11): 1091-1101.
覃玉娥, 刘朝奇. Nrf2及其相关抗氧化基因的miRNA调控研究进展[J]. 生物技术通报, 2013, 8(9): 34-37.
Denicola G M, Karreth F A, Humpton T J, et al. Oncogene-induced Nrf2 transcription promotes ROS detoxification and tumorigenesis[J]. Nature, 2011, 475(7354): 106- 109.
Motohashi H, Yamamoto M. Nrf2-Keap1 defines a physiologically important stress response mechanism[J]. Trends in Molecular Medicine, 2004, 10(11): 549-557.
Pendyala S, Moitra J, Kalari S, et al. Nrf2 regulates hyperoxia-induced Nox4 expression in human lung endothelium: Identification of functional antioxidant response elements on the Nox4 promoter[J]. Free Radical Biology and Medicine, 2011, 50(12): 1749-1759.
Buelnachontal M, Guevarachávez J G, Silvapalacios A, et al. Nrf2-regulated antioxidant response is activated by protein kinase C in postconditioned rat hearts [J]. Free Radical Biology & Medicine, 2014, 74(5): 145-156.
Li Y, Cao Y, Wang F, et al. Scrotal heat induced the Nrf2-driven antioxidant response during oxidative stress and apoptosis in the mouse testis[J]. Acta histochemica, 2014, 116(5): 883-890.
Wang L, Gallagher E P. Role of Nrf2 antioxidant defense in mitigating cadmium-induced oxidative stress in the olfactory system of zebrafish[J]. Toxicology and Applied Pharmacology, 2013, 266(2): 177-186.
Sykiotis G P, Bohmann D. Keap1/Nrf2 Signaling Regulates Oxidative Stress Tolerance and Lifespan in Drosophila[J]. Developmental Cell, 2008, 14(1): 80-85.
李雪麗, 唐 云, 许雪珠. 核转录因子Nrf2最新研究进展[J]. 中国组织工程研究, 2012, 16(24): 4530-4534.
Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-ΔΔCt)[J]. Methods, 2001, 25(5): 402-408.
Rigsby C M, Showalter D N, Herms D A, et al. Physiological responses of emerald ash borer larvae to feeding on different ash species reveal putative resistance mechanisms and insect counter-adaptations[J]. Journal of insect physiology, 2015, 78(11): 56-64.
王亚茹, 梁 晓, 伍春玲, 等. 木瓜秀粉蚧取食不同木薯品种后体内保护酶活性差异分析[J].生物技术通报, 2018, 34(6): 115-119.
胡黎华. 寄主转换对橘小实蝇种群动态和抗氧化酶系的影响[D]. 重庆: 西南大学, 2011.
Lu F, Liang X, Lu H, et al. Overproduction of superoxide dismutase and catalase confers cassava resistance to Tetranychus cinnabarinus[J]. Scientific Reports, 2017, 7: 40179.
Lu F, Chen Z, Lu H, et al. Effects of resistant and susceptible rubber germplasms on development, reproduction and protective enzyme activities of Eotetranychus sexmaculatus (Acari: Tetranychidae) [J]. Experimental and Applied Acarology, 2016, 9(4): 427-443.
Andrew P, Dirk B. Mechanisms and functions of Nrf2 signaling in Drosophila[J]. Free Radical Biology & Medicine, 2015, 88(Pt B): 302-313.
Misra J R, Horner M A, Lam G, et al. Transcriptional regulation of xenobiotic detoxification in Drosophila[J]. Genes & Development, 2011, 25(17): 1796-1806.

