miR-138调节SIRT1p-STAT3通路抑制高糖诱导肾小球系膜细胞炎性反应及纤维化
丁国明 郑寿浩 戢 晴 阮 园
糖尿病肾病是糖尿病的重要并发症,属于糖尿病慢性并发症中的微血管病,其机制与细胞外基质沉积过多、肾小球系膜细胞肥大、基膜增厚、肾小球与肾间质发生纤维化改变有关。微小RNA(microRNA,miRNA)是长约22nt的非编码RNA,能够与mRNA结合阻断蛋白编码基因的表达,进而实现对转录水平的调控[1~3]。miR-138能促进过氧化物酶受体的表达,促进体内脂肪细胞分化[4]。同时miR-138可促进转化生长因子 β(TGF-β)受体和及Ⅳ型胶原的表达,加重肾脏纤维化程度,激活单核细胞、补体系统,增加细胞因子释放,介导内皮功能紊乱,暴露胶原组织,加速血小板附着和聚集,加剧肾脏损伤程度[5,6]。
SIRT1是Ⅲ类去乙酰化酶组蛋白的成员,通过去乙酰化和微调蛋白质因子(包括内皮型一氧化氮合成酶)的活性,参与衰老、代谢和对氧化应激的耐受性[7]。SIRT1通过抑制血管生成和减少动脉内壁脂质沉淀,成为血肾小球血管内皮稳态的关键调节因子[8]。P-STAT3是SIRT1 mRNA靶向非翻译区(UTR)的结合分子,具有促进炎性、纤维化因子结缔组织生长因子(connective tissue growth factor,CTGF)、内皮素-1(endothelin-1,ET-1)、纤连蛋白(fibronectin,FN)、转化生长因子(transforming growth factor-β1,TGF-β1)、血管内皮生长因子(vascular endothelial growth factor,VEGF)高表达的作用[9,10]。目前关于糖尿病肾病与miR-138、SIRT1p-STAT3调节机制的研究较少。本研究拟探讨miR-138调节SIRT1p-STAT3通路抑制高糖诱导肾小球系膜细胞炎性反应及纤维化,为糖尿病肾病的发病机制提供理论依据。
资料与方法
1.细胞来源、仪器与试剂:大鼠肾小球系膜细胞株(中国科学院典型培养物保藏中心昆明细胞库)、DnJ-4249CO2培养箱(美国Revco公司)、RPMI1640 培养基(美国Thermo Fisher Scientific公司)、胰酶(德国Merck公司)、四甲基偶氮唑蓝(北京广源恒信科技发展有限公司)、99.99%葡萄糖(美国Thermo公司)、Lipofectamine2000 脂质体(美国Invitrogen公司)、miRNA-138-mimics、序列:5′-CCAGUCAGUUCCUGAUGCAGUA-3′、NG+miRNA-138(沉默)-mimics序列:5′-GAUGUCAGUUCCAUCGUUGCUCAG-3′(上海伯豪生物技术有限公司)、吖啶橙(中国碧云天生物技术公司产品)、胎牛血清(美国康宁公司)、Trizol试剂(美国Invitrogen Thermo Fisher Scientifc公司),反转录试剂盒及实时荧光定量PCR试剂盒(英国Cambridge公司)、FCRL5基因的表达测定采用UltraSYBR One Step RNA PCR Kit(宝生物工程大连有限公司)、实时荧光定量PCR仪(美国热电公司)、NanoDrop2000c 型蛋白核酸检测仪(美国Thermo公司)、SIRT1、P-STAT3、CTGF、ET-1、FN蛋白 Elisa 试剂盒(德国Merck公司)、DMI3000 B倒置显微镜(德国Leica公司)、MK3酶标仪(美国 Thermo公司)、恒温培养箱grp-9080(美国通用公司)二氧化碳培养箱(赛默飞世尔科技中国有限公司)、超净工作台(上海恒跃医疗器械有限公司)。
2.细胞复苏培养、分组设计及转染情况检测
(1)细胞复苏培养:将装有大鼠肾小球系膜细胞株的冻存管从液氮中取出,37℃水浴箱迅速解冻,吸取菌液至5ml EPP无菌管中,1500r/min,离心5min,上清液吸弃,加入pH值为7.2含10%胎牛血清、链霉素100μg/ml、青霉素100μg/ml、的RPMI 1640培养基,37℃、5%CO2培养箱中进行培养,3天换液,当细胞融合率达到80%时,用0.5%胰蛋白酶消化传代。
(2)分组设计:正常浓度葡萄糖组(4.0mmol/L,normal glucose,NG)、 高浓度葡萄糖组(40.0mmol/L,high glucose,HG):取5ml大鼠肾小球系膜细胞液(细胞浓度为5×106/ml)于10%胎牛血清的RPMI 1640培养液中,分别加入5ml 8.0mmol/L、80.0mmol/L的无菌葡萄糖溶液,置于CO2培养箱(37℃、5%CO2、20%O2)。NG+miRNA-138沉默组、NG+miRNA-138转染组:取5ml大鼠肾小球系膜细胞液(细胞浓度为5×106/ml)于10%胎牛血清的RPMI 1640培养液中,分别加入5ml转染miRNA-138-mimics、NG+miRNA-138(沉默)-mimics以及10ml 8.0mmol/L的无菌葡萄糖溶液,转染按照美国Invitrogen公司 Lipofectamine2000 脂质体转染试剂说明书进行。HG+miRNA-138沉默组、HG+miRNA-138转染组:取5ml大鼠肾小球系膜细胞液(细胞浓度为5×106/ml)于10%胎牛血清的RPMI 1640培养液中,分别加入5ml转染miRNA-138-mimics、NG+miRNA-138(沉默)-mimics以及10ml 80.0mmol/L的无菌葡萄糖溶液,转染按照美国Invitrogen公司 Lipofectamine2000 脂质体转染试剂说明书进行。
(3)转染情况检测:即用型免疫组化法进行转染情况检测,miRNA-138-mimics转染细胞核内有明显的棕黄色颗粒, 而miRNA-138沉默细胞核被苏木素复染成蓝色。以上各组每孔设6个平行样,培养72h。
3.各组大鼠肾小球系膜细胞株miRNA138 RNA水平的检测:取5ml细胞液(细胞浓度为5×106/ml),5000r/min离心5min,miRNeasy Mini试剂盒(美国Qiagen公司)提取总RNA,NanoDrop1000(美国NanoDrop公司)定量RNA纯度。TaqMan MicroRNA Reverse Transcription试剂盒(美国Applied Biosystems公司)进行RT反应。为合成cDNA,将反应混合物依次在16℃下孵育30min,在42℃下孵育30min,在85℃下孵育5min。参照GenBank 数据获取 2 个基因多态性位点的序列,设计待测基因位点的PCR扩增引物和单碱基延伸引物(参照http://links.lww.com/MD/A675),按20μl模板和10μl 反应液构成 PCR反应体系, 扩增程序: 95℃ 5min; 93℃10s,61℃ 30s,重复 40个循环,61℃时采集荧光(表1、表2)。实时荧光定量 PCR仪检测其表达量。

表1 miRNA-138、β-actin RNA引物序列

表2 RT-PCR反应体系
4.各组大鼠肾小球系膜细胞株SIRT1、P-STAT3、CTGF、ET-1、FN、TGF-β1、VEGF蛋白水平测定:染毒结束后,5000r/min离心收集各组细胞,加入PBS制成细胞悬液后,酶联免疫吸附法测定培养液中SIRT1、P-STAT3、CTGF、ET-1、FN、TGF-β1、VEGF蛋白水平。
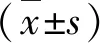
结 果
1.各组细胞miRNA-138 RNA、SIRT1、P-STAT3水平比较:由表3可见,HG组miRNA-138 RNA、P-STAT3水平高于NG组,SIRT1水平低于NG组(P<0.05);NG+miRNA-138沉默组miRNA-138 RNA、P-STAT3水平低于NG组,SIRT1水平高于NG组(P<0.05);NG+miRNA-138转染组miRNA-138 RNA、P-STAT3水平高于NG组,SIRT1水平低于NG组(P<0.05);NG+miRNA-138转染组miRNA-138 RNA、P-STAT3水平高于NG+miRNA-138沉默组,SIRT1水平低于NG+miRNA-138沉默组(P<0.05);HG+miRNA-138沉默组miRNA-138 RNA、P-STAT3水平低于HG组,SIRT1水平高于HG组(P<0.05); HG+miRNA-138转染组miRNA-138 RNA、P-STAT3水平高于HG组,SIRT1水平低于HG组(P<0.05);HG+miRNA-138转染组miRNA-138 RNA、P-STAT3水平高于HG+miRNA-138沉默组(P<0.05)。

表3 各组细胞miRNA-138 RNA、SIRT1、P-STAT3水平比较
与NG组比较,*P<0.05;与NG+miRNA-138沉默组比较,#P<0.05;与HG组比较,ΔP<0.05;与HG+miRNA-138沉默组比较,▲P<0.05
2.各组细胞炎性因子TGF-β1、VEGF水平比较:由表4可见,HG组TGF-β1、VEGF水平高于NG组;NG+miRNA-138沉默组TGF-β1、VEGF水平低于NG组(P<0.05);NG+miRNA-138转染组TGF-β1、VEGF水平高于NG组(P<0.05);NG+miRNA-138转染组TGF-β1、VEGF水平高于NG+miRNA-138沉默组(P<0.05);HG+miRNA-138沉默组TGF-β1、VEGF水平低于HG组(P<0.05); HG+miRNA-138转染组TGF-β1、VEGF水平高于HG组(P<0.05);HG+miRNA-138转染组TGF-β1、VEGF水平高于HG+miRNA-138沉默组(P<0.05)。

表4 各组细胞炎性因子TGF-β1、VEGF水平比较
与NG组比较,*P<0.05;与NG+miRNA-138沉默组比较,#P<0.05;与HG组比较,ΔP<0.05;与HG+miRNA-138沉默组比较,▲P<0.05
3.各组细胞纤维化因子CTGF、ET-1、FN水平比较:由表5可见,HG组CTGF、ET-1、FN水平高于NG组;NG+miRNA-138沉默组CTGF、ET-1、FN水平低于NG组(P<0.05);NG+miRNA-138转染组CTGF、ET-1、FN水平高于NG组(P<0.05);NG+miRNA-138转染组CTGF、ET-1、FN水平高于NG+miRNA-138沉默组(P<0.05);HG+miRNA-138沉默组CTGF、ET-1、FN水平低于HG组(P<0.05); HG+miRNA-138转染组CTGF、ET-1、FN水平高于HG组(P<0.05);HG+miRNA-138转染组CTGF、ET-1、FN水平高于HG+miRNA-138沉默组(P<0.05)。

表5 各组细胞纤维化因子CTGF、ET-1、FN水平比较
与NG组比较,*P<0.05;与NG+miRNA-138沉默组比较,#P<0.05;与HG组比较,ΔP<0.05;与HG+miRNA-138沉默组比较,▲P<0.05
4.SIRT1p-P-STAT3通路各指标相关性分析:由表6可见,miRNA-138与SIRT1呈负相关(P<0.01),SIRT1与P-STAT3呈负相关(P<0.05),P-STAT3与CTGF、ET-1、FN、TGF-β1、VEGF呈正相关(P<0.05)。

表6 SIRT1p-P-STAT3通路各指标相关性分析
讨 论
大量证据表明microRNAs的失调与细胞炎症、纤维化反应有关[11]。miR-138通过细胞凋亡途径PI3K/AKT抑制肌纤维细胞炎症。miR-143充当平滑肌细胞和HUVEC之间的通信分子,抑制HUVEC纤维化反应[12]。miR-155通过抑制细胞特异性靶基因在内皮炎症、纤维化反应过程中发挥调节生成作用。
研究表明,miR-138是肾小球系膜细胞的损害因子。最近的一项研究表明,高糖水平诱导的miR-138过表达是肾小球系膜细胞保护因子SIRT1的负调节因子,其通过内皮型一氧化氮合酶(eNOS)减少一氧化氮的产生[13,14]。本研究结果显示,HG、NG+miRNA-138转染组TGF-β1、VEGF、CTGF、ET-1、FN水平高于NG组;NG+miRNA-138沉默组TGF-β1、VEGF、CTGF、ET-1、FN水平低于NG组; NG+miRNA-138、HG+miRNA-138转染组TGF-β1、VEGF、CTGF、ET-1、FN水平高于NG+miRNA-138沉默组;HG+miRNA-138沉默组TGF-β1、VEGF、CTGF、ET-1、FN水平低于HG组; HG+miRNA-138转染组TGF-β1、VEGF、CTGF、ET-1、FN水平高于HG组;说明高糖诱导的肾小球系膜细胞miR-138的表达增加,能明显增强炎症、纤维化反应,进一步就miR-138致炎症、纤维化机制进行研究。结果显示,miR-138负向调控SIRT1,SIRT1是肾小球系膜细胞保护因子,其能抑制肾小球系膜细胞损害过程中伴随的炎症、纤维化反应。
国外研究表明,SIRT1能下调促炎细胞因子单核细胞趋化蛋白1(MCP-1)、肿瘤坏死因子α(TNF-α)、白细胞介素6(IL-6)和IL-1b、ET-1、FN[15]。通过抑制SIRT1的表达,雷帕霉素靶蛋白(mTOR)已显示出促进肾小球系膜细胞炎症、纤维化反应的能力[16]。结合本研究结果中,SIRT1与TGF-β1、VEGF、CTGF、ET-1、FN呈负相关,笔者推测高糖水平破环SIRT1的正常表达而促进TGF-β1、VEGF、CTGF、ET-1、FN过表达,进而加剧肾小球系膜细胞炎症、纤维化反应。P-STAT3是炎症、纤维化反应的响应细胞因子和生长因子,STAT3被受体磷酸化,形成同源二聚体或异源二聚体,转移至细胞核,发挥调控作用,在胶质母细胞瘤的体外增殖实验中,SIRT1磷酸化p-STAT3促进VEGF、IL-6、FN的分泌[17,18]。此外,SIRT1也抑制了HepG2细胞中p-STAT3的表达。在本研究中,SIRT1与P-STAT3呈负相关,SIRT1对p-STAT3蛋白的表达具有抑制作用 ,与上述结果一致,提示SIRT1可能通过抑制p-STAT3蛋白表达而起到高糖促进肾小球系膜细胞炎性反应及纤维化。
本研究结果表明,miR-138在介导高糖诱导肾小球系膜细胞炎性反应及纤维化过程中起重要作用。 研究发现miR-138通过调控细胞炎性因子TGF-β1、VEGF水平以及纤维化因子CTGF、ET-1、FN水平参与高糖诱导肾小球系膜细胞损害。作为miR-138的直接靶分子,SIRT1过表达能起到保护减轻氧化应激反应,抑制肾脏纤维化的作用,由SIRT1介导的pSTAT3蛋白表达的调节也是高糖诱导肾小球系膜细胞损害的原因。 因此,本研究初步表明高糖能诱导miR-138水平过表达,抑制SIRT1表达,进而p-STAT3、TGF-β1、VEGF、CTGF、ET-1、FN高水平表达,导致肾小球系膜细胞炎性反应及纤维化。
综上所述,miR-138促进高糖诱导的肾小球系膜细胞炎性反应及纤维化,其机制与抑制SIRT1引起的P-STAT3的磷酸化、导致TGF-β1、VEGF、CTGF、ET-1、FN高表达有关。

