重组人白介素35质粒的构建及鉴定
顾香 陈吉泉 李兵

【摘要】 目的:通过分子生物学技术构建重组人白介素35(IL-35)质粒,为进一步研究人IL-35的生物学功能奠定基础。方法:用KG-1细胞(人白血病细胞)扩增p35和EBI3的cDNA,将两者先后连接至pSectag2A质粒中,最后把Linker连接至pSectag2A-p35-EBI3中,构建成pSectag2A-IL-35质粒。结果:经测序等方法鉴定重组质粒中p35和EBI3序列与Genbank中(p35 NM-000882和EBI3 NM-005725)公布的序列一致。结论:成功构建pSectag2A-IL-35真核表达载体。
【关键词】 重组; PCR; IL-35; 质粒
doi:10.14033/j.cnki.cfmr.2019.17.078 文献标识码 B 文章编号 1674-6805(2019)17-0-03
【Abstract】 Objective:To construct recombinant human IL-35 expression vector by molecular biology technique,which could lay a foundation for further study of the biological function of IL-35.Method:EBI3 and p35 were amplified by PCR from the cDNA library derived from the KG-1 cells.And they were cloned into pSectag2A vector.Finally Linker was cloned into pSectag2A-EBI3-p35,and pSectag2A-IL-35 plasmid was successfully reconstructed.Result:The pSectag2A-IL-35 vector was verified by DNA sequencing,whose sequencing were consistent with those published in Genbank(EBI3 nm-005725,p35 nm-000882).Conclusion:Psectag2a-IL-35 eukaryotic expression vector is successfully constructed.
【Key words】 Recombinant; PCR; IL-35; Plasmid
First-authors address:Shanghai Changzheng Hospital,Second Military Medical University,Shanghai 200003,China
IL-35是白介素12家族的一員,1997年Devergne等[1]报道了IL-35是由白介素12的p35亚基(IL-12 p35,即p35)和EB病毒诱导基因3(EBI3)构成。p35及EBI3基因编码分子量分别为35、34 kD的糖蛋白[2]。2007年Collison等[3]经小鼠体内实验初步证实,调节性T细胞(Treg细胞)可高表达EBI3和p35,且两者的二聚体能加强Tregs的免疫抑制功效。2007第13届免疫学国际会议上,由Vignali首次提议该二聚体命名为IL-35,最后成功获批。自此,IL-35就成为免疫学、分子生物学等领域研究的热点。本实验拟构建人IL-35质粒,为深入研究IL-35的生物学作用及其机制奠定基础。
1 材料与方法
1.1 材料
1.1.1 细胞株和质粒 人白血病细胞株KG-1由华东理工大学代同成博士惠赠,pSectag2A载体由英国格拉斯哥大学Wei Xiaoqing教授惠赠。
1.1.2 主要试剂 限制性内切酶HindⅢ、EcoRⅠ、NotⅠ、XhoⅠ,DL2000 Marker、T4DNA连接酶、质粒抽提试剂盒(北京全式金生物技术有限公司)、T载体(TAKARA)、DNA胶回收试剂盒、RNA提取试剂。
1.1.3 培养基 DMEM高糖培养基购自GIBICO公司,Hyclone胎牛血清。
1.2 方法
1.2.1 p35和EBI3 cDNA的克隆 按照p35和EBI3在NCBI的GenBank中的cDNA序列,利用Primer Premier 5软件设计引物。依照pSectag2A质粒图谱,筛选酶切位点。在EBI3上游引物的5端加上4个保护碱基并引入HindⅢ酶切位点:AAAGAAGCTTTGCCCGCCCTGCAGTGGA,EBI3下游引物的5端加上5个保护碱基并引入EcoRⅠ及NotⅠ酶切位点:ATTAAGAATTCGCGGCCGCGCCCAGGCTCATTGTGG;在p35上游引物的5端加上10个保护碱基并引入NotⅠ酶切位点:ATATTAGAATGCGGCCGCAACCTCCCCGTGGCCAC,p35下游引物的5端加上4个保护碱基并引入XhoⅠ酶切位点:GGCCCTCGAGGGAAGCATTCAGATAGCTCAT;Linker引物均引入NotⅠ酶切位点,HLS:GGCCGCGGTGGTGGTGGTTCTGGTGGTGGTGGTTCTGGTGGTGGTGGTTCTGC,HLA:GGCCGCAGAACCACCACCACCAGAACCACCACCACCAGAACCACCACCACCGC。引物由上海生工生物工程公司合成。
1.2.2 KG-1细胞RNA的提取及PCR扩增目的片段 用PBS冲洗细胞2遍,按每106个细胞加入1 ml的Trizol,将细胞轻轻冲洗下来,收集至1.5 ml离心管中,随后加入200 μl氯仿,经过剧烈震荡,4 ℃,13 000 r/min离心15 min,可分3层,上层为RNA水相,将其吸出并加入500 μl异丙醇,冰上静置10 min,4 ℃,12 000 r/min离心15 min,弃上清,加入1 ml预冷的用DEPC水配制的75%乙醇,混匀后4 ℃,12 000 r/min离心5 min,弃上清,加入30 μl的焦碳酸二乙酯水溶解。
把上述RNA逆转录合成cDNA文库,逆转录-聚合酶链反应的反应体系:5×PrimeScript RT Master Mix 2 μl,Total RNA 7 μl,RNase Free 1 μl;反应参数:37 ℃ 30 min;85 ℃ 5 s,4 ℃ 10 min。
以上述引物为引物,将逆转录获得的cDNA为模板,扩增目的基因。PCR反应参数:94 ℃ 3 min;94 ℃ 30 s,55℃ 30 s,72 ℃ 45 s,30个循环;72 ℃ 5 min。扩增产物EBI3、p35去掉信号肽序列、起始及终止密码子,大小为642 bp及591 bp。
1.2.3 IL-35-pSectag2A重组真核表达载体的构建 PCR产物经1%琼脂糖凝胶电泳,凝胶成像系统观察并照相回收目的片段。将胶回收的产物EBI3及p35连接到T载体上,转化DH5α感受态细胞,挑取单克隆于3 ml LB培养基中,37 ℃,120 r/min培养过夜。提取质粒,对EBI3利用HindⅢ、EcoRⅠ进行双酶切,用T4连接酶将酶切的目的片段和同样酶切的pSectag2A载体片段分别进行黏性末端的连接,转化培养,提取质粒,经PCR鉴定后测序。
测序正确后,将p35经NotⅠ、XhoⅠ双酶切,用T4连接酶将酶切的目的片段和同样酶切的pSectag2A-EBI3载体片段进行连接,转化培养,抽提质粒,经PCR鉴定后测序。
若测序正确,以退火反应获得Linker。退火体系:LinkerS:5 μl,LinkerA:5 μl,Buffer:10 μl,ddH2O:80 μl。退火参数:90 ℃ 5 min,37 ℃ 1 h。在退火产物中加入100 μl ddH2O,并加入600 μl无水乙醇,混匀后放入-20 ℃冰箱过夜,12 000 r/min,离心5 min,弃上清,待酒精挥发完后加入20 μl ddH2O,混匀后与经NotⅠ单酶切的pSectag2A-EBI3-p35载体连接,转化培养,抽提质粒,经PCR鉴定后测序。
2 结果
2.1 p35和EBI3基因的克隆
通过逆转录-聚合酶链反应扩增获得p35、EBI3基因片段,RT-PCR产物在1%琼脂糖凝胶电泳后可见大小约为591 bp及642 bp的条带,所获条带与预期大小相符(图1),可将其连接至pUCm-T载体。
2.2 pUCm-T-EBI3、pUCm-T-p35的酶切产物
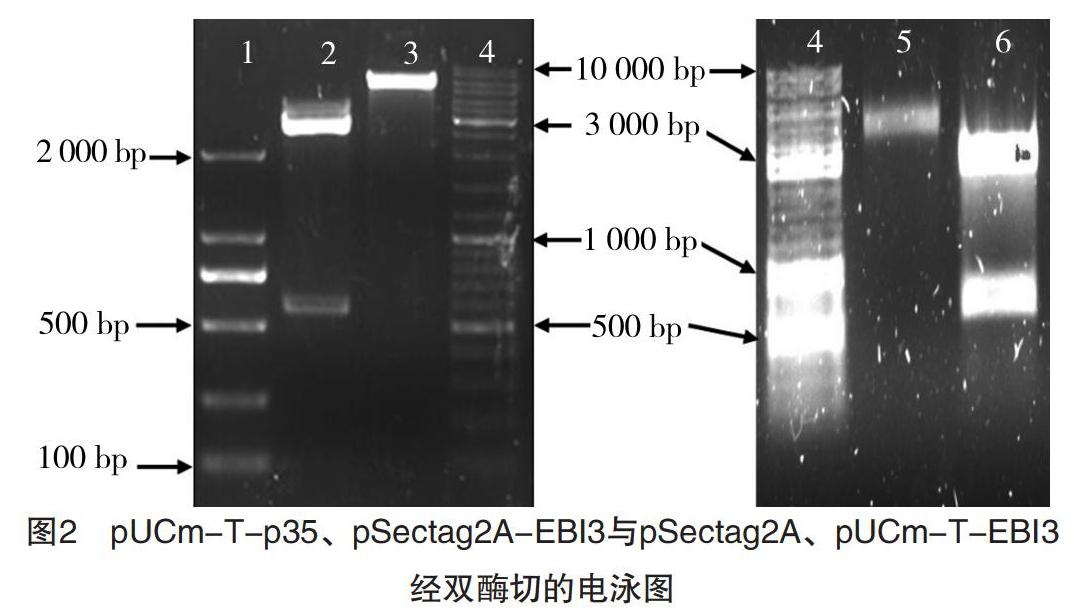
RT-PCR产物EBI3与pUCm-T连接,同时与pSectag2A经HindⅢ、EcoRⅠ双酶切;p35与pUCm-T连接,并与pSectag2A-BBI3经NotⅠ、XhoⅠ双酶切。上述酶切产物经1%琼脂糖凝胶电泳,结果见图2。图2中1泳道为DL 2000 DNA Marker,2泳道显示大小两条带,其中小片段大小与预期大小相符(591 bp);3泳道所显示条带的大小与预期大小相符(5 707 bp);4泳道为10 000 bp DNA Marker,5泳道显示一条带,其大小与理论值(6 349 bp)一致,6泳道显示大小两条带,其中小片段大小与预期大小相符(642 bp),最后将目的片段p35和EBI3切胶回收,分别与pSectag2A及pSectag2A-EBI3连接。
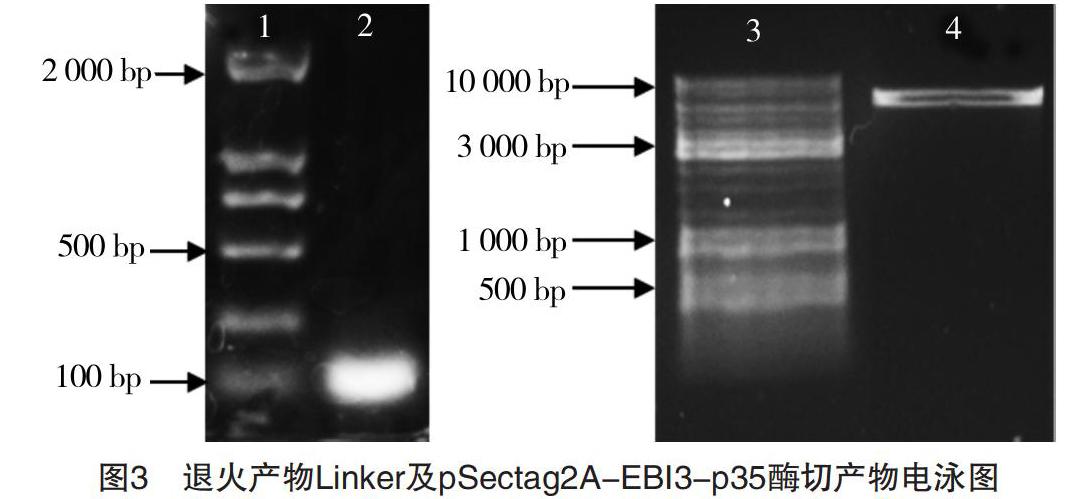
退火获得Linker产物,经1%琼脂糖凝胶电泳,结果见图3。图3中2泳道显示一条带,大小与理论值(51 bp)相符,未见其他非特异性条带。
EBI3及p35片段先后连接至pSectag2A构成重组质粒pSectag2A-EBI3-p35,经过NotⅠ单酶切的产物,随后经1%琼脂糖凝胶电泳,结果如图3所示。图3中4泳道显示的条带为线性化的pSectag2A-EBI3-p35载体,大小与理论值(6 349 bp)相符,切胶回收目的条带,最后与Linker连接。
2.3 重组IL-35-pSectag2A真核表达载体的鉴定。
以HES、HEA为引物PCR鉴定重组载体pSectag2A-EBI3,结果示图4中2、4、5泳道显示一条带,大小与理论值(642 bp)一致,表明pSectag2A与目的片段EBI3连接成功。用测序引物T7/BGH对pSectag2A质粒进行双向测序,测序结果与NCBI中GenBank上的序列(p35 NM-000882,EBI3 NM-005725)完全一致。
3 讨论
1997年,EBI3-p35由Devergne首次发现[1],在2007年正式被命名为IL-35,后者是IL-12家族的一员,属于I型细胞因子超家族成员,由α链p35和β链EBI3组成[4-5]。IL-35主要由Treg、调节性B细胞(Breg)细胞分泌[3]。在Treg表面,IL-35的信号通路由信号传导及转录激活因(STAT)STAT1-STAT4,STAT4-STAT4,STAT1-STAT1介导[6];而在Breg表面,则由STAT1-STAT3介导[7]。
研究发现,IL-35是具有重要免疫调节功能的细胞因子[8],通过增强Treg细胞的功能,抑制Th17细胞的增殖分化,发挥免疫抑制功能,抑制炎症反应、防止过度的自身免疫反应的发生[9]。由此可见,IL-35在诸多疾病中,均具有不容小觑的作用。本实验成功构建了pSectag2A-IL-35真核表达载体,为体内外进一步研究IL-35的功能和作用机制奠定了基础。
参考文献
[1] Devergne O,Birkenbach M,Kieff E.Epstein-Barr virus-induced gene 3 and the p35 subunit of interleukin 12 form a novel heterodimeric hematopoietin[J].Proc Natl Acad Sci USA,1997,94(22):12041-12046.
[2]石银月,武桂萍,颜学兵.IL-12细胞因子家族的新成员—IL-35[J/OL].中华实验和临床感染病杂志:电子版,2012,2(6):159-161.
[3] Collison L W,Workman C J,Kuo T T,et al.The inhibitory cytokine IL-35 contributes to regulatory T-cell function[J].Nature,2007,450(7169):566-569.
[4]王志会.IL-35在免疫相关疾病中的研究进展[J].华中科技大学学报:医学版,2015,2(44):239-242.
[5]黄崇标,田野,崔焱,等.白细胞介素35的在肿瘤发展中的作用[J].中国肺癌杂志,2016,19(4):230-235.
[6]陈爽,鞠晓红,郑文彧,等.IL-35与人类疾病关系的研究进展[J].免疫学杂志,2014,7(30):645-649.
[7]蒋瑜,张松照.细胞因子IL-35研究进展[J].国际检验医学杂志,2017,12(38):1639-1641.
[8]姚國泰,陈励.IL-35与人类自身免疫性疾病的关系[J].细胞与分子免疫学杂志,2016,32(7):993-999.
[9]韩丽,李培,武伏旭.IL-35在肿瘤中的研究进展[J].免疫学杂志,2018,10(34):906-911.
(收稿日期:2019-01-08) (本文编辑:何玉勤)

